
1
Министерство образования Республики Беларусь
УО МОГИЛЁВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ
Кафедра химии
КОНТОЛЬНЫЕ ЗАДАНИЯ ПО КУРСУ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Методические указания для студентов заочной формы обучения технологических специальностей
Могилёв 2004
2
УДК 54
Рассмотрены и утверждены на заседании кафедры химии МГУП.
Протокол № от 2004 г.
Автор |
доцент Н. И. Сухарева |
Рецензент |
профессор В.В. Ясинецкий |
© Могилёвский государственный университет продовольствия
|
|
3 |
|
|
|
СОДЕРЖАНИЕ |
|
ВВЕДЕНИЕ |
4 |
||
1 |
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
5 |
|
1.1 |
Вопросы к контрольному заданию |
9 |
|
1.2 |
Пример решения контрольного задания (задача №16) |
10 |
|
2 |
РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ |
12 |
|
2.1 |
Вопросы к контрольному заданию |
13 |
|
2.2 |
Пример решения контрольного задания (задача №32) |
14 |
|
3 |
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ |
17 |
|
3.1 |
Вопросы к контрольному заданию |
18 |
|
3.2 |
Пример решения контрольного задания (задача №48) |
19 |
|
4 |
ОБМЕННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ. |
|
|
ГИДРОЛИЗ СОЛЕЙ |
23 |
||
4.1 |
Вопросы к контрольному заданию |
24 |
|
4.2 |
Пример решения контрольного задания (задача № 64) |
26 |
|
5 |
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ |
28 |
|
6 |
ПРИЛОЖЕНИЕ А (СПРАВОЧНОЕ) |
30 |
|
7 |
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ |
31 |
|
4
ВВЕДЕНИЕ
Впроцессе изучения курса общей и неорганической химии студент заочной формы обучения технологических специальностей должен выполнить две контрольные работы. Настоящие методические указания предназначены для выполнения первой контрольной работы.
Вданном пособии рассматриваются четыре основных раздела курса общей и неорганической химии: 1) «Основные классы неорганических соединений»; 2) «Способы выражения состава растворов»; 3) «Диссоциация воды. Водородный и гидроксидный показатели»; 4) «Обменные реакции. Гидролиз солей».
Контрольные задания к каждой из четырех тем включают: 1) краткую теоретическую информацию по данной теме; 2) вопросы, общие для всех вариантов; 3) конкретные задания для данного варианта (всего 16 вариантов по теме);
4)пример решения типового задания.
Краткая информация по каждой теме перед контрольным заданием начинается цифровой ссылкой на номер соответствующего вопроса к экзамену.
Контрольную работу рекомендуется выполнять в следующей последовательности:
1 На установочной сессии каждому студенту необходимо получить у лектора потока номера соответствующих задач.
2 Перед решением задач соответствующего раздела необходимо изучить по учебным пособиям (1) и (2) материал, относящийся к данному разделу.
3 Проработать краткое изложение материала изучаемого раздела по данному методическому указанию. Обратить внимание на термины, выделенные в тексте.
4 Попытаться решить самостоятельно последний вариант каждого раздела. При затруднениях проработать и понять суть приведённого решения этого варианта.
5 Решить задачи своего варианта. В конце работы привести список использованной литературы. Работа должна быть подписана студентом.
6 При получении оценки «не зачтено» исправить ошибки в этой же тетради и выслать работу на рецензирование повторно. Работу над ошибками следует выполнять в конце тетради.
7 Контрольная работа, выполненная не по своему варианту, не проверяется и не зачитывается.
5
1 ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1Оксиды – химические соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления (-2). Название оксида включает слово «оксид», название элемента в родительном падеже, степень окисления элемента. Например, CrO3 - оксид хрома (VI). Большинство оксидов реагируют с кислотами или основаниями с образованием солей. Такие оксиды называют солеобразующими. Несолеобразующие оксиды (СО, NO, N2O, SiO) не реагируют с водой, кислотами и основаниями с образованием солей. Гидратной формой оксида называется продукт взаимодействия его с водой. Если оксиды с водой не взаимодействуют, то соответствующие им гидратные формы (гидроксиды), можно получить косвенным путём. По характеру гидратных форм солеобразующие оксиды делятся на три типа: основные, кислотные и амфотерные.
Основные оксиды в качестве гидратных форм образуют основания с общей формулой Ме (ОН)n, где n – степень окисления металла. Основные оксиды образуют только металлы (все металлы 1А и 2А групп кроме Ве, некоторые другие металлы со степенью окисления +1 и +2). Основные оксиды реагируют с кислотами и кислотными оксидами.
Например,
СаО + СО2 → СаСО3 |
NiO + Н2SO4 → NiSO4+ Н2O. |
Кислотные оксиды в качестве гидратных форм образуют оксокислоты. Неметаллы, а также металлы со степенью окисления выше +4, образуют только кислотные оксиды. Кислотные оксиды реагируют с основаниями и основными оксидами.
Например,
CrO3 + 2NaOH → Na2CrO4+ Н2O P2O5 + 3CaO → (Ca)3(PO4)2
Гидратными формами амфотерных оксидов являются амфотерные гидроксиды, которые проявляют свойства, как кислот, так и оснований. Амфотерные оксиды образуют Ве, большинство р-металлов, цинк, хром и некоторые другие металлы. Амфотерные оксиды реагируют и с кислотами, и с основаниями, а также с кислотными и основными оксидами.
Например,
Al2O3 + 2NaOH → 2NaAlO2+ Н2O |
Al2O3 + 3Н2SO4 → Al2 (SO4)3+ 3Н2O. |
Al2O3 + СаО → Сa (AlO2)2 |
Al2O3 + 3SiO2→ Al2 (SiO3)3 |
2Кислоты – химические соединения, которые в водных растворах диссоциируют с образованием катионов водорода. Кислоты классифицируют: 1)по основности; 2) по силе электролита; 3) по содержанию кислорода; 4) по содержанию молекул воды (мета - и ортокислоты).
Основность определяется числом атомов водорода в молекуле кислоты, способных замещаться на металл. Например, фосфорная кислота H3РO4 – трёхосновная, серная кислота – двухосновная. По силе электролита различают сильные и слабые кислоты. Сильные кислоты диссоциируют нацело, т. е. нахо-
6
дятся в водном растворе только в виде ионов. Слабые кислоты диссоциируют частично. Напомним, что диссоциацией называется распад на ионы под влиянием растворителя (воды). Диссоциация сильных кислот (на примере серной) не-
обратима и идёт в одну ступень:
Н2SO4 2H+ + SO42
Диссоциация слабых кислот протекает обратимо и для многоосновных кислот ступенчато. Например, ортофосфорная кислота - слабый электролит и диссоциирует в три ступени:
1)H3РO4 ↔ H2РO4 + H+;
2)H2РO4 ↔ HРO42 + H+;
3)HРO42 ↔ РO43 + H+.
Следствием такой диссоциации является возможность образования кислых солей.
По содержанию или отсутствию кислорода в составе молекулы различают кислородсодержащие (оксокислоты) (Н2SO4) и бескислородные кислоты (Н2S). Название оксокислоты включает название кислотообразующего элемента с окончанием – ная или – вая, если элемент находится в высшей степени окисления, и с окончанием – истая, если степень окисления элемента более низкая. Например, НNO3 – азотная кислота, НNO2 – азотистая кислота. Название бескислородной кислоты содержит название кислотообразующего элемента с добавлением слова «водородная». Например, Н2S – сероводородная кислота.
Мета - и ортокислоты различаются содержанием молекул воды. Ортокислоты содержат на одну молекулу воды больше метакислот. Например, метакремниевая кислота - Н2SiO3 , ортокремниевая кислота – Н4SiO4 .
Кислоты взаимодействуют со многими металлами. На практике чаще других применяют серную (Н2SO4), азотную (НNO3) и соляную (НСl) кислоты. С металлами, стоящими в ряду напряжения до водорода, разбавленные серная и соляная кислоты реагируют с выделением Н2↑.
Zn + Н2SO4 (разб.) H2↑ + ZnSO4
Металлы, стоящие в ряду напряжения после водорода, не восстанавливают газообразный водород из кислот. Концентрированная серная кислота взаимодействует с металлами за счёт окислительных свойств серы (VI):
Cu + 2Н2SO4 (конц.) CuSO4 + SO2↑+ 2Н2O
Азотная кислота любой концентрации при взаимодействии с металлами не выделяет газообразный водород. Концентрированная азотная кислота восстанавливается до оксида азота (IV):
Cu +4НNO3 (конц.) Cu (NO3)2 + 2NO2↑+ 2Н2O
Очень разбавленная азотная кислота наиболее активными металлами (Mg, Al, Zn) может восстановиться до ионов аммония:
4Mg + 10НNO3 (конц.) 4Mg (NO3)2 + NH4NO3+ 3Н2O
7
Кислоты взаимодействуют с основными оксидами и основаниями с образованием солей:
Mg(OН)2 + Н2SO4 MgSO4+ 2Н2O
Рекомендуется запомнить формулы кислот и солей, а также их названия, представленные в таблице 1.
Таблица 1 - Названия и формулы широко используемых кислот и их солей
Формулы кислот |
Названия |
ки- |
Сила ки- |
Названия со- |
Формулы со- |
|
слот |
|
слоты |
лей: |
лей: |
1 |
2 |
|
3 |
4 |
5 |
HCl |
соляная |
|
сильная |
хлориды |
FeCl3 |
H2S |
сероводородная |
слабая |
сульфиды |
Na2S |
|
H2SO3 |
сернистая |
|
слабая |
сульфиты |
K2SO3 |
H2SO4 |
серная |
|
сильная |
сульфаты |
Al2(SO4)3 |
HNO3 |
азотная |
|
сильная |
нитраты |
Fe(NO3)3 |
HNO2 |
азотистая |
|
слабая |
нитриты |
Cu(NO2)2 |
H3PO4 |
фосфорная |
|
слабая |
фосфаты |
Ca3(PO4)2 |
H2CO3 |
угольная |
|
слабая |
карбонаты |
(NH4)2CO3 |
H2SiO3 |
кремниевая |
|
слабая |
силикаты |
K2SiO3 |
CH3COOH |
уксусная |
|
слабая |
ацетаты |
NaCH3COO |
3Основания – химические соединения, которые в водных растворах диссоциируют с образованием анионов гидроксильных групп. Название основания включает: слово «гидроксид», название элемента в родительном падеже, сте-
пень окисления элемента. Например, Cr(OН)3 - гидроксид хрома ( ). Основания
классифицируют:
1) по: кислотности; 2) по силе электролита. Кислотность определяется числом гидроксильных групп в молекуле основания. Однокислотные основания образуют щелочные металлы, например, гидроксид натрия NaОН. Трёхкислотное основание – гидроксид алюминия Al(ОН)3. По силе электролита различают сильные и слабые основания. Полностью диссоциируют гидроксиды металлов групп 1А и 2А (кроме бериллия и магния). Десять сильных оснований щелочных и щелочноземельных металлов хорошо растворимы в воде и называются щелочами. Все остальные основания – слабые электролиты и малорастворимые в воде соединения.
Диссоциация сильного основания необратима и для гидроксида бария, например, её записывают так:
Ba (ОН)2 → Ba2+ + 2OH .
Диссоциацию слабого основания записывают как равновесное превращение, например, для гидроксида марганца ( ):
Mn(OH)2 ↔ MnOH+ + OH ;
MnOH+ ↔ Mn2+ + OH .
|
8 |
Основания взаимодействуют с кислотными оксидами и кислотами: |
|
Ca (OН)2 + СО2 → CaСО3↓ + Н2О |
Ba(ОН)2 + Н2SO4 → BaSO4↓+ Н2O. |
4Соли – химические соединения, которые в водных растворах диссоциируют с образованием катионов металла и анионов кислотного остатка. Различают средние, кислые и основные соли.
Средняя соль – это продукт полного замещения атомов водорода в молекуле кислоты на другие катионы и полного замещения гидроксильных групп в молекуле основания на другие анионы. Название средней соли включает название аниона, к которому добавляется название катиона в родительном падеже с
указанием степени окисления металла. Например, NiSO4 – сульфат никеля ( ), CuCl2 – хлорид меди ( ). Название аниона солей бескислородных кислот имеет
окончание – ид (S2 - сульфид – ион). Название аниона солей кислородсодержащих кислот имеет окончание – ат, если кислота образована элементом в высшей степени окисления или окончание – ит, если кислота образована элементом в более низкой степени окисления. Например, NO3 – нитрат-анион,
NO2 – нитрит-анион. Например, NiSO4 – сульфат никеля ( ), CuCl2 – хлорид ме-
ди ( ).
Кислая соль – это продукт неполного замещения атомов водорода в молекуле кислоты другими катионами. Название кислой соли строится по тому же принципу, что и средней, однако перед названием аниона добавляют сокращённое латинское название атома водорода: «гидро». Например, Ca(НСО3)2 – гидрокарбонат кальция, Al(Н2РO4)3 - дигидрофосфат алюминия.
Основная соль – это продукт неполного замещения гидроксильных групп в молекуле основания анионами кислотного остатка. Название основной соли включает сокращённое название гидроксильной группы «гидроксо», которое ставится перед названием металла. Например, (CuОН)2СO3 –карбонат гидроксомеди, Al(ОН)2Cl –хлорид дигидроксоалюминия. Все соли – сильные электролиты. В кислых и основных солях остатки кислот или оснований могут диссоциировать по типу слабого электролита. Например, приведём уравнения диссоциации средней соли (1), кислой соли (2) и основной соли (3):
CuCl2 → Cu2+ + 2Cl
Ca (НСО3)2→ Ca2+ + 2 НСО3 .
НСО3 ↔ Н+ + СО32 .
(CuОН)2СO3 → CuОН+ + СО32 . CuОН+ ↔Cu2+ + ОН .
Химические свойства солей очень многообразны:
1)участие в обменных процессах с образованием осадков, газов, или слабых электролитов (гидролиз, комплексообразование);
2)окислительно–восстановительные реакции;
4) термическое разложение солей.
Остановимся подробнее на десяти типичных способах получения солей:
9
1) взаимодействие простых веществ: металла и неметалла:
Mg + Cl2 → MgCl2
2) взаимодействие кислотного и основного оксида:
CaO + СО2 → CaСО3
3) взаимодействие кислоты и основания:
НCl + NaOH → NaCl+ Н2O.
4) взаимодействие кислоты и основного оксида:
Н2SO4 + CaO → СaSO4↓+ Н2O.
5) взаимодействие основания и кислотного оксида:
Ba(ОН)2 + СО2 → ВaСО3↓ + Н2O.
6) взаимодействие активного металла с кислотой:
Mg + Н2SO4 → MgSO4 + H2↑
7) взаимодействие активного металла с солью, образованной менее активным металлом
Zn + CuSO4 → Cu + ZnSO4
8) взаимодействие двух солей с образованием соли, нерастворимой в воде:
Na2SO4 + Ba(NO3)2 → ВaSO4↓ + 2NaNO3.
9) взаимодействие соли с кислотой:
Ba(NO3)2 + Н2SO4 → ВaSO4↓ + 2НNO3.
10) взаимодействие соли с основанием:
Na2SO4 + Ba(ОН)2 → BaSO4↓ + 2NaОН.
1.1 Вопросы к контрольному заданию
а) Напишите формулы кислоты и основания, названия которых приведены в разделе (а) Вашего варианта. Укажите силу этих электролитов; напишите уравнения их электролитической диссоциации в водном растворе. Составьте формулы средних, кислых и основных солей, которые соответствуют заданным кислоте и основанию; назовите эти соли по систематической номенклатуре. Напишите уравнения электролитической диссоциации этих солей в водном растворе.

10
б) Напишите уравнения реакций получения солей, указанных в разделе (б) Вашего варианта, взаимодействием: основного и кислотного оксидов; основания и кислоты. Изобразите графические формулы этих солей.
Таблица 2 - Задания к разделу: «Основные классы неорганических соединений»
№ за- |
а) |
б) |
дач |
|
Сульфат цинка и |
1 |
Ортофосфорная кислота и |
|
|
гидроксид кальция |
перманганат калия |
2 |
Ортомышьяковая кислота и |
Нитрат магния и |
|
гидроксид хрома ( ) |
силикат натрия |
3 |
Серная кислота и |
Карбонат кальция и |
|
гидроксид железа ( ) (3) |
сульфат хрома ( ) |
4 |
Ортокремниевая кислота и |
Ортофосфат калия и |
|
гидроксид магния |
сульфат железа ( ) |
5 |
Серная кислота и |
Хромат калия и |
|
гидроксид алюминия |
сульфат меди ( ) |
6 |
Ортофосфорная кислота и |
Нитрат кальция и |
|
гидроксид бария |
метаалюминат калия |
7 |
Серная кислота и |
Сульфат алюминия и |
|
гидроксид алюминия |
карбонат натрия |
8 |
Сернистая кислота и |
Метаалюминат бария и |
|
гидроксид бария |
нитрит магния |
9 |
Ортофосфорная кислота и |
Силикат калия и |
|
гидроксид хрома ( ) |
сульфат железа ( ) |
10 |
Ортомышьяковая кислота и |
Нитрат алюминия и |
|
гидроксид железа ( ) |
ортофосфат цинка |
11 |
Угольная кислота и |
Хромат натрия и |
|
гидроксид кальция |
нитрат хрома ( ) |
12 |
Ортокремниевая кислота и |
Ортофосфат калия и |
|
гидроксид бария |
сульфат кобальта ( ) |
13 |
Сернистая кислота и |
Карбонат калия и |
|
гидроксид магния |
гипохлорит алюминия |
14 |
Угольная кислота и |
Нитрат бария и |
|
гидроксид бария |
ортофосфат кальция |
15 |
Ортофосфорная кислота и |
Перманганат натрия и |
|
гидроксид алюминия |
силикат магния |
16 |
Ортомышьяковая кислота и |
Ортофосфат кальция |
|
гидроксид магния |
и гипохлорит бария |
11
1.2 Пример решения контрольного задания (задача №16)
Задание (а)
Напишите формулы ортомышьяковой кислоты и гидроксида магния. Укажите силу этих соединений как электролитов. Напишите уравнения электролитической диссоциации этих соединений в водном растворе. Составьте формулы средних, кислых и основных солей, которые соответствуют ортомышьяковой кислоте и гидроксиду магния. Назовите эти соли по систематической номенклатуре. Напишите уравнения электролитической диссоциации этих солей в водном растворе.
Ответ:
Гидроксид магния как электролит относится к слабым основаниям и диссоциирует в две ступени:
Mg(OH)2 ↔ MgOH+ + OH ;
MgOH+ ↔ Mg2+ + OH .
Ортомышьяковая кислота является слабым электролитом и диссоциирует в три ступени:
H3AsO4 ↔ H2AsO4 + H+;
H2AsO4 ↔ HAsO42 + H+;
HAsO42 ↔ AsO43 + H+.
Гидроксиду магния и ортомышьяковой кислоте соответствует 4 соли:
1)средняя соль - ортоарсенат магния Mg3(AsO4)2;
2)основная соль - ортоарсенат гидроксомагния (MgOH)3AsO4;
3)кислая соль - дигидроортоарсенат магния Mg(H2AsO4)2;
4)кислая соль - гидроортоарсенат магния MgHAsO4
Уравнения электролитической диссоциации солей в водном растворе.
Mg3(AsO4)2 → 3Mg2+ + 2AsO43
(MgOH)3AsO4 → 3MgOH+ + AsO43
MgOH+ ↔ Mg2+ + OH .
Mg (H2AsO4)2→ Mg2+ + H2AsO4
H2AsO4 ↔ HAsO42 + H+;
HAsO42 ↔ AsO43 + H+.
MgHAsO4 → Mg2+ + HAsO42
HAsO42 ↔ AsO43 + H+.
Задание (б)
Напишите уравнения реакций получения ортофосфата кальция и гипохлорита бария взаимодействием:
1)основного и кислотного оксидов;
2)основания и кислоты. Изобразите графические формулы солей.
Ответ:
Ортофосфат кальция (Ca)3(PO4)2 можно получить:
12
1) взаимодействием оксида кальция CaO (основного оксида) и оксида фосфора
(5) P2O5 (кислотного оксида). Степени окисления элементов в оксидах должны соответствовать их степеням окисления в солях.
3CaO + P2O5 → (Ca)3(PO4)2
2) взаимодействием гидроксида марганца (2) и ортофосфорной кислоты:
3Ca (OН)2 + 2Н3PO4 → (Ca)3(PO4)2 + 6Н2О
Сульфит бария ВaSO3 можно получить:
1) взаимодействием оксида бария BaO (основного оксида) и оксида серы (IV) SO2 (кислотного оксида):
BaO + SO2 → ВaSO3
2) взаимодействием гидроксида бария и хлорноватистой кислоты:
Ba (OН)2 + 2НСlO → Ba (ClO)2 + 2Н2О
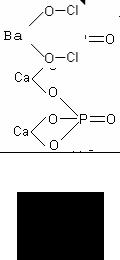
Графическая формула ортофосфата кальция (Ca)3(PO4)2
Графическая формула гипохлорита бария Ba(ClO)2
2 РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
11 Раствором называется гомогенная система переменного состава, состоящая из двух или большего числа компонентов. В истинных растворах вещества находятся в виде молекул, атомов или ионов. В пищевой технологии используются, в основном, водные растворы. Вода в таких растворах считается растворителем, а растворёнными веществами могут быть и твёрдые вещества (например, хлорида натрия), газы (например, сероводород), и жидкости (например, этиловый спирт). Масса раствора (mp) равна сумме массы растворённого вещества Х (mв(Х)) и массы воды (m H2O):
mp = mв(Х) + m(H2O) |
(1) |
На практике чаще используются два способа выражения состава растворов - массовая доля растворённого вещества и молярная концентрация раствора:
1) массовая доля растворённого вещества Х ω(Х) – отношение массы растворённого вещества (mв(Х)) к массе раствора (mp):
ω(Х) = mв(Х) • 100% / mp |
(2) |
13
Массовая доля выражается в процентах и в долях единицы. Например, 1,5%-ный раствор хлорида натрия в воде – это такой раствор, в 100г которого содержится 1,5г хлорида натрия и 98,5г воды, состав раствора можно выразить
вдолях: ω(NaCl) = 0,015
2)молярная концентрация раствора С(Х) – отношение количества растворённого вещества Х (n) в молях к объёму раствора (Vp) в литрах:
С(Х) = n(Х) / Vp |
(3) |
Наряду с размерностью (моль/л) допускается обозначение М. Так, 0.1М Н2SO4 означает раствор, в одном литре которого содержится 0,1 моль серной кислоты, т.е. С (Н2SO4) = 0.1моль/л.
Для перевода одного вида концентрации в другой рекомендуем выбрать произвольную массу или объём раствора и произвести соответствующие расчёты. Например, необходимо определить молярную концентрацию 12%-ного раствора хлорида натрия (плотность раствора равна 1,086г/мл). Возьмём 100г 12%- ного раствора хлорида натрия. Молярную концентрацию раствора рассчитываем по формуле (3): С(Х) = n(Х) / Vp. Количество вещества хлорида натрия n(NaCl) в 100г раствора найдём, используя формулы
n(Х) = mв(Х) / М(Х), |
(4) |
mв(Х) = ω(Х) mp/100%, |
(5) |
где М(Х) – молярная масса растворённого вещества, в данном случае NaCl. Объём раствора (Vp) определим, используя формулу
(Vp) = mp/ρ, |
(6) |
где ρ – плотность раствора.
Тогда, mв(NaCl) = ω(NaCl) • mp / 100% = 12% • 100г / 100% = 12г. n(NaCl) = mв (NaCl) / М(NaCl) = 12г / 58г/моль = 0,207моль.
Vp = mp / ρ = 100г / 1.086г/мл = 92,08мл.
С(NaCl) = n(NaCl) / Vp = 0,207моль / 0,092л = 2.25 моль/л.
Таким образом, молярная концентрация 12%-ного раствора хлорида натрия составляет 2.25 моль/л
2.1 Вопросы к контрольному заданию
а) Определите массовую долю растворённого вещества и его молярную концентрацию при смешении двух растворов, указанных в пункте (а) Вашего варианта. Плотности всех растворов считать равными 1г/мл.
б) Вычислите массу кристаллогидрата и объём воды, которые необходимы для приготовления раствора, указанного в пункте (б) Вашего варианта. Массовая доля дана по безводной соли. Плотности растворов указаны в приложении А.
в) Определите объём 30%-ного раствора серной кислоты (ρ = 1,220г/мл) и объём воды, которые необходимы для приготовления раствора, указанного в пункте (в) Вашего варианта. Плотности разбавленных растворов указаны в приложении А.
14
Таблица 3 - Задания к разделу «Способы выражения состава растворов»
№ задачи |
а) |
|
|
|
б) |
|
в) |
1 |
2 |
|
3 |
|
|
|
4 |
17 |
100мл 6% NaCl |
и |
75мл 2% CuSO4 |
из |
80мл 6% Н2SO4 |
||
|
350мл 1% NaCl |
|
CuSO4•5 H2O |
|
|
|
|
18 |
90мл 6% KBr и 370мл |
90мл 4% Al2(SO4)3 |
из |
100мл 8% Н2SO4 |
|||
|
10% KBr |
|
Al2(SO4)3•18 H2O |
|
|
||
19 |
85мл 10% NH4Cl |
и |
80мл |
6% |
BaCl2 |
из |
95мл 5% Н2SO4 |
|
500мл 2% NH4Cl |
|
BaCl2•2 H2O |
|
|
|
|
20 |
100мл 3% Na2SO4 и |
|
100мл 2% CuSO4 |
из |
85мл 10% Н2SO4 |
||
|
800мл 4% Na2SO4 |
|
CuSO4•5 H2O |
|
|
|
|
21 |
90мл 1% NaCl и 200мл |
100мл |
3% Na2SO4 |
из |
100мл 4% Н2SO4 |
||
|
2% NaCl |
|
Na2SO4•10 H2O |
|
|
||
22 |
95мл 2% KBr и 185мл |
95мл |
2% |
BaCl2 |
из |
90мл 8% Н2SO4 |
|
|
10% KBr |
|
BaCl2•2 H2O |
|
|
|
|
23 |
85мл 10% NH4Cl |
и |
85мл 2% Na2SO4 |
из |
80мл 9% Н2SO4 |
||
|
160мл 8% NH4Cl |
|
Na2SO4•10 H2O |
|
|
||
24 |
90мл 4% Na2SO4 |
и |
85мл 6% CuSO4 из |
85мл 6% Н2SO4 |
|||
|
80мл 6% Na2SO4 |
|
CuSO4•5 H2O |
|
|
|
|
25 |
95мл 8% NaCl и 190мл |
95мл 4% BaCl2 из BaCl2•2 |
100мл 7% Н2SO4 |
||||
|
4% NaCl |
|
H2O |
|
|
|
|
26 |
100мл 8% KBr и 950мл |
80мл |
3% Na2SO4 |
из |
90мл 12% Н2SO4 |
||
|
2% KBr |
|
Na2SO4•10 H2O |
|
|
||
27 |
80мл 10% NH4Cl |
и |
100мл 2% Al2(SO4)3 |
из |
95мл 8% Н2SO4 |
||
|
400мл 6% NH4Cl |
|
Al2(SO4)3•18 H2O |
|
|
||
28 |
80мл 6% Na2SO4 и |
|
95мл 4% Na2SO4 |
из |
100мл 9% Н2SO4 |
||
|
700мл 2% Na2SO4 |
|
Na2SO4•10 H2O |
|
|
||
29 |
95мл 10% NaCl и 290мл |
85мл |
6% Al2(SO4)3 |
из |
80мл 5% Н2SO4 |
||
|
1% NaCl |
|
Al2(SO4)3 •18 H2O |
|
|
||
30 |
100мл 6% NH4Cl |
и |
100мл |
7% Na2SO4 |
из |
85мл 9% Н2SO4 |
|
|
650мл 1% NH4Cl |
|
Na2SO4•10 H2O |
|
|
||
31 |
90мл 4% KBr и 100мл |
90мл |
4% |
CuSO4 |
из |
100мл 4% Н2SO4 |
|
|
8% KBr |
|
CuSO4•5 H2O |
|
|
|
|
32 |
300мл 2% NaNO3 |
и |
100мл |
2% |
BaCl2 |
из |
150мл 9% Н2SO4 |
|
500мл 1% NaNO3 |
|
BaCl2•2 H2O |
|
|
|
|
2.2 Пример решения контрольного задания (задача №32)
Задание а)
Определите массовую долю (ω3) и молярную концентрацию (С3) вещества в растворе, полученном при сливании 300мл (V1) 2% (ω1) NaNO3 и 500мл (V2) 1% (ω2) NaNO3. Плотности всех растворов считать равными 1г/мл.
Введём необходимые обозначения:
Массовая доля вещества в первом растворе NaNO3 ω1 = 2%. Объём 2%-ного раствора NaNO3: V1 = 300мл.
Массовая доля вещества во втором растворе NaNO3 ω2 = 1%.
15
Объём 1%-ного раствора NaNO3 V2 = 500мл. Плотности растворов ρ = 1,0г/мл. Определить:
Массовую долю вещества в смешанном растворе ω3, %.
Молярную концентрацию вещества в смешанном растворе С3, моль/л.
Решение:
Массовую долю (ω3) долю вещества в смешанном растворе найдём по формуле (2)
ω3 = mв3• 100% / mp3
Масса вещества (NaNO3) в смешанном растворе (mв3) равна сумме масс вещества в первом и втором растворах (mв1, mв2):
mв3 = mв1 + mв2 = ω1•mр1 / 100% + ω2•mр2 / 100% =
=ω1•V1•ρ1 / 100% + ω2•V2•ρ2 / 100% =
=2%•300мл•1г/мл / 100% + 1%•500мл•1г/мл / 100% = 6г + 5г = 11г.
Масса смешанного раствора (mp3) равна сумме масс первого и второго растворов (mр1, mр2):
mв3 = mв1 + mв2 = V1•ρ1 + V2•ρ2 =
= 300мл•1 г/мл + 500мл•1г/мл= 300 г + 500 г = 800 г.
Определим массовую долю вещества в смешанном растворе (ω3):
ω3 = mв3• 100% / mp3 = 11 г•100% / 800 г = 1,38%
Молярную концентрацию вещества в растворе рассчитаем по формуле (3)
– С3= n3 / V3. Количество вещества нитрата натрия (n3) и объём смешанного раствора (V3) найдём, используя формулы (4) и (6):
n3 = mв3 / М = 11г / 85 г/моль = 0.13 моль V3 = mp3 / ρ = 800 г / 1.0 г/мл = 800мл. = 0.8 л
С3 = n3(NaNO3) / V3 = 0,13 моль / 0.8л = 0,16 моль/л. Ответы: ω3 = 1,38%; С3 = 0,16 моль/л.
Задание б)
Вычислите массу кристаллогидрата BaCl2•2H2O и объём воды, которые необходимы для приготовления 100мл 2%-ного раствора BaCl2.
Введём необходимые обозначения: Массовая доля BaCl2 в растворе BaCl2: ω = 2%. Объём 2%-ного раствора BaCl2: V = 100 мл.
Молярная масса кристаллогидрата BaCl2•2H2O М(BaCl2•2H2O) = 244 г/моль.
Молярная масса безводной соли BaCl2 М(BaCl2) = 208 г/моль Плотность раствора BaCl2 ρ = 1,016 г/мл (таблица А.1, Приложение А) Плотность воды ρ(H2O) = 1,0 г/мл.
Масса безводной соли BaCl2 m(BaCl2), г. Масса раствора BaCl2 mр, г.
