
- •Химические реакции метана
- •Цис-транс-номенклатура
- •I. Электрофильное присоединение по двойной связи
- •II. Радикальное гидробромирование алкенов (эффект Хараша)
- •Химические реакции непредельных углеводородов
- •Окисление алкенов без разрыва по двойной связи
- •Окисление алкенов с разрывом молекулы по двойной связи
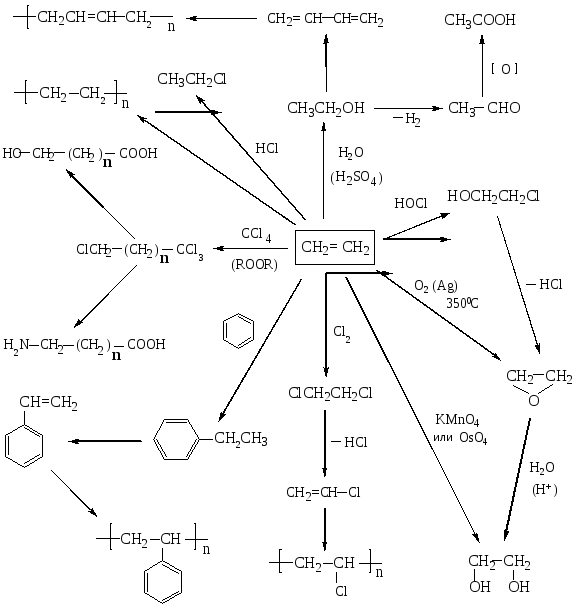
- •Промышленное использование этилена
- •Озонолиз бензола и его производных
- •Правило ориентации в реакциях электрофильного замещения в ряду производных нафталина
- •Химические реакции нафталина
- •Химические реакции антрацена и фенантрена
Промышленное использование этилена
Лекция № 2
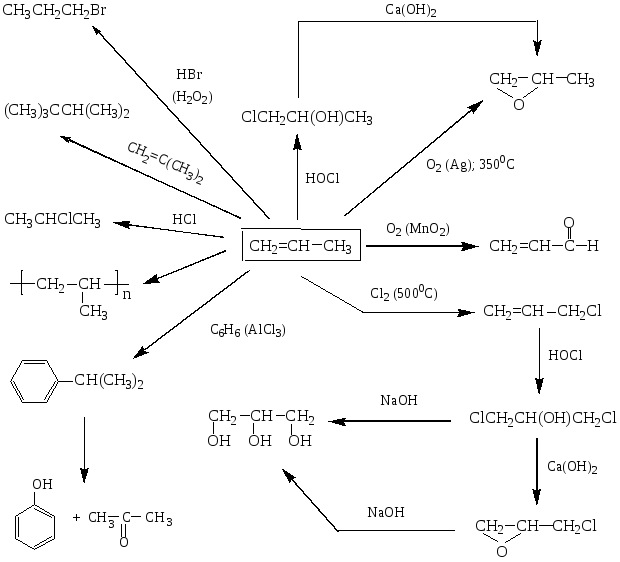
ПРОМЫШЛЕННОЕ ИСПОЛЬЗОВАНИЕ ПРОПИЛЕНА
Лекция № 2
ПОЛИМЕРИЗАЦИЯ
Полимеризация процесс получения высокомолекулярных соединений (полимеров), при котором макромолекула образуется путем последовательного присоединения молекул низкомолекулярного ненасыщенного вещества (мономера) к активному центру, находящемуся в конце растущей цепи. Полимеризация алкенов и диенов протекает по схеме:
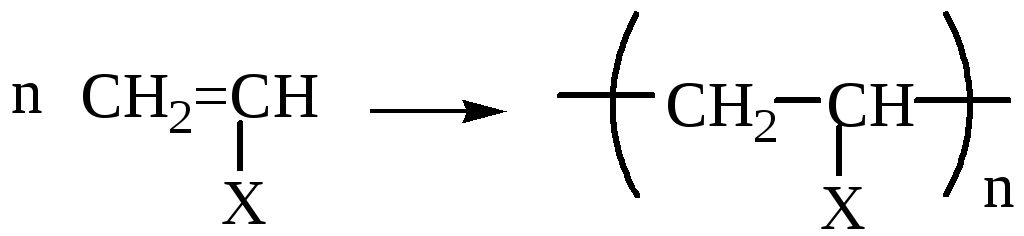 ,
где
n
степень полимеризации;
,
где
n
степень полимеризации;
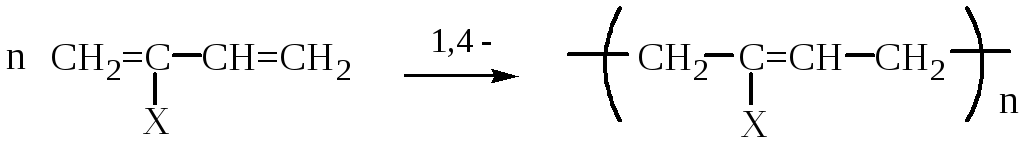
СОПОЛИМЕРИЗАЦИЯ
В сополимеризации участвуют два различных мономера:
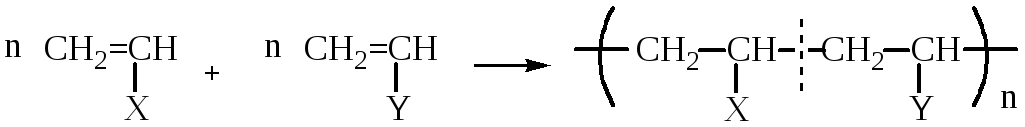
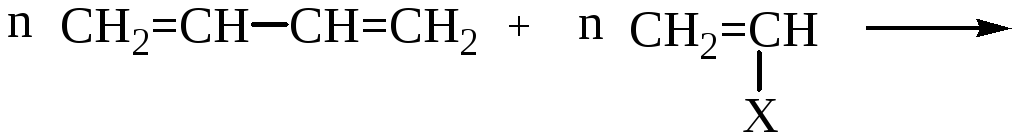
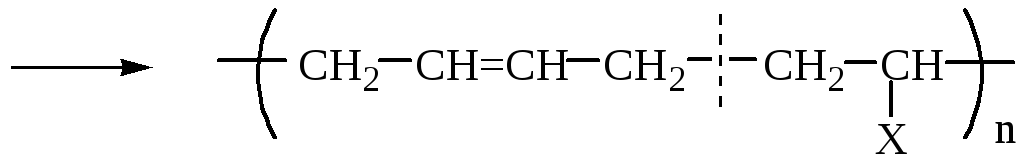
Лекция № 2
МЕХАНИЗМЫ ПРОЦЕССОВ ПОЛИМЕРИЗАЦИИ
РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ ХЛОРВИНИЛА
![]()
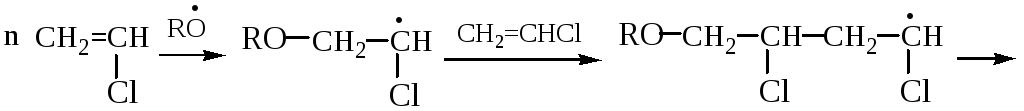
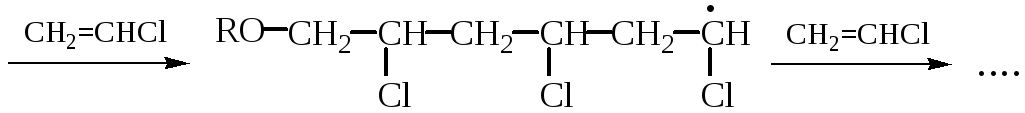
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ ПРОПИЛЕНА (в прис. H2SO4)
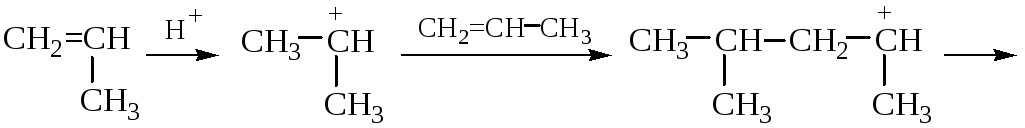
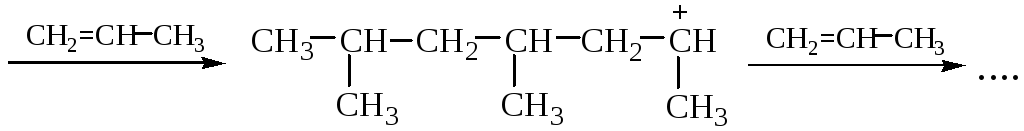
АНИОННАЯ ПОЛИМЕРИЗАЦИЯ АКРИЛОНИТРИЛА
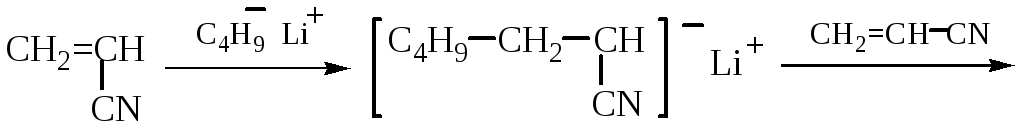
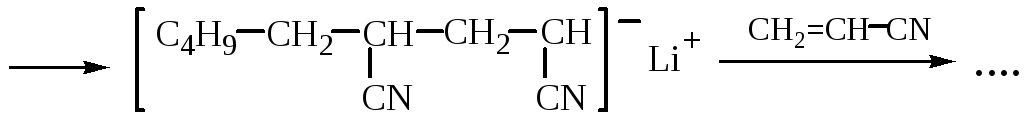
Лекция № 2
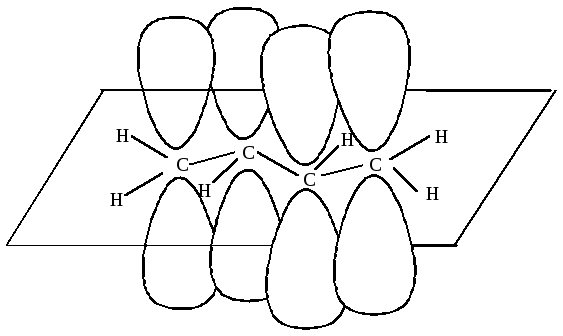
1,2- и 1,4-ПРИСОЕДИНЕНИЕ К БУТАДИЕНУ-1,3
![]()
Двойные связи дивинила реагируют не каждая сама по себе, а как единая -система; атака мезомерного катиона нуклеофилом Вr приводит к продуктам 1,2- и 1,4-присоединения, поскольку именно второй и четвертый атомы углерода сопряженной системы двойных связей несут в этом катионе положительный заряд:
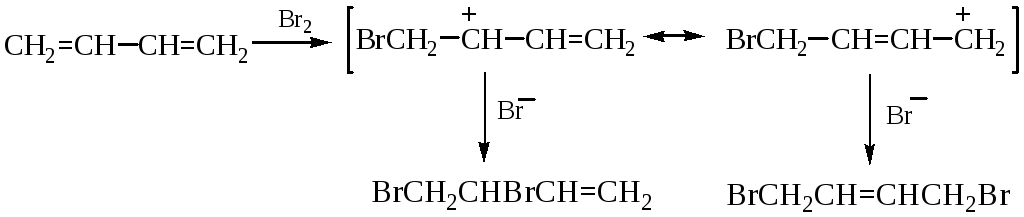
Лекция № 2
АЛКИНЫ
МЕТОДЫ СИНТЕЗА АЛКИНОВ
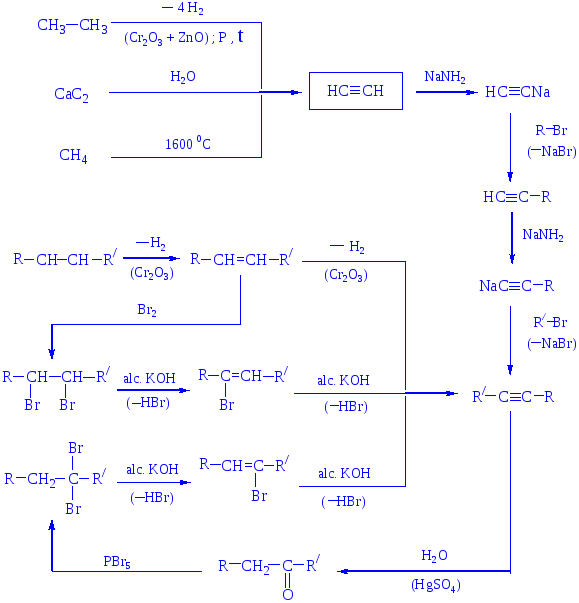
Лекция № 2
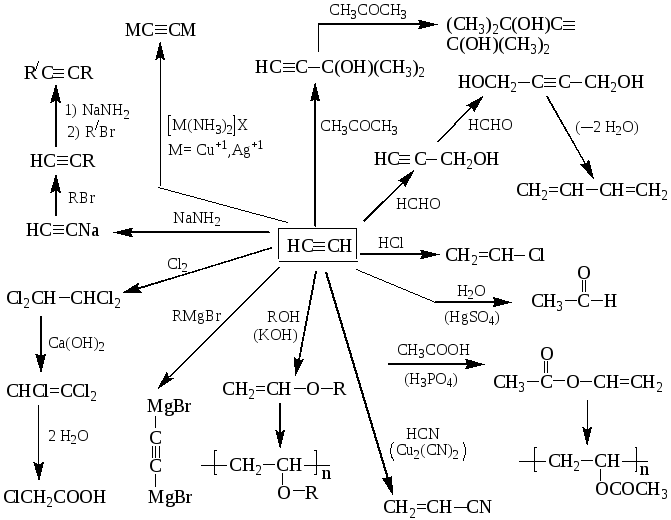
АЦЕТИЛЕН
НС≡СН, этин
Получение – взаимодействие карбида кальция с водой
СaC2 + 2 H2O → Ca(OH)2 + НС≡СН
пиролиз или электрокрекинг природного газа (1500 ºС)
2 CH4 → НС≡СН + 3 H2
Димеризация ацетилена - дает винилацетилен;
линейная тримеризация – дивинилацетилен;
циклотримеризация (акт. С; р, t) – бензол.
Основные химические превращения ацетилена (реакции присоединения по тройной связи и замещение атома водорода):
Лекция № 3
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
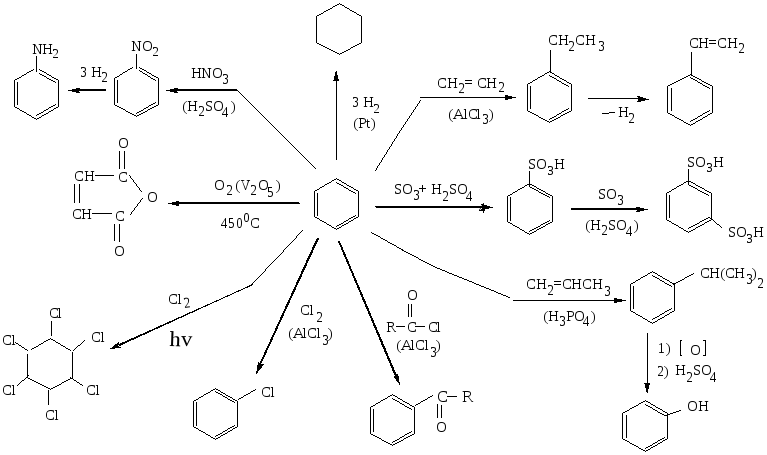
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
БЕНЗОЛ – простейший ароматический углеводород
Получение: дегидроциклизация гексана, дегидрирование циклогексана, циклотримеризация ацетилена.
Бензол легко реагирует с электрофильными реагентами (с галогенами, HNO3, H2SO4) c образованием продуктов замещения соответственно С6H5Cl, C6H5NO2, C6H5SO3H. При наличии одного заместителя в зависимости от его природы дальнейшее электрофильное ароматическое замещение может направляться преимущественно в орто- и пара-положения или же в мета-положение (см. правило ориентации). Для бензола характерна высокая термическая и химическая устойчивость.
На бензол не действуют сильные окислители (KMnO4, K2Cr2O7).
Ядро бензола может быть разрушено только в результате озонолиза (образуется глиоксаль) или окисления кислородом при 450 ºС на катализаторе V2O5 до малеинового ангидрида.
Реакции присоединения бензолу нехарактерны и немногочисленны (гидрирование до циклогексана, хлорирование на свету до гексахлорциклогексана).
.
Лекция № 3
