
- •И.А. Зеляев, о.М. Захарова, с.В. Митрофанова химия
- •Лабораторные работы
- •Содержание
- •Введение
- •Форма титульного листа лабораторного журнала для оформления
- •Лабораторная работа № 2 «Химическое равновесие»
- •Лабораторная работа № 3 «Скорость химических реакций»
- •Лабораторная работа № 4 «Приготовление раствора соды заданной концентрации»
- •Лабораторная работа № 5 «Измерение водородного показателя некоторых растворов»
- •Лабораторная работа № 6 «Исследование скорости коррозии цинка в соляной кислоте»
- •Лабораторная работа № 7 «Распознавание строительных материалов»
- •Часть II
- •603950, Н. Новгород, Ильинская, 65
Лабораторная работа № 5 «Измерение водородного показателя некоторых растворов»
Цель работы
Определить характер среды в некоторых растворах, измерить водородный показатель (рН) с помощью индикатора и рН-метра.
Теоретическая часть
Вода является очень слабым электролитом, диссоциирующим на ионы водорода и гидроксил-ионы
![]()

![]()
В чистой воде
концентрация этих ионов равна и составляет
![]() моль/л каждого. Константа диссоциации
моль/л каждого. Константа диссоциации

В любых водных
растворах произведение
![]() является
постоянным и называется ионное
произведение воды
является
постоянным и называется ионное
произведение воды
![]() .
Водородный показатель (рН) – это
отрицательный десятичный логарифм
концентрации ионов водорода
.
Водородный показатель (рН) – это
отрицательный десятичный логарифм
концентрации ионов водорода
![]()
Если
![]() - среда нейтральная,
- среда нейтральная,![]() ;
;
![]() - среда кислая,
- среда кислая,
![]() ;
;
![]() - среда щелочная,
- среда щелочная,
![]() ;
;
Известны вещества-индикаторы, которые меняют окраску в зависимости от характера среды. Например, лакмус имеет красную окраску в кислой среде (рН<7) и синюю в щелочной (pH>7).
Промышленность выпускает универсальную индикаторную бумагу, пропитанную смесью индикаторов, цвет которой изменяется в интервале рН=2÷12. более точно рН измеряют специальными приборами – рН-метрами.
Экспериментальная часть
Для измерения рН
приготовлены девять растворов электролитов
(кислот, оснований и солей) с одинаковой
молярной концентрацией
![]() моль/л. ИзмерениерН
проводим на рН-метре и контролируем
индикаторной бумагой.
моль/л. ИзмерениерН
проводим на рН-метре и контролируем
индикаторной бумагой.
Ход работы:
Включить рН-метр.
Настроить прибор по буферному раствору с точным значением рН.
Измерить рН дистиллированной воды.
Вынув электроды из сосуда с дистиллированной водой, просушить их кусочком фильтровальной бумаги. Сухие электроды погрузить в раствор HCl. Измерить значение рН.
Вынуть электроды из раствора, промыть поверхность электродов дистиллированной водой из промывалки над стаканом. Вновь просушить фильтровальной бумагой. Сухие электроды погрузить в раствор
 .
.
Аналогичные операции повторить со всеми растворами.
После измерения рН последнего раствора электроды промыть и погрузить в сосуд с дистиллированной водой. Выключить прибор из сети.
Результаты занести в таблицу.
Рассчитать по полученным значениям рН концентрацию ионов
 в каждом растворе. Результаты занести
в таблицу.
в каждом растворе. Результаты занести
в таблицу.Записать уравнения реакций, объясняющих характер среды в исследуемых реакциях.
|
Электролит С=0.01 моль/л |
рН приб. |
рН инд. |
|
Ионное или молекулярное уравнение |
|
|
7,1 |
|
10-7,1 |
|
|
|
2 |
|
10-2 |
|
|
|
3,3 |
|
10-3,3 |
|
|
|
5,6 |
|
10-5,6 |
|
|
|
6,8 |
|
10-6,8 |
|
|
|
6,9 |
|
10-6,9 |
|
|
|
10,6 |
|
10-10,6 |
|
|
|
10,95 |
|
10-10,95 |
|
|
|
12,15 |
|
10-12,15 |
|
Выводы:
Установлено, что в растворах
![]() - среда кислая;
- среда кислая;
![]() - нейтральная;
- нейтральная;
![]() - щелочная.
- щелочная.
рН растворов кислот
 и
и (соляной и уксусной) резко отличаются
друг от друга при одной и той же
концентрации электролита 0,01 моль/л.
Это объясняется тем, что уксусная
кислота продиссоциировала только на
4,3%;рН
растворов
(соляной и уксусной) резко отличаются
друг от друга при одной и той же
концентрации электролита 0,01 моль/л.
Это объясняется тем, что уксусная
кислота продиссоциировала только на
4,3%;рН
растворов
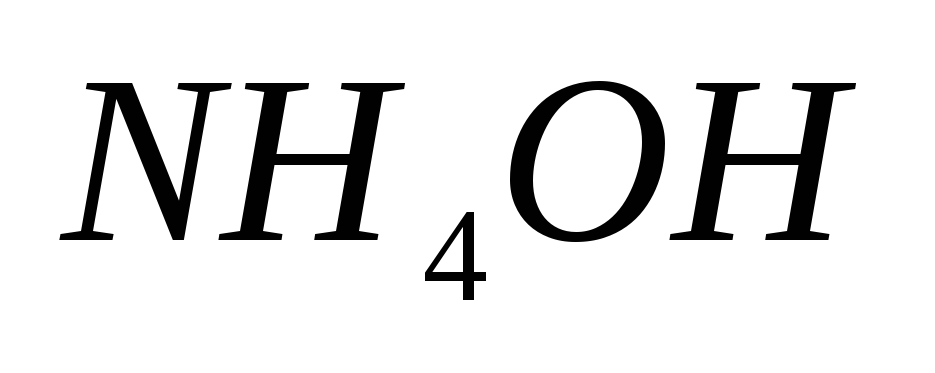 и
и так же отличаются, поскольку в растворе
гидроксид аммония диссоциирует на
4,2%; соли
так же отличаются, поскольку в растворе
гидроксид аммония диссоциирует на
4,2%; соли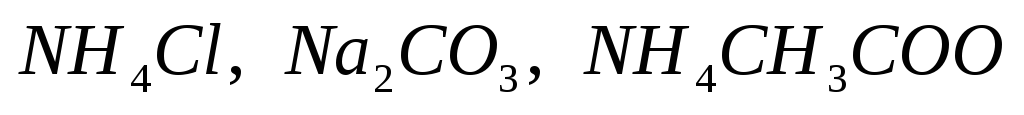 в растворах подвергаются гидролизу,
характер среды определяется более
сильной кислотой или основанием.
в растворах подвергаются гидролизу,
характер среды определяется более
сильной кислотой или основанием.








