
- •1. ИНФОРМАЦИЯ О ДИСЦИПЛИНЕ
- •2. РАБОЧИЕ УЧЕБНЫЕ МАТЕРИАЛЫ
- •2.2. Тематический план дисциплины
- •2.3. Структурно-логическая схема дисциплины3
- •2.5. Практический блок
- •2.6. Балльно-рейтинговая система оценки знаний
- •3. ИНФОРМАЦИОННЫЕ РЕСУРСЫ ДИСЦИПЛИНЫ
- •3.1. Библиографический список
- •3.2. Опорный конспект
- •РАЗДЕЛ 1. ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •3.3. Глоссарий
- •3.4. Технические и программные средства обеспечения дисциплины
- •3.5. Методические указания к выполнению лабораторных работ
- •4. БЛОК КОНТРОЛЯ ОСВОЕНИЯ ДИСЦИПЛИНЫ
- •4.1. Общие указания
- •ПРИЛОЖЕНИЯ
4. БЛОК КОНТРОЛЯ ОСВОЕНИЯ ДИСЦИПЛИНЫ
4.1. Общие указания
Блок контроля усвоения дисциплины включает:
1. Задание на контрольную работу и методические указания к ее выполнению
Контрольная работа состоит из пяти задач и трех теоретических заданий. Порядок выбора индивидуальных заданий указан в пункте «Задания на контрольную работу и методические указания к ее выполнению».
Приведены методические указания к решению каждого типа задач, включающие краткое теоретическое введение и примеры решения типовых задач, завершающиеся общей схемой решения.
2. Блок тестов текущего контроля
Приводятся 4 теста текущего контроля (по введению и каждому из разделов дисциплины). Они предлагаются студентам в качестве тренировочных (репетиционных). После работы с этими тестами можно проверить ответы – они приведены на с. 267. Завершив работу с тренировочным тестом по разделу, студент должен пройти аналогичный контрольный тест. Время ответа и число попыток ответа для контрольного теста ограничено.
3. Блок итогового контроля
Изучение дисциплины завершается сдачей зачета.
В данном блоке приводятся примеры вопросов для подготовки к зачету.
4.2.Задание на контрольную работу и методические указания
кее выполнению
4.2.1. Общие указания
Аналитическая химия является сложной синтетической наукой, находящейся на стыке многих наук и разделов техники. Прежде всего, ее развитие связано с достижениями неорганической, органической, коллоидной химии, такими разделами физической химии, как учение о химическом равновесии, химическая кинетика, электрохимия. Успехи физики в развитии спектроскопии (оптической, рентгеновской, радиочастотной) одновременно с развитием приборостроения обеспечили поистине революционные изменения в развитии спектральных методов анализа, способов регистрации аналитических сигналов. Компьютеризация как самих аналитических приборов, так и всего аналитиче-
170
ского цикла, включая интерпретацию результатов, является характерной чертой массовых промышленных анализов, то есть современной аналитической службы предприятий.
Решение разнообразных расчетных задач при изучении дисциплины «Химия,ч.3. Аналитическая химия» является одним из основных направлений учебной деятельности студента. Учебный план предусматривает для студентов очно-заочной и заочной форм обучения выполнение одной контрольной работы, которую необходимо оформить следующим образом.
Условие задачи нужно переписать в тетрадь. Формулы, которые будут использованы при решении, следует привести сначала в общем виде, после чего подставить в них численные значения и произвести вычисления. Каждое действие при решении задач должно сопровождаться объяснением. В ответе задачи необходимо указать размерность полученной величины.
Если для решения задачи необходимо построить график, то он выполняется на листе миллиметровой бумаги, который вклеивают в тетрадь.
На страницах тетради для выполнения задания следует оставить поля (3-4 см) для замечаний и указаний преподавателя. Запись условия и решение каждой задачи начинается с новой страницы. Левое поле тетради оставляется свободным для внесения необходимых исправлений и добавлений по результатам рецензирования.
Выполненную работу следует представить на кафедру для рецензии.
На титульном листе работы указать фамилию, имя и отчество студента, шифр студента, институт, филиал, специальность, форму обучения (очнозаочная, заочная). Работы без шифра не рецензируются. Вариант контрольной работы определяется по последним цифрам шифра, что указано перед каждой задачей.
Значения физико-химических констант, используемых при решении задач, приведены в рекомендуемой литературе.
Студенты, обучающиеся по заочной форме обучения, могут выслать контрольную работу по e-mail, а студенты, обучающиеся с элементами ДОТ, выполняют контрольную работу на учебном сайте СЗТУ.
171
4.2.2. Задание на контрольную работу Химические методы анализа Гравиметрический метод определения элементов Задача №1
Номер варианта выбирается по сумме двух последних цифр шифра.
1.При определении серы в чугуне его обрабатывают кислотой и выделившийся сероводород улавливают раствором соли кадмия. Обрабатывая осадок раствором сульфата меди, переводят его в сульфид меди. При прокаливании получают оксид меди, который взвешивают. Вычислить аналитический множитель для этого определения.
2.Из навески стали массой 1,0000 г получили осадок SiO2 и WO3 общей массой 0,1021 г. После обработки осадка фтороводородной кислоты и отгонки кремния масса остатка стала равной 0,0712 г. Вычислить массовую долю (%, масс.) кремния и вольфрама в стали.
3.Из 2,7000 г сплава получили 0,2004 г Al2O3 и 0,0518 г SiO2. Вычис-
лить массовую долю (%, масс.) алюминия и кремния в сплаве.
4.Из навески алюминиевого сплава массой 5,0000 г получили 0,0560 г SnO2. Вычислить массовую долю (%, масс.) олова в сплаве.
5.Из навески серного колчедана массой 0,1500 г при определении серы получили осадок BaSO4 массой 0,5155 г. Рассчитайте массовую долю (%, масс.) серы в колчедане и аналитический множитель (фактор пересчета) для этого определения.
6.Вычислить массовую долю (%, масс.) Fe3O4 в магнитном железняке, если из навески руды массой 0,5000 г получили 0,3089 г Fe2O3. Вычислить аналитический множитель (фактор пересчета) для этого определения.
7.Вычислить массовую долю (%, масс.) свинца в бронзе, если из навески образца массой 1,000 г получили 0,0430 г PbSO4 и аналитический множитель (фактор пересчета) для этого определения.
8.Для определения содержания кремния взята навеска чугуна массой 0,5000 г; полученная в результате определения масса SiO2 равна 0,0227 г. Вычислить массовую долю кремния (%, масс.) в чугуне.
9.Для определения содержания железа в руде его осаждают аммиаком в виде Fe(OH)3, который при прокаливании переходит в Fe2O3. Какой объем раствора аммиака с концентрацией c(NH3) = 1 моль/л потребуется для осаждения железа из 0,2 г руды, содержащей 20 масс. % Fe2O3?
172
10. Какую навеску сплава, содержащего около 65 масс. % Pb, требуется взять для анализа, если свинец определяют в виде PbSO4, а масса осадка около
0,5 г?
11. В анализируемой пробе шлака массой 0,2 г содержится примерно 40 масс. % СаО. Для точного определения его содержания использован метод гомогенного осаждения кальция щавелевой кислотой, медленно генерирующейся в анализируемом растворе при введении в него этилоксалата:
(С2Н5)2С2О4 + 2 Н2О = 2 С2Н5ОН + Н2С2О4 Вычислить, сколько граммов этилоксалата (С2Н5)С2О4 нужно взять для опреде-
ления содержания кальция по этой схеме с учетом 10 %-го избытка осадителя. 12. При определении содержания магния в мартеновском основном шлаке навеску анализируемого образца массой 1, 1090 г растворили и осадили
магний в виде MgNH4PO4. После прокаливания осадка масса гравиметрической формы Mg2P2O7 оказалась равной 0,2076 г. Вычислить массу (г) магния в анализируемом растворе и аналитический множитель (фактор пересчета) для этого
определения. |
|
|
13. Определить массовую долю фосфора в |
навеске |
сплава массой |
3,5442 г, если масса прокаленного пирофосфата |
магния |
Mg2P2O7 равна |
0,06402 г. Вычислить аналитический множитель (фактор пересчета) для этого определения.
14.Какую навеску сплава, содержащего около 0,40 % фосфора, требуется взять для определения фосфора гравиметрическим методом, чтобы масса гравиметрической формы Mg2P2O7 не превышала 0,1 г?
15.Вычислить, какой объем 0,1000 М хлорида бария потребуется затратить для осаждения серы в виде BaSO4 из навески FeS2 массой примерно 0,5 г ?
16.Проба воздушно-сухого угля содержит примерно 5 масс. % влаги. Какую навеску угля следует взять для определения влажности методом высушивания, если изменение в массе осадка до и после высушивания должно быть примерно 0,1 г ?
17.Проба донецкого угля содержит примерно 2 масс. % аналитической влаги и 2 масс. % серы (в пересчете на сухую пробу ). Вычислить навеску воз- душно-сухого угля, требуемую для определения в нем содержания серы при использовании в качестве весовой формы сульфата бария, учитывая, что при этом масса прокаленного осадка не должна превышать 0,4 г ?
18.Сколько миллилитров 2 М раствора хлорида бария потребуется для осаждения сульфата, полученного при обработке 1,000 г твердого топлива, со-
173
держащего примерно 4 масс. % серы ?
0. Из навески угля массой 1,2100 г после соответствующей обработки был получен осадок сульфата бария массой 0,1327 г. Из навески того же образца массой 1,7680 г после высушивания при 105 С было получено 1,7400 г сухой пробы. Вычислить массовую долю серы (%) в исходном образце угля и пересчитать ее на сухое вещество.
Титриметрические методы определения элементов Задача № 2
Номер варианта выбирается по сумме двух последних цифр шифра. 1. Определение марганца в черных металлах и сплавах производится
персульфатно-серебряным методом. Навеску стали массой 1,0150 г растворили в смеси кислот; при этот марганец окислился до Mn2+. Затем с помощью надсернокислого аммония в присутствии катализатора нитрата серебра Mn2+ окислили до MnO4 . После охлаждения полученный раствор оттитровали 20,5 мл раствора мышьяковистокислого натрия NaAsO2 до перехода малиновой окраски раствора в зеленую. Титр рабочего раствора по марганцу T(NaAsO2/Mn) = 0,000168 г/мл. Рассчитать массовую долю (%, масс.) марганца в стали и записать все реакции, протекающие в растворе при этом определении.
2. Навеска руды массой 0,2133 г, содержащей железо, растворена в хлороводородной кислоте. Железо восстановлено до Fe2+ и затем оттитровано 17,2 мл раствора KMnO4 c концентрацией с(1/5 KMnO4) = 0,1117 моль/л. Вычислить массовую долю железа в руде (%, масс.) и записать все реакции, протекающие при этом определении.
3. Для определения концентрации рабочего раствора иода навеску стандартного образца сплава массой 2,0140 г, содержащего 0,06 масс. % серы, сожгли в токе кислорода. На титрование раствора, полученного после поглощения SO2, израсходовали 7,4 мл раствора иода. Вычислить титр рабочего раствора иода по сере и записать реакции, протекающие при этом определении.
4. Для определения серы навеску сплава ферровольфрама массой 1,2130 г сожгли в токе кислорода. На титрование раствора после поглощения SO2 израсходовали 8,1 мл раствора иода с титром по сере T(I2/S) = 0,00021 г/мл. Рассчитать массовую долю серы (%, масс.) в сплаве и записать реакции, протекающие при определении.
174
5.Для определения концентрации рабочего раствора арсенита натрия Na3AsO3 взяли навеску стандартного образца стали массой 1,2860 г, содержащей 1,22 % масс. марганца. После соответствующей обработки на титрование полученной марганцевой кислоты HMnO4 было израсходовано 22,4 мл рабочего раствора. Рассчитать титр раствора арсенита по марганцу.
6.Вычислить, какой объем перманганата калия KMnO4 достаточен для окисления железа в виде Fe2+ из навески руды массой 0,40 г, содержащей около 50 масс. % железа? Концентрация рабочего раствора c (1/5 KMnO4) =0,1 моль/л.
7.Рассчитать массовую долю меди (%) в руде по следующим данным: из навески руды массой 0,5100 г медь после ряда операций была переведена в раствор в виде Cu2+; при добавлении к этому раствору иодида калия выделился иод, на титрование которого пошло 14,10 мл тиосульфата натрия, имеющего титр по меди Т(Na2S2O3/Cu) = 0,0065 г/мл.
8.Вычислить, какую навеску руды, содержащей примерно 70 масс. % Fe2O3 надо взять для анализа, чтобы после соответствующей ее обработки на титрование шло 20 … 30 мл раствора KMnO4 с концентрацией с(1/5 KMnO4) = 0,1 моль/л.
9.Для определения содержания хрома навеску феррохрома массой 0,2 г путем ряда операций перевели в раствор, окислили хром до дихромат-иона
Cr2O72- надсернокислым аммонием (NH4)2S2O8 в присутствии катализатора азотнокислого серебра. Для восстановления дихромат-иона до Cr3+ использовали раствор двойной соли сернокислого железа (II) и аммония в присутствии индикатора (фенилантраниловой кислоты). На титрование пошло 30,5 мл рабочего раствора с титром по хрому Т((NH4)2SO4 · FeSO4/Cr) = 0,004013 г/мл. Вычислить массовую долю хрома в образце и записать реакции, протекающие при титровании.
10.Для определения содержания свинца в руде взята навеска руды массой 5,000 г. После растворения ее в кислоте ион Pb2+ осажден в виде PbCrO4, осадок отфильтрован, промыт и растворен в смеси HCl и KI. Выделенный при этой реакции иод оттитрован 42,0 мл раствора тиосульфата натрия с концентрацией c(Na2S2O3) = 0,5000 моль/л. Записать уравнения реакций, протекающих при определении, рассчитать эквивалентную массу свинца, используя закон эквивалентов, и титр тиосульфата по свинцу T(Na2S2O3/Pb). Вычислить массовую долю (%, масс.) свинца в руде.
11.При определении содержания серы в угле навеску воздушно-сухой пробы массой 0,2750 г сожгли в токе кислорода и выделившийся газ пропус-
175
тили через раствор перекиси водорода. Образовавшуюся серную кислоту оттитровали 12,6 мл раствора едкого натра с концентрацией T(NaOH/S) = 0,0001446 г/мл . Вычислить массовую долю серы (%, масс.) в воздушно-сухой пробе.
12. Определение кальция в приготовленном растворе мартеновского шлака проводили перманганатометрическим методом. Для этого растворили навеску образца массой 1,050 г и приготовленный для анализа раствор перенесли в мерную колбу вместимостью 250 мл. Аликвотную часть 5 мл разбавили водой и добавили 10 мл раствора щавелевой кислоты с концентрацией с(1/2Н2С2O4)=0,1016 моль/л, избыток которой оттитровали 5,20 мл раствора перманганата калия с концентрацией с(1/5KMnO4) = 0,1022 моль/л. Вычислить массовую долю (%, масс.) кальция в анализируемом образце шлака.
13. К 10 мл раствора, содержащего кальций, добавили 10 мл раствора Н2С2O4, избыток которого оттитровали 4,25 мл раствора перманганата калия с концентрацией с(1/5KMnO4)=0,1040 моль/л. На 1 мл раствора Н2С2O4 при титровании расходуется 1,02 мл раствора KMnO4. Определить массовую долю (%, масс.) кальция в анализируемом растворе.
14.Вычислить, сколько миллиграммов иода содержится в анализируемом растворе, если на титрование его пошло 20 мл раствора тиосульфата с концентрацией с(Na2S2O3)=0,1040 моль/л.
15.Из навески руды массой 0,5100 г медь после ряда операций была переведена в раствор в виде Cu2+. При добавлении к этому раствору иодида калия выделился иод, на титрование которого пошло 14,10 мл тиосульфата натрия, имеющего титр по меди Т(Na2S2O3/Cu) = 0,0065 г/мл. Рассчитать массовую долю меди (%, масс.) в анализируемой руде.
16.Для определения содержания алюминия к анализируемому раствору добавили 25,0 мл 0,040 М раствора ЭДТА. На титрование избытка ЭДТА было израсходовано 5,00 мл 0,035 М раствора ZnSO4. Вычислить массу (г) алюминия
ванализируемом растворе.
17.Определение кальция в приготовленном растворе шлака проводили перманганатометрическим методом. Для этого к анализируемому раствору добавили 10 мл раствора щавелевой кислоты с концентрацией с(1/2Н2С2О4) = 0,1016 моль/л, избыток которой оттитровали 5,20 мл раствора перманганата калия с концентрацией с(1/5KMnO4) = 0,1022 моль/л. Вычислить массу кальция в
анализируемом растворе.
176
18. При определении общей жесткости воды использовали комплексонометрическое титрование. На титрование 100 мл пробы анализируемой воды израсходовано 5,20 мл 0.0200 М раствора ЭДТА. Вычислить жесткость воды по содержанию карбоната кальция (мг/л).
0. На титрование 100 мл воды израсходовано 10,50 мл 0,01800 М раствора ЭДТА. Выразить жесткость воды в граммах СаО на 1 л воды.
Физические и физико-химические методы анализа
Спектроскопические оптические методы анализа
Молекулярно-абсорбционный анализ Фотоэлектроколориметрия. Использование метода калибровочного гра-
фика при элементном количественном анализе в фотометрии
Задача № 3
На основании данных, приведенных в табл. 4, определите содержание заданных элементов в исследуемых объектах, используя метод калибровочного графика.
Номер варианта соответствует последней цифре шифра студента.
177
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
варианта |
Опре- |
Метод |
|
|
|
|
|
|
|
|
|
|
|
|
|
деля- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
емый |
опреде- |
|
|
|
Оптическая плотность А |
|
|
|
|
Концентрации |
||||
№ |
эле- |
ления |
|
|
|
|
|
|
|
|
|
|
|
|
|
мент |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стан- |
Исследуемый |
|
|
|
|
|
|
|
Объем растворов, мл |
|
|
|
дарт- |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ный |
раствор, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рас- |
аликвотная часть |
|
|
|
|
|
|
|
|
|
|
|
|
|
Иссле- |
||
|
|
|
|
|
|
Стандартные растворы |
|
|
|
твор, |
10 мл |
||||
|
|
|
|
|
|
|
|
|
дуемый |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ах |
мкг/мл |
|
|
|
|
1 мл |
2 мл |
3 мл |
4 мл |
5 мл |
6 мл |
7 мл |
8 мл |
9 мл |
10мл |
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
1 |
Fe |
с сульфо- |
0,09 |
0,178 |
0,268 |
0,356 |
0,445 |
|
|
|
|
|
0,244 |
79,3 |
Fe (%, масс.) в карбиде |
|
|
салици- |
|
|
|
|
|
|
|
|
|
|
|
|
хрома при навеске |
|
|
ловой |
|
|
|
|
|
|
|
|
|
|
|
|
0,0400 г в 250 мл |
|
|
кислотой |
|
|
|
|
|
|
|
|
|
|
|
|
раствора |
2 |
Cr |
с дифенил- |
0,106 |
0,196 |
0,285 |
0,374 |
0,464 |
|
|
|
|
|
0,354 |
10.25 |
Cr2O3 (%, масс.) в бок- |
|
|
карбази- |
|
|
|
|
|
|
|
|
|
|
|
|
сите при навеске |
|
|
дом |
|
|
|
|
|
|
|
|
|
|
|
|
0,1556 г в 100 см3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
раствора |
3 |
Mn |
по собст- |
|
0,055 |
0,090 |
0,120 |
0,150 |
0,180 |
0,210 |
0,240 |
0,270 |
0,300 |
0,250 |
25,62 |
Mn (%, масс.) в руде при |
|
|
венной |
|
|
|
|
|
|
|
|
|
|
|
|
навеске 0,1400 г в 250 |
|
|
окраске |
|
|
|
|
|
|
|
|
|
|
|
|
мл раствора |
4 |
Mo |
роданид- |
|
0,07 |
0,102 |
0,136 |
0,170 |
0,204 |
0,237 |
0,271 |
0,305 |
0,340 |
0,310 |
7,2 |
Mo (%, масс.) в стали |
|
|
ный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при навеске 0,1120 г в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
250 мл раствора |
178
Продолжение табл. 4
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
16 |
|
|
5 |
W |
роданид- |
0,12 |
0,180 |
|
0,232 |
0,290 |
0,345 |
0,400 |
0,459 |
0,516 |
|
|
0,390 |
68,0 |
W (%, масс. ) в руде при |
|||
|
|
ный |
|
|
|
|
|
|
|
|
|
|
|
|
|
навеске 1,5776 г в 100 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мл раствора |
|
||
6 |
Ni |
с диметил- |
0,07 |
0,132 |
|
0,190 |
0,257 |
0,320 |
0,382 |
0,447 |
|
|
|
0,365 |
10,0 |
Ni |
в стали при навеске |
||
|
|
глиокси- |
|
|
|
|
|
|
|
|
|
|
|
|
|
1,4250 г в 250 мл |
|
||
|
|
мом |
|
|
|
|
|
|
|
|
|
|
|
|
|
раствора |
|
|
|
7 |
Cu |
в виде си- |
0,06 |
0,105 |
|
0,150 |
0,195 |
0,242 |
0,290 |
0,335 |
0,380 |
0,427 |
0,470 |
0,175 |
36 |
Си |
(%, масс.) в ферро- |
||
|
|
него ам- |
|
|
|
|
|
|
|
|
|
|
|
|
|
молибдене при навеске |
|||
|
|
миачного |
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1580 г в 250 мл |
|
||
|
|
комплекса |
|
|
|
|
|
|
|
|
|
|
|
|
|
раствора |
|
|
|
8 |
Р |
в виде |
0,08 |
0,18 |
|
0,26 |
0,34 |
0,42 |
0,50 |
0,61 |
|
|
|
0,23 |
10,0 |
Р в ферромолибдене при |
|||
|
|
фосфор- |
|
|
|
|
|
|
|
|
|
|
|
|
|
навеске 0.5087 г в 100 |
|||
|
|
номолиб- |
|
|
|
|
|
|
|
|
|
|
|
|
|
мл раствора |
|
||
|
|
деновой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гетеропо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ликислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
Fe |
с ортофе- |
0,065 |
0,135 |
|
0,205 |
0,260 |
0,322 |
0,450 |
0,460 |
0,520 |
0,592 |
0,640 |
0,550 |
10,0 |
Fe (%, масс.) в титано- |
|||
|
|
нантроли- |
|
|
|
|
|
|
|
|
|
|
|
|
|
вой |
руде при |
навеске |
|
|
|
ном |
|
|
|
|
|
|
|
|
|
|
|
|
|
0.3450 г в 500 мл рас- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
твора |
|
|
|
0 |
Sb |
экстракци- |
0,084 |
0,170 |
|
0,250 |
0,370 |
0,422 |
|
|
|
|
|
0,275 |
5,0 |
Sb (%, масс.) в ферро- |
|||
|
|
онно- |
|
|
|
|
|
|
|
|
|
|
|
|
|
хроме |
при |
навеске |
|
|
|
фотомет- |
|
|
|
|
|
|
|
|
|
|
|
|
|
5..5090 г (для фотомет- |
|||
|
|
рический с |
|
|
|
|
|
|
|
|
|
|
|
|
|
рирования используется |
|||
|
|
бриллиан- |
|
|
|
|
|
|
|
|
|
|
|
|
|
экстрагирование |
|
||
|
|
товым зе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
сурьмы из всего приго- |
|||
|
|
леным |
|
|
|
|
|
|
|
|
|
|
|
|
|
товленного раствора) |
|||
179
Атомно-эмиссионный спектральный анализ Атомно-эмиссионный спектральный анализ с фотографической регистра-
цией спектра. Метод трех эталонов
Задача № 4
Определить массовую долю меди в алюминии, серебра в медных отливках, сурьмы в свинце, марганца в стальных деталях по значениям почернений аналитической пары элементов (табл.5). Данные для эталонных образцов приведены в табл. 6. Вариант выбирается по последней цифре шифра.
Таблица 5
|
|
Результаты фотометрирования |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Парамет- |
|
|
|
Варианты и исходные данные |
|
|
|
|||||
ры |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
|
4 |
5 |
6 |
7 |
|
8 |
9 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S (Cu) |
0,41 |
0,44 |
0,56 |
|
|
|
|
|
|
|
|
|
S (Al) |
0,35 |
0.41 |
0,42 |
|
|
|
|
|
|
|
|
|
S (Ag) |
|
|
|
|
0,51 |
0,47 |
0,64 |
|
|
|
|
|
S (Cu) |
|
|
|
|
0,65 |
0,65 |
0,67 |
|
|
|
|
|
S (Sb) |
|
|
|
|
|
|
|
1,02 |
|
0,95 |
|
|
S (Pb) |
|
|
|
|
|
|
|
1,64 |
|
1,69 |
|
|
S (Mn) |
|
|
|
|
|
|
|
|
|
|
0,91 |
0,63 |
S (Fe) |
|
|
|
|
|
|
|
|
|
|
0,73 |
0,76 |
|
|
|
|
|
|
|
|
|
|
|
|
|
180
|
|
|
|
|
|
|
|
|
|
Таблица 6 |
||
|
|
|
|
Характеристики эталонных образцов |
|
|||||||
|
|
|
|
|
|
|
|
|
||||
Пара- |
|
Эталоны |
|
Пара- |
|
Эталоны |
|
|||||
метры |
|
|
|
метры |
|
|
|
|
||||
1 |
2 |
3 |
1 |
2 |
|
3 |
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
0,25 |
0,80 |
1,20 |
|
* |
0,12 |
0,38 |
|
0,80 |
|
(Сu) |
|
|
|
|
(Sb) |
|
|
|
|
|
|
|
S(Cu) |
0,25 |
0,54 |
0,61 |
S(Sb) |
|
0,79 |
1,20 |
|
1,65 |
|||
S(Al) |
|
0,42 |
0,44 |
0,41 |
S(Pb) |
|
1,58 |
1,55 |
|
1,59 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
0,23 |
0,34 |
0,55 |
|
|
* |
0,05 |
0,21 |
|
0,30 |
(Ag) |
|
|
|
|
(Mn) |
|
|
|
|
|
||
S(Ag) |
0,45 |
0,54 |
0,68 |
S(Mn) |
0,53 |
0,90 |
|
1,03 |
||||
S(Cu) |
0,65 |
0,64 |
0,67 |
S(Fe) |
|
0,72 |
0,74 |
|
0,78 |
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
Концентрация элемента выражена в массовых долях (%, масс.) |
|
|||||||||
181
Электрохимические методы анализа
Задача № 5
Вариант задачи № 5 выбирается в соответствии с суммой двух последних цифр шифра студента.
1.Навеску сплава массой 0,6578 г растворили и через полученный раствор в течение 20 минут пропускали ток силой 0,20 А , в результате чего на катоде выделилась медь. Определить массовую долю (%, масс.) меди в сплаве, если выход по току составлял 80 % .
2.Из анализируемого раствора, содержащего ионы металла, М1+ в результате электролиза при силе тока 1 А за 50 мин было выделено на катоде 3.3540 г металла. Определить, какой металл выделился на катоде.
3.Навеску сплава массой 2,1574 г растворили и после соответствую-
щей обработки довели объем раствора до 100 мл. Определить массовую долю (%, масс.) серебра в сплаве, если при потенциометрическом титровании 25 мл приготовленного раствора раствором хлористого натрия с концентрацией с(NaCl)=0,1250 моль/л получили следующие результаты:
V (NaCl), мл |
|
16,0 |
18,0 |
|
19,0 |
19,5 |
|
19,9 |
|
20,0 |
20,1 |
|
20,5 |
|
21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е, мВ |
|
689 |
670 |
|
652 |
634 |
|
594 |
|
518 |
441 |
|
401 |
|
383 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Указания к решению задачи. |
|
|
|
|
|
|
|
|
|
|
|
|||||
Кривую потенциометрического титрования построить в |
координатах E V и |
|||||||||||||||
E/ V V. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Из навески сплава массой 2,0400 |
г таллий |
перевели в Tl+1 и оттитро- |
||||||||||||||
вали раствором |
KBrO3 с |
концентрацией с(1/6 KBrO3) =0,1000 |
моль/л |
в хло- |
||||||||||||
роводородной среде. В процессе титрования в растворе протекает реакция
BrO3- + 3 Tl+ + 6H+ = Br- + 3Tl3+ + 3H2 O
Вычислить массовую долю (%, масс.) таллия в сплаве по следующим результатам потенциометрического титрования:
V (KBrO3), мл |
2,0 |
10,0 |
18,0 |
19,8 |
20,0 |
20,2 |
22,0 |
Е , мВ |
1251 |
1280 |
1309 |
1339 |
1407 |
1430 |
1451 |
|
|
|
|
|
|
|
|
182

Указания к решению задачи.
Кривую потенциометрического титрования построить в координатах E
V и E/ V V.
5. Из навески сплава массой 0,6000 г титан перевели в TiO2+ и оттитровали раствором хлористого хрома с концентрацией с(CrCl2 ) = 0,1000 моль/л:
TiO2+ + Cr2+ + 2H+ = Ti3+ + Cr3+ +H2 O
Вычислить массовую долю (%, масс.) таллия в сплаве по следующим ре-
зультатам потенциометрического титрования: |
|
|
|
||||
|
|
|
|
|
|
|
|
V (CrCl2), мл |
2,0 |
10,0 |
18,0 |
19,8 |
20,0 |
20,2 |
22,0 |
Е, мВ |
159 |
100 |
41 |
- 18 |
- 155 |
- 292 |
- 351 |
Указания к решению задачи.
Кривую потенциометрического титрования построить в координатах E
V и E/ V V.
6.Для определения содержания примеси свинца в металлическом алюминии навеску последнего массой 5,1340 г растворили, перенесли в мерную колбу на 50 мл и раствор довели до метки водой. При снятии полярограммы высота волны h оказалась равной 9 мм. При полярографировании стандартных растворов соли свинца получили следующие результаты:
c (Pb) 106, г/мл |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
h , мм |
4,0 |
8,0 |
12,0 |
16,0 |
20,0 |
|
|
|
|
|
|
Построить калибровочный график в координатах h c и определить массовую долю (%, масс.) свинца в металлическом алюминии.
7. Навеску стали, содержащей медь, массой 0,2000 г растворили в азотной кислоте и объем полученного раствора довели водой до 50 мл. При полярографировании 5 мл раствора в 20 мл фона высота волны h = 37 мм. При полярографировании 25 мл эталонного раствора, содержащего 3 10-5 г меди, высота волны h оказалась равной 30 мм. Определить массовую долю меди (%, масс.) в стали.
8. Для определения содержания свинца в цинковой руде методом добавок навеску руды массой 1,0000 г растворили и после соответствующей обработки объем раствора довели до 200 мл. Для снятия полярограммы взяли 20 мл этого раствора. Высота волны h оказалась равной 25 мл. После прибавления в
183

раствор 0,004 г свинца высота волны увеличилась до 35 мм. Определить массовую долю свинца (%, масс.) в анализируемой руде.
9.Навеску минерала массой 0,5650 г, содержащего титан, растворили и после соответствующей обработки разбавили водой до 200 мл. При полярографировании 10 мл раствора, содержащего Ti(IV), высота волны h оказалась равной 55 мм. После прибавления 0,25 мл раствора TiCl4 с титром Т(Ti ) = 0,0000350 г/мл высота волны h увеличилась до 63,5 мм. Определить массовую долю (%, масс.) ТiО2 в минерале.
10.Определить концентрацию свинца (г/мл), если при амперометрическом титровании 10,0 мл анализируемого раствора рабочим раствором сульфата натрия с титром по свинцу, равным T(Na2SO4/Pb) = 0,00640 г/мл, получили следующие данные:
V (Na2 SO4), мл |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
Диффузионный ток , мкА |
215 |
163 |
113 |
60 |
40 |
39 |
Указания к решению задачи.
Титр рабочего раствора по определяемому веществу показывает количество граммов определяемого вещества (свинца), эквивалентное в данной реакции 1 мл рабочего раствора (сульфата натрия).
11.Вычислить электродный потенциал медного электрода, опущенного
враствор его соли с концентрацией меди с(Cu2+) = 0,1 моль/л.
12.Вычислить концентрацию ионов меди в растворе CuSO4, при условии, что электродный потенциал меди в нем равен нулю.
13.На кулонометрическое титрование церия (IV) в 0,1 М растворе Fe(III)
электрогенерируемыми ионами Fe(II) при силе тока 30 мА потребовалось 100 с. Определите массу церия (IV) в анализируемом растворе.
14.Рассчитайте потенциал платинового электрода, опущенного в раствор FeSO4, который на 99,9 % оттитрован растворомKMnO4 .
15.Для определения примеси железа в алюминии использовали метод кулонометрического титрования ионов Fe3+ электровосстанавливаемыми ионами Sn2+ при постоянной силе тока 4 мА. Точка эквивалентности фиксировалась потенциометрическим методом. Время электролиза составило 100 с. Навеска алюминия 1,0005 г. Вычислить массовую долю железа (%, масс.) в алюминии.
16.Концентрацию кадмия в растворе определяли полярографически ме-
тодом добавок. Для анализируемого раствора объемом 15 мл высота поляро-
184
графической h волны оказалась равной 25 мм. После добавления в анализируемый раствор 1 мл стандартного раствора хлорида кадмия с концентрацией 0,105 моль/л высота волны h увеличилась до 30 мм. Вычислить концентрацию кадмия в растворе в моль/л.
17. Для определения содержания меди в стали навеску стали массой 0,1985 г растворили в азотной кислоте, перенесли полученный раствор в мерную колбу вместимостью 50 мл и довели до метки водой. При полярографировании 5 мл полученного раствора в 20 мл фона высота полярографической волны равна 35 мм. При полярографировании 25 мл эталонного раствора, содержащего 3 10-5 г меди, высота волны оказалась равной 29 мм. Определить массовую долю меди (%, масс.) в стали.
18. Какое время необходимо для полного выделения кадмия из 20 мл раствора с концентрацией с (1/2CdSO4 ) = 0,05 моль/л, если сила тока равна 0,1 А. А выход по току равен 90% ?
0. Для определения примеси алюминия в сурьме использовали метод кулонометрического титрования с биамперометрической фиксацией точки эквивалентности. Для этого навеску сурьмы массой 0,7050 г перевели в раствор и выделили из него примесь алюминия в виде оксихинолята. Осадок очистили, растворили в соляной кислоте и провели кулонометрическое титрование выделившегося 8-оксихинолина бромом, генерируемом в ходе электролиза из бромида калия при постоянной силе тока 8,2 мА. Титрование проводилось в течение 130 с. Навеска сурьмы равна 0,6235 г. Вычислить массовую долю алюминия (%, масс.) в анализируемом образце сурьмы, если число электронов, участвующих в электрохимическом превращении в расчете на один атом алюминия, равно 12.
185
ТЕОРЕТИЧЕСКИЕ ЗАДАНИЯ
Теоретические задания 1, 2 и 3 выполняются каждым студентом независимо от номера его шифра.
Задание № 1. Кулонометрия. Использование кулонометрических анализаторов в аналитическом контроле металлургического производства
Нарисовать принципиальную схему кулонометрического анализатора на углерод. Записать реакции, протекающие в ходе определения углерода. Привести формулу, лежащую в основе расчета массовой доли углерода в сплаве. Объяснить, как подбираются стандартные образцы для калибровки анализатора.
Задание № 2. Использование атомно-эмиссионного спектрального анализа в сервисной службе аналитического контроля металлургического производства
Нарисовать оптическую схему квантометра и объяснить, как используются эти приборы для анализа сталей и сплавов.
Задание № 3. Методы локального анализа поверхности твердого тела
1.Электронно-зондовый рентгеноспектральный микроанализ (РСПМА). Нарисовать принципиальную схему микрозонда и описать его возможности для анализа.
2.Рентгеновская фотоэлектронная спектроскопия (РФЭС) и Ожеэлектронная спектроскопия (ОЭС) для анализа поверхности. Охарактеризовать аппаратурное оформление методов. Описать содержание получаемой информации.
186
4.2.3. Методические указания к выполнению контрольной работы
Химические методы анализа
Гравиметрический метод определения элементов
Задача № 1 Основные типы расчетов в гравиметрическом анализе
Конечной целью проведения гравиметричекого анализа может быть вычисление массового содержания или массовой доли определяемого вещества.
Результаты анализа можно выражать по-разному: в виде содержания в пробе элементов (Fe, Cu, P, O, C и т.д.), содержания ионов (например, Ca2+, Mg2+), содержания оксидов (SiO2, Fe2O3, Al2O3, CaO, P2O5 и т.д.).
Гравиметрический анализ включает два экспериментальных измерения:
–взвешивание навески анализируемого образца mобр.;
–взвешивание продукта известного химического состава P, полученного из этой навески в ходе анализа (гравиметрическая или весовая форма), для установления его массы m (P).
Гравиметрическая или весовая форма может непосредственно состоять из определяемого компонента A (например, весовая форма имеет состав SiO2 при определении содержания SiO2), либо определяемый компонент входит в состав весовой формы в точно стехиометрических соотношениях (например, при определении содержания серы гравиметрическая форма имеет состав BaSO4). В случае косвенных определений гравиметрическая форма совсем не содержит определяемого компонента, но между ними могут быть установлены точные стехиометрические соотношения.
Во всех случаях для достижения конечного результата расчета - вычисления массовой доли определяемого компонента - необходимо массу гравиметрической формы осадка m(P) пересчитать на массу m определяемого компонента А - m(A).
m(A) m(P) |
x |
|
м о лярн ая м асса о п ределяем о го ко м п о н ен та |
m(P) |
x |
|
M (A) |
, |
y |
м о лярн ая м асса гравим етрическо й ф о рм ы |
y |
M (P) |
187

где x и y – целые числа, на которые нужно умножить молярные массы определяемого компонента и гравиметрической формы, соответственно, чтобы числа молей в числителе и знаменателе были химически эквивалентны.
Вычисленное значение массы определяемого компонента m (A) позволяет рассчитать его массовую долю ω в анализируемом объекте по формуле
ω(A) m(A) 100% .
mî áð.
При любом изменении исходной навески, а следовательно, и массы конечного продукта - гравиметрической формы, указанное эквивалентное отношение молярных масс в расчете массовой доли определяемого компонента сохраняется постоянным. Это отношение называется гравиметрическим фактором,
фактором пересчета или аналитическим множителем и обозначается симво-
лом F
F xy MM ((PA)) .
При серийных анализах, то есть при большом потоке анализируемого материала, гравиметрический фактор, для упрощения расчетов, рассчитывают заранее, поскольку он не изменяется при данной выбранной схеме определения.
При построении методики и обработке результатов гравиметрического анализа можно выделить следующие основные типы расчетов:
1.Вычисление фактора пересчета (аналитического множителя, гравиметрического фактора).
2.Расчет количества осадителя.
3.Расчет навески анализируемого образца.
4.Расчет результатов анализа.
Рассмотрим подробнее каждый из этих видов расчетов.
Вычисление фактора пересчета
Как уже было сказано, гравиметрический фактор (или фактор пересчета, или аналитический множитель) F – это эквивалентное отношение молярных масс определяемой и весовой (гравиметрической) формы. Эта ве-
личина рассчитывается по-разному в зависимости от состава гравиметрической формы и от стехиометрического соотношения между составом этой формы и
188

составом определяемого компонента. Числовые значения гравиметрических факторов приведены в справочных таблицах [5].
Пример 1. Вычислить аналитический множитель для пересчета сульфата бария на серу и определить сколько граммов серы содержится в 0,2040 г сульфата бария?
Решение
Из формулы сульфата бария BaSO4 видно, что 1 моль серы эквивалентен 1 моль сульфата бария. Поэтому, в соответствии с определением, вычисляем величину аналитического множителя как отношение молярных масс определяемого вещества - серы и его гравиметрической формы – сульфата бария
F (BaSO4 / S) M M(BaSO(S) 4 ) 23532 0,1362 .
Тогда масса серы, содержащейся в 0,2040 г сульфата бария, равна
m (S) = m (BaSO4) · F (BaSO4 / S) = 0,2040 · 0,1362 = 0,0278 г .
Пример 2. Вычислить фактор пересчета триоксида марганца на марганец. Какова масса марганца, соответствующая 0,2040 г триоксида марганца Mn3O4?
Решение
1 моль Mn3O4 эквивалентен 3 моль Mn. Поэтому
F (Mn3 O4 / Mn) |
3 M (Mn) |
|
3 54,93 |
0,7204 . |
|
M (Mn3 O4 ) |
228,73 |
||||
|
|
|
Следовательно, масса марганца, эквивалентная 0,2040 г триоксида марганца,
равна: |
|
|
|
|
|
|
|
m (Mn) |
m (Mn3 O4 ) |
3 M (Mn) |
|
0,2040 |
3 54,9 |
0,1470 г. |
|
M (M3 O4 ) |
228,73 |
||||||
|
|
|
|
|
189
При косвенных определениях гравиметрическая форма не содержит определяемого элемента. В этом случае эквивалентность между ними, то есть фактор пересчета, вычисляют на основе стехиометрических соотношений между ними.
Пример 3. При определении фосфора в чугуне осаждают фосфор в виде (NH4)3PO4 ·12 MoO3, затем осадок растворяют в аммиаке, осаждают молибденовую кислоту раствором ацетата свинца и взвешивают в виде PbMoO4, по массе которого определяют содержание фосфора. Вычислить фактор пересчета для такого определения.
Решение
Записываем схему определения
P → PO43- → (NH4)3PO4 · 12 MoO3 → 12 ·PbMoO4 .
Отсюда |
|
|
|
|
F |
M (P) |
|
30,98 |
0,00703. |
12 M (PbMoO4 ) |
12 367,16 |
Расчет количества осадителя
Реактивы, которые используют для осаждения, применяют в виде растворов различной концентрации. Для вычисления требуемого объема необходимо по уравнению реакции рассчитать необходимую массу реагента, а затем, зная концентрацию раствора, сделать пересчет на объем.
Вычисление необходимого количества реактива не требует особой точности, поскольку на практике для уменьшения потерь при осаждении используют избыток осадителя.
Пример 4. Какой объем раствора ацетата свинца с массовой долей 1 % требуется для осаждения молибдена при определении его содержания в ферромолибдене в виде молибденово-кислого свинца, если примерное содержание молибдена составляет 50 % (масс.), а навеска образца сплава около 0,25 г?
190
Решение
Запишем схему определения
Mo → MoO42- → MoO42- + Pb(CH3COO)2 → PbMoO4 ↓
Молярные массы определяемого вещества и осадителя равны:
М(Mo) = 96 г · моль-1 и М(Pb(CH3COO)2) = 266 г · моль-1 .
Масса молибдена в анализируемой навеске сплава равна: m(Mo) =0.25 · 0.5 = 0,125 г .
Составим пропорцию, в соответствии с которой взаимодействуют определяемое вещество и осадитель:
96 г |
Mo |
─ |
266 г Pb(CH3COO)2 |
0.125 г |
Mo |
─ |
m г Pb(CH3COO)2 |
Следовательно, m (Pb(CH3COO)2 ) = (0,125· 266)/96 = 0.346 г .
Учитывая массовую концентрацию раствора, вычисляем требуемую массу раствора ацетата свинца
mр-ра = (0.346·100)/1 = 34,6 г.
Поскольку плотность разбавленного раствора близка к 1 г/см3 , вычисленная масса раствора равна его объему. На практике обычно используется полутора - двукратный объем осадителя. Следовательно, для полноты осаждения необходимо взять примерно 70 мл раствора ацетата свинца.
Расчет навески анализируемого образца
Перед началом анализа необходимо приблизительно знать, сколько определяемой составной части содержится в анализируемом образце. На этом основании рассчитывают, сколько надо взять вещества для анализа, то есть какую навеску необходимо взять. Этот расчет обязательно должен предшествовать анализу во избежание получения слишком малого или, наоборот, слишком большого количества прокаленного осадка. При слишком малой массе осадка неизбежные потери на всех стадиях анализа, неточность аналитических весов внесут слишком значительную (в долевом отношении) погрешность. Если взять слишком большую навеску, при осаждении получится столь большое количество осадка, что его невозможно будет тщательно промыть.
В методиках гравиметрического анализа обычно приводится либо величина оптимальной навески, либо указывается, какими нормами следует руководствоваться при ее расчете. При расчете навески обычно достаточно определить только два первых знака, но само взвешивание, конечно, проводят с обычной аналитической точностью, то есть до четвертого знака.
191
Пример |
5. Какую навеску феррованадия, содержащего примерно |
0,10 ─ 0,15 % |
(масс.) фосфора, следует взять для точного определения его со- |
держания в сплаве, если фосфор осаждают в виде фосфорно-молибденово-ам- монийной соли (NH4)3PO4 · 12 MoO3 ·2H2O, которую высушивают и прокаливают до получения P2O5 ·24MoO3? Масса получаемого осадка примерно 0,1 г.
Решение
Сначала составляем схему анализа
Р → (NH4)3 PO4 · 12 MoO3 ·2H2O → P2O5 ·24MoO3.
На ее основе вычисляем фактор пересчета для данного определения:
F (P2O5 ·24MoO3 /P) = 2M (P) / M (P2O5 ·24MoO3) = 62 / 3598 = 0,01723 .
Для расчета массы фосфора, требуемого для проведения анализа, умножим фактор пересчета на полученную массу гравиметрической формы:
m(P) = F(P2O5 ·24MoO3 /P) · m (P2O5 ·12MoO3) = 0,01723 · 0,1 = 0,001723 г.
По условию содержание фосфора в сплаве не превышает 0,15 % (масс.). Следовательно, навеска сплава для анализа mсплава вычисляется из пропорции
0,001723 г Р 0.15%
mсплава 100% .
Таким образом, для анализа необходимо взять навеску сплава mсплава = (0,001723 · 100)/0,15 = 1,15 г .
Расчет результатов анализа
Как уже было указано выше, конечной целью проведения гравиметричекого анализа является вычисление массового содержания или массовой доли определяемого вещества.
Эти расчеты производятся на основе уравнений реакций образования гравиметрической формы.
Пример 6. Определение свинца в руде проводили осаждением его в виде PbSO4. Для этого навеску руды массой 2.2590 г растворили, осадили из подготовленного анализируемого раствора свинец в виде PbSO4. После соответствующей обработки полученный осадок сульфата свинца прокалили и взвесили. Масса осадка PbSO4 составила 0.2547 г. Вычислить массовую долю свинца в руде.
192
Решение
В основе определения лежит реакция образования труднорастворимого соединения сульфата свинца при взаимодействии определяемых ионов свинца с ионами сульфата:
Pb2+ + SO42- = PbSO4↓.
В данном случае составы осаждаемой и гравиметрической формы осадка совпадают. Требуемые для последующих расчетов молярные массы составляют:
M(PbSO4) = 303 г/моль; M(Pb) = 207 г/моль.
Рассчитаем фактор пересчета сульфата свинца на свинец
F(PbSO4 / Pb) = M(Pb)/ M(PbSO4) = 207 / 303 = 0.683.
Вычислим массу свинца в полученной гравиметрической форме
m (Pb) = m(PbSO4) · F(PbSO4 · Pb) = 0.2547·0,683 = 0,1740 г .
Следовательно, в навеске анализируемой руды массой 2,2590 г содержится 0,1740 г свинца. Теперь можем вычислить массовую долю свинца в анализируемом веществе:
0.1740 г Pb содержится |
в 2.2590 г анализируемой руды |
m г Pb содержится |
в 100 г анализируемой руды; |
m (Pb) = ω( Pb) = (0,1740·100)/ 2.2590 =7,70 % Pb.
Следовательно, массовая доля свинца в исследуемой руде составляет
ω (Pb) = 7,70 %.
Схема решения задачи №1 (Гравиметрический метод анализа):
1.Записать название темы контрольной задачи.
2.Полностью переписать условие задачи.
3.Записать тип расчета, рассматриваемый в данной задаче.
4.Записать схему определения или химические уравнения реакций, лежащих в основе расчетов.
5.Привести подробное обоснование решения и необходимые вычисления, руководствуясь изложенными примерами типовых расчетов ( примеры
1…6).
193
Титриметрические методы определения элементов
Задача № 2 Способы выполнения титриметрических определений
и расчеты результатов титрования
По способу выполнения различают прямое титрование, обратное титрование (титрование по остатку) и заместительное титрование (титрование заместителя).
Все расчеты в титриметрическом методе анализа основаны на использова-
нии закона эквивалентов: вещества реагируют между собой в эквивалентных количествах.
Прямое титрование. Титрант непосредственно добавляют к определяемому веществу. Для расчета количества определяемого вещества необходимо заранее знать точную концентрацию титранта. В ходе титрования устанавливается точный объем стандартного раствора, пошедшего на титрование определяемого вещества. Расчет основан на равенстве количеств эквивалентов стандартного раствора и определяемого вещества. Количество эквивалентов стандартного раствора вычисляют, используя разные способы выражения концентраций: молярную концентрацию, молярную концентрацию эквивалента, титр рабочего раствора, титр рабочего раствора по определяемому веществу.
Пример 1. Навеску руды массой 0,2050 г растворили в кислоте. Содержащееся в пробе железо восстановили до Fe2+. Для определения его количества использовали титрование рабочим раствором перманганата калия с молярной концентрацией эквивалента, равной 0,1025 моль·л. На титрование израсходовано 15,45 мл рабочего раствора KMnO4. Вычислить массовую долю железа в руде.
Решение
В задаче рассматривается прямое титрование ионов Fe2+ рабочим раствором перманганата калия KMnO4.
194
Расчет содержания железа в анализируемом образце основан на равенстве количества эквивалентов определяемого вещества Fe2+ и рабочего раствора KMnO4. Поэтому для начала необходимо определить факторы эквивалентности реагирующих компонентов. Для этого составим электронно-ионные уравнения процессов окисления и восстановления, а также суммарное ионное уравнение реакции, протекающей в процессе титрования:
5 |
|
|
|
Fe2 e Fe3+ |
||
|
||||||
1 |
|
|
MnO4 |
- 8H+ 5e Mn2+ 4H2O |
||
|
||||||
|
|
|||||
5 Fe 2+ + MnO4 - + 8 H+ = 5 Fe3+ + Mn2++ 4 H2O. |
||||||
Исходя из приведенных уравнений полуреакций, видно, что fэкв(KMnO4) = 1/5, fэкв (Fe) =1. Следовательно, равенство количества эквивалентов можно записать следующим образом:
n (Fe) = n (1/5 KMnO4) .
Записываем формулы, позволяющие рассчитать требуемые количества эквивалентов:
n (Fe) = m (Fe) / M(Fe),
n (1/5KMnO4) = [c (1/5 KMnO4) / 1000] · V (KMnO4).
Приравняв эти выражения, получаем возможность рассчитать определяемую массу железа по формуле:
m (Fe)=[c (1/5KMnO4)/1000] · V(KMnO4)·M(Fe)= =[0,1025/1000]·15,45·55,85=0,08844 г.
Расчет массовой доли железа (Fe) в руде производим по формуле:
(Fe) = [m (Fe) / m обр] · 100 = ( 0,08844 / 0,2050) · 100 = 43,14 % .
195
Обратное титрование используют в следующих случаях:
-при малой скорости прямой реакции;
-при отсутствии подходящего индикатора;
-при возможности протекания побочных реакций, например, потерь вещества вследствие его летучести.
Обратное титрование осуществляют следующим образом: к определяемому веществу добавляют отмеренный избыток ПЕРВОГО ТИТРАНТА. Определяемое вещество вступает в реакцию с первым титрантом в эквивалентных количествах. Если реакция протекает медленно, выжидают необходимое время до достижения равновесия. Иногда раствор нагревают. Остаточное количество ПЕРВОГО ТИТРАНТА оттитровывают ВТОРЫМ ТИТРАНТОМ.
Для проведения анализа необходимо заранее знать
-концентрации обоих титрантов,
-точный объем первого титранта.
Входе титрования устанавливается точный объем второго титранта, пошедшего на титрование остатка первого титранта.
Пример 2. Для определения содержания хрома в стали навеску образца массой 1,1220 г перевели в раствор и окислили хром до хромат-иона CrO4 2-. Затем к раствору прибавили 25,0 мл рабочего раствора соли Мора - (NH4)2SO4 · FeSO4 6H2 O и избыток Fe2+ оттитровали 6,1 мл раствора перманганата калия KMnO4. При этом 25,00 мл соли Мора эквивалентны 24,2 мл перманганата калия, а титр перманганата калия по хрому Т(KMnO4/Cr) = 0,0004498 г/мл. Вычислить массовую долю хрома в стали.
Решение
В задаче рассматривается определение хрома с помощью обратного титрования. Первый титрант, добавленный в отмеренном избытке - соль Мора затрачивается на восстановление хрома (VI) до хрома (III); второй титрант, пошедший на титрование избытка соли Мора, не вступившего в реакцию с хромом, - это перманганат калия.
196

Составим уравнения реакций, соответствующие этим процессам.
Первая реакция в анализируемом растворе протекает между хромат-ионом CrO4 2-и ионом Fe2+ , действующим началом соли Мора:
1 CrO4 2 8H+ 3e Cr3+ 4H2O 3 Fe2 e Fe3+
СrO42- + 3 Fe 2+ + 8 H+ = Cr3+ + 3 Fe3+ + 4 H2O.
Учитывая число электронов, участвующих в полуреакциях, записываем факторы эквивалентности для хрома и железа:
|
|
|
|
|
|
fэкв (Cr)= 1/3; fэкв (Fe) =1. |
|
Вторая реакция протекает между избытком соли Мора, не израсходован- |
|||||||
ным на восстановление хромат-иона, и перманганатом калия: |
|||||||
5 |
|
|
|
Fe2+ e Fe3+ |
|
|
|
|
|
|
|||||
1 |
|
|
MnO-4 8H+ 5e Mn2+ 4H2O |
||||
|
|||||||
|
|
|
|
||||
5 Fe 2+ + MnO4- |
+ 8 H+ = 5 Fe3+ + Mn2++ 4 H2O. |
||||||
Исходя из |
приведенных уравнений полуреакций, видно, что |
||||||
fэкв(KMnO4) = 1/5, |
fэкв,(Fe) =1. Следовательно, равенство количества эквива- |
||||||
лентов можно записать следующим образом:
n (1/3 Cr ) = n(Fe) - n (1/5 KMnO4) .
Это равенство является фактической основой для решения задач на об-
ратное титрование: количество эквивалентов определяемого вещества рав-
но разности количеств эквивалентов первого и второго титрантов.
Если в условии указаны концентрации и объемы обоих титрантов, то расчет количества эквивалентов определяемого вещества производится прямо на основе этого уравнения.
Но в данной задаче расчет можно упростить, поскольку имеются данные о соотношении объемов обоих титрантов.
В соответствии с условием 25 мл соли Мора эквивалентны 24,2 мл перманганата калия. Это позволяет сразу определить объем перманганата калия, эквивалентный содержащемуся в пробе количеству хрома ( хотя хром был восстановлен под действием соли Мора):
197
V (KMnO4 ) = 24,2 - 6,1 = 18,1 мл .
Известное значение величины титра перманганата по хрому дает возможность очень просто рассчитать массу хрома, содержащуюся в исследуемом образце стали :
m(Cr) = Т(KMnO4/Cr) · V (KMnO4) = 0,0004498 · 18,1 = 0,008141 г .
Расчет массовой доли хрома ω (Cr) в стали производим по формуле:
ω (Cr) = [m (Cr) / m обр]· 100 = (0,008141 / 1,1220)· 100 = 0,72 %.
Титрование заместителя используют в следующих случаях:
-при нестехиометричности реакции;
-при образовании смеси нескольких продуктов реакции с непостоянным количественным соотношением между ними;
-при недостаточной скорости протекания реакции;
-при невозможности прямой реакции между определяемым веществом и реагентом.
Титрование заместителя осуществляют следующим образом: к анализируемому раствору прибавляют неотмеренный избыток вспомогательного реагента, с которым определяемое вещество вступает в стехиометрическую реакцию ; в результате реакции образуется эквивалентное по отношению к анализируемому веществу количество нового соединения, которое называют заместителем. Затем заместитель оттитровывают прямым титрованием.
Пример 3. Определение содержания меди в сплаве проводили иодометрическим методом. Для этого навеску сплава массой 2,3560 г после растворения и соответствующей предварительной подготовки перенесли в мерную колбу вместимостью 250 мл. К 20 мл полученного раствора добавили избыток сухого иодида калия и оттитровали выделившийся иод рабочим раствором тиосульфата натрия. На титрование израсходовано 12,50 мл тиосульфата натрия с концентрацией 0,1015 моль·л-1. Вычислить массовую долю меди в анализируемом сплаве.
198

Решение
В задаче рассматривается титрование методом замещения. Определяемое вещество - медь вступает в химическую реакцию с неотмеренным избытком вспомогательного реагента иодида калия. В результате реакции образуется иодид меди (I), количество эквивалентов которого точно равно количеству эквивалентов меди, взятой для анализа, и эквивалентному количеству свободного иода, поскольку иодид калия вступает в реакцию с медью в строго эквивалентных количествах. Выделившийся свободный иод оттитровывают тиосульфатом натрия.
Реакции, протекающие при определении: 2 Cu2+ I- e CuI
2I 2e I2
2 Сu2+ + 4I- = 2CuI↓ +I2
I2 2e 2I-
2S2O32 2e S4O62
2 S2O32- + I2 = 2 I- + S4O62- .
Определяем факторы эквивалентности для реагирующих веществ: fэкв(Cu) = 1, fэкв (I-) =1, fэкв(I2) = 1/2, fэкв(Na2 S2 O3) = 1.
Следовательно, равенство количества эквивалентов можно записать следующим образом:
n (Cu) = n(I- ) = n(1/2 I2) = n(Na2 S2 O3) .
Убирая промежуточные данные, получаем
n (Cu) = n(Na2 S2 O3).
Записываем формулы, позволяющие рассчитать количества эквивалентов меди и тиосульфата натрия:
n (Cu) = m (Cu) / M(Cu)
n(Na2 S2 O3) =[c (Na2 S2 O3) / 1000] · V (Na2 S2 O3).
199
Приравняв эти выражения, выводим формулу для расчета массы меди m1 (Cu), содержащейся в 20 мл приготовленного раствора сплава, взятого для титрования:
m1 (Cu) = [c (Na2 S2 O3) / 1000 ] ·V (Na2 S2 O3) · M(Cu) = = (0,1015 / 1000)·12,50·63,5 = 0,08056 г.
Поскольку общий объем приготовленного раствора анализируемого сплава составляет 250 мл, то масса меди, содержащаяся во всем объеме анализируемого раствора, m (Cu) равна
m (Cu) = [m1 (Cu) / 20] · 250 = (0.08056 / 20) · 250 =1,007 г .
Зная эту величину и массу навески сплава, можем рассчитать массовую долю меди в сплаве ω( Cu):
ω( Cu)= [m(Cu) / mобр.] · 100 =(1,0070 / 2,3560) ·100 =42,74%.
Пример 4. При перманганатометрическом определении кальция прямое титрование невозможно, поскольку кальций не взаимодействует с перманганатионом. Поэтому ионы кальция осаждают в виде оксалата кальция, прибавляя к анализируемому раствору неотмеренный избыток оксалата аммония. Осадок отмывают от избытка осадителя, растворяют в серной кислоте и образовавшуюся при этом щавелевую кислоту титруют раствором перманганата калия. Эта схема позволяет рассчитать количество кальция в анализируемом растворе.
Решение
Расчет количества кальция в анализируемом растворе m (Ca2+) основан на равенстве количества эквивалентов кальция, оксалата кальция, щавелевой кислоты и перманганата калия .
Факторы эквивалентности рассчитывают на основе уравнений реакций
1. CaCl2 + |
(NH4)2C2O4 |
= CaC2O4 + 2 NH4Cl ; |
2. CaC2O4 |
+ H2SO4 = |
H2C2O4 + CaSO4 ; |
3. 5H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 + 8H2O + K2SO4.
Электронно-ионные уравнения процессов окисления и восстановления
200
5 |
|
|
|
C2O4 |
2 2e 2CO2 |
|
|
||
|
|
|
|||||||
1 |
|
|
MnO4 |
- 8H+ 5e Mn2+ 4H2O |
|
|
|||
|
|
|
|||||||
|
|
|
|
||||||
5C2O42- |
+ 2 MnO4- + 16 H+ = 10CO2 + 2 Mn2+ + 8 H2O . |
||||||||
Отсюда |
|
|
|
|
|||||
|
|
|
|
|
|
|
fэкв(KMnO4) = 1/5, fэкв (C2O42-) =1/2, fэкв(H2C2O4) =1/2, |
||
|
|
|
|
|
|
|
fэкв(CaC2O4) =1/2, |
fэкв (Ca2+) = 1/2. |
|
Следовательно, можно записать равенство количества эквивалентов, опре- |
|||||||||
деляющее ход расчетов, |
|
|
|||||||
|
|
|
|
|
n (1/2 Ca2+) = n (1/2 CaC2O4) = |
n (1/2 H2C2O4) = n (1/5 KMnO4). |
|||
Убрав ненужные промежуточные данные, получаем: n (1/2 Ca2+) = n (1/5 KMnO4).
Записываем формулы, позволяющие рассчитать количества эквивалентов кальция и перманганата калия:
n (1/2 Ca2+) = m (Ca) / M(1/2 Ca2+) ,
n (1/5 KMnO4) = [c (1/5 KMnO4) / 1000] · V (KMnO4) .
Приравняв эти выражения, получаем возможность рассчитать определяемую массу кальция по формуле:
m (Ca2+) = [c (1/5 KMnO4) / 1000] · V (KMnO4) · M(1/2 Ca2+) .
Во всех приведенных примерах мы рассматривали использование рабочих растворов с известной концентрацией, то есть стандартных растворов. Следовательно, перед началом любого титриметрического определения необходимо провести предварительную работу по установлению точной концентрации рабочего раствора - его стандартизацию.
Для этого тоже используют процесс титрования: берут точную навеску установочного вещества (первичного стандарта) и оттитровывают ее приготовленным рабочим раствором. По результатам титрования рассчитывают точное значение концентрации приготовленного рабочего раствора.
В аналитическом контроле металлургического производства в зависимости от последующих задач в качестве первичных стандартов могут быть использованы не только соли, чистые металлы, их оксиды, но и специально подобранные стандартные образцы с известным химическим составом, соответствующим решению поставленных задач.
В качестве иллюстрации к сказанному рассмотрим следующий пример.
201

Пример 5. Для определения концентрации рабочего раствора арсенита натрия Na3AsO3 взято 0,3125 г стандартного образца стали с содержанием 1,05 % (масс.) марганца. После растворения стали марганец (II) переведен в перманганат-ион MnO4-, на титрование которого пошло 22,5 мл рабочего раствора Na3AsO3. Рассчитать молярную концентрацию эквивалента рабочего раствора арсенита натрия и его титр по марганцу.
Решение
Вданной задаче рассматривается процесс стандартизации рабочего раствора арсенита натрия Na3AsO3, то есть установления его точной концентрации, по реакции взаимодействия с установочным веществом - перманганатом калия KMnO4. Но в соответствии с целями дальнейшего использования титранта для его стандартизации применяют не просто готовый раствор перманганата калия
сизвестной концентрацией, а навеску стандартного образца стали с точно известным содержанием марганца, окисленного до перманганат-иона.
Впроцессе стандартизации в растворе протекает реакция между арсенитом натрия и перманганатом калия, схему которой можно записать следующим образом:
Na3AsO3+ KMnO4 → Na3AsO4 + MnSO4.
Для уравнивания реакции и определения факторов эквивалентности составим уравнения полуреакций восстановления и окисления соответствующих ионов:
2 MnO4- + 8H+ +5e → Mn2+ + 4H2O
5 AsO33- + H2O –2 e → AsO43- + 2H+
2 MnO4- + 16 H+ + 5 AsO33- + 5 H2O → 2 Mn2+ + 8 H2O + 5 AsO43- + 10 H+.
Сокращаем подобные члены в обеих частях уравнения и получаем полное ионное уравнение реакции:
2 MnO4- + 6 H+ + 5 AsO33- 2 Mn2+ + 3 H2O + 5 AsO43-,
а затем молекулярное уравнение реакции:
202

2 KMnO4 + 3 H2 SO4 + 5 Na3AsO3 |
→ 2 MnSO4 + 3 H2O + 5 Na3AsO4 . |
|
На основе уравнений полуреакций окисления и воссстановления вычисля- |
||
ем факторы эквивалентности для марганца и арсенита натрия |
||
fэкв (KMnO4) = 1/5 |
и |
fэкв (Na3AsO3) =1/2, |
а также эквивалентную массу марганца в этой реакции |
||
M (1/5 Mn) = M (Mn) / 5 = 55 / 5 = 11 г/моль. |
||
Теперь рассчитаем массу марганца в навеске стандартного образца стали |
||
m (Mn) (Mn) m (стали) 1,05 0,3125 0,00328 г. |
||
100 |
|
100 |
Число эквивалентов марганца n (Mn) |
в этой навеске можно вычислить по |
|
формуле |
|
|
m Mn
n (Mn) = M 1/5Mn ,
а число эквивалентов арсенита натрия n(1 2 Na3AsO3) через число эквивалентов Na3AsO3 в одном миллилитре раствора [с(1/2Na3AsO3)/1000] и объем этого раствора V(Na3AsO3), пошедший на титрование перманганата :
n (Na3AsO3) = [c (1/2 Na3AsO3) / 1000] · V (Na3AsO3).
Поскольку вещества реагируют в эквивалентных количествах, то n (1 2 Na3AsO3) = n (1 5 Mn) ,
то есть
|
m (Mn) |
|
c (1/ 2 Na3AsO3 ) |
V (Na3AsO3 ) . |
|
M (1/ 5 Mn) |
1000 |
||
Это равенство позволяет нам вычислить молярную концентрацию эквива- |
||||
лента рабочего раствора с (1/2 Na3AsO3) и титр рабочего раствора по марганцу
T (Na3AsO3 / Mn):
c (1/ 2 Na3AsO3 ) |
|
m (Mn) 1000 |
|
0,00328 1000 |
0,01325 моль/л. |
|
M (1/5 Mn) V (Na3AsO3 ) |
11 22,5 |
|||||
|
|
|
||||
Следовательно, |
|
|
|
|
|
|
T (Na3AsO3 |
/Mn) c (1/2 Na3AsO3 ) M (1/5 Mn) 0,0001457 г/мл. |
|||||
|
|
1000 |
|
|
|
|
|
|
203 |
|
|
|
|
Можно начать расчет концентрации рабочего раствора с вычисления титра рабочего раствора по определяемому веществу T (Na3AsO3/Mn), руководствуясь только определением этого понятия и двумя величинами: m(Mn) и
V (Na3AsO3).
T (Na3AsO3 / Mn) |
m (Mn) |
|
0,00328 |
0,0001457 г/мл. |
|
V (Na3AsO3 ) |
22,5 |
||||
|
|
|
Вычислив T (Na3AsO3/Mn), пересчитаем значение его величины на значение величины молярной концентрации эквивалента рабочего раствора арсенита на-
трия c (1/2 Na3AsO3):
с (1/2 Na2AsO3 ) T (Na2AsO3 / Mn) 1000 |
|
0,0001457 1000 |
0,01325 моль/л. |
M (1/5 Mn) |
|
11 |
|
Таким образом, найденная величина молярной концентрации эквивалента рабочего раствора арсенита натрия равна с (1/2 Na3AsO3) = 0,01325 моль/л, а
T (Na3AsO3/Mn) = 0,0001457 г мл.
Схема решения задачи №2 (Титриметрический анализ).
Записать название темы контрольной задачи. Полностью переписать условие задачи в тетрадь.
1.Определить и записать название метода титрования (кислотно-основное, окислительно-восстановительное, осадительное, комплексонометрическое) и способа его проведения (прямое, обратное, заместительное), рассматриваемых
вданной задаче.
2.Записать химическую схему определения, рассматриваемую в данной задаче, и уравнения реакций, лежащих в основе титрования.
3.Рассчитать факторы эквивалентности для реагирующих веществ.
4.Руководствуясь изложенными типовыми расчетами, записать равенство количества эквивалентов, определяющее ход решения, привести подробное обоснование решения требуемой задачи и все необходимые расчеты.
204
Физические и физико-химические методы анализа
Спектроскопические оптические методы анализа
Молекулярно-абсорбционный анализ Фотоэлектроколориметрия. Использование метода калибровочного гра-
фика при элементном количественном анализе в фотометрии
Задача 3.
Указания к решению задачи № 3
Фотометрические определения основаны на использовании закона Бугера- Ламберта-Бера, который выражается уравнением
А = l с ,
где А -абсорбция (оптическая плотность); с- молярная концентрация; l-толщина поглощающего слоя, см; -молярный коэффициент поглощения.
В задаче №3 рассматривается применение метода калибровочного (градуировочного) графика, который обычно применяют при многократных серийных определениях.
Для получения серии эталонных растворов с возрастающей концентрацией используют метод разбавления исходного первичного эталонного раствора, приготовленного из чистых металлов, солей, оксидов, стандартных образцов.
Затем приготовленные растворы фотометрируются (измеряется их оптическая плотность) и на основе результатов фотометрирования строится калибровочный график в координатах оптическая плотность - объем стандартного раствора, поскольку пересчет объема на концентрацию неизбежно вызывает необходимость округления данных при построении графика, а следовательно, и уменьшает точность определения.
По готовому графику определяется содержание элемента в анализируемом растворе после измерения его оптической плотности. Для этого по калибровочному графику определяют значение объема стандартного раствора и пересчитывают его на концентрацию (1 мкг = 10-6 г).
205
И эталонные растворы для построения калибровочного графика, и исследуемый раствор должны приготавливаться по одной и той же методике в мерных колбах одной и той же вместимости, и иметь примерно одинаковый состав по всем компонентам, отличаясь только по содержанию определяемого компонента.
Построенный градуировочный график может быть использован для многократного определения содержания элемента в однотипных образцах.
При построении калибровочного графика (на миллиметровой бумаге) необходимо правильно выбрать масштаб с тем, чтобы точность вычислений соответствовала точности исходных данных и требуемой точности результата измере-
ний.
Пример. Фотоэлектроколориметрическое определение содержания кремния в стали проводили на основе образования синего кремнемолибденового комплекса с использованием метода калибровочного графика. Навеску стали массой 0,2530 г растворили в кислоте и после соответствующей обработки получили 100 мл исследуемого раствора. Аликвотную (равнодольную) часть этого раствора объемом 10 мл поместили в мерную колбу вместимостью 100 мл, добавили все необходимые реагенты и получили 100 мл окрашенного раствора синего кремнемолибденового комплекса. Оптическая плотность (абсорбция) этого раствора равна Ах = 0,192. Для построения графика был приготовлен стандартный (эталонный) раствор с содержанием кремния 7,2 мкг/мл (Т(Si) = 7,2 мкг/мл). Объемы V стандартного раствора, взятые для построения графика равны 1,0; 2,0; 3,0; 4,0; 5,0; 6,0 мл. Измеренные значения оптических плотностей Аэт этих растворов соответствуют следующим величинам: 0,060; 0,105; 0,150; 0,195; 0,244; 0,290. Определить содержание (массовую долю)
кремния в исследуемом образце стали.
206

Решение
Решение задачи включает следующие этапы:
1.Построение калибровочного графика.
2.Определение по калибровочному графику содержания кремния, соответствующего измеренному значению величины оптической плотности исследуемого раствора.
3.Расчет содержания (массовой доли) кремния в анализируемом образце стали с учетом разбавления анализируемого раствора.
Следуя этому порядку приводим решение задачи.
1. Построение градуировочного (калибровочного) графика. Эксперимен-
тальные данные по объемам стандартного раствора V и соответствующим им значениям оптических плотностей А заносим в таблицу 7.
Таблица 7
Результаты измерения оптических плотностей А стандартных растворов
V, мл |
1,0 |
2.0 |
3,0 |
4,0 |
5,0 |
6,0 |
|
|
|
|
|
0,244 |
|
А |
0,060 |
0,105 |
0,150 |
0,195 |
0,290 |
По этим данным строим калибровочный график (рис.8). Калибровочный график обычно строят в координатах оптическая плотность – объем стандартного раствора, чтобы избежать округления данных и уменьшения точности оп-
ределения. При построении калибровочного графика (на миллиметровой
бумаге) необходимо правильно выбрать масштаб с тем, чтобы точность вычислений соответствовала точности исходных данных и требуемой точности результата измерений. При этом разметка осей производится в мас-
штабных единицах, а не по значениям экспериментальных величин.
После построения калибровочного графика приступают к выполнению определения содержания кремния в заданном образце стали.
2. Определение по графику содержания кремния, соответствующего измеренному значению величины оптической плотности исследуемого раствора.
В соответствии с условием, измеренная величина оптической плотности анализируемого раствора равна Ах = 0,192. По графику величине оптической плотности Ах = 0,192 соответствует объем стандартного раствора кремния, равный Vх (Si) = 3,88 мл. Масса кремния, соответствующая этому объему, равна
mх (Si) = T (Si) · Vx (Si) = 7,2 · 10-6 · 3,88 = 2,794 · 10-5 г.
207
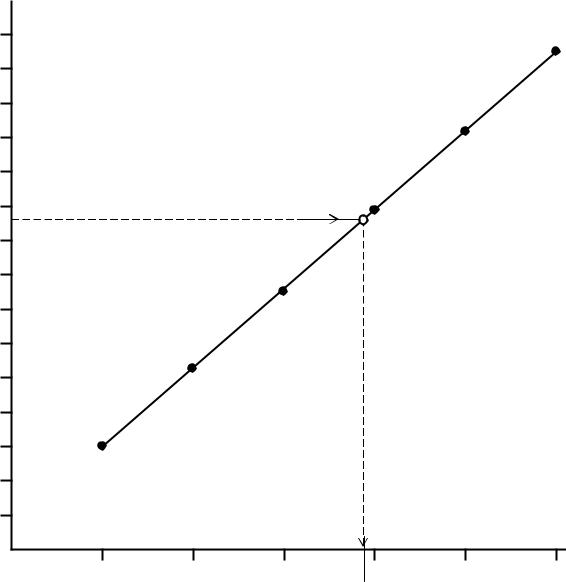
A |
|
|
|
|
|
|
0,300 |
|
|
|
|
|
|
0,280 |
|
|
|
|
|
|
0,260 |
|
|
|
|
|
|
0,240 |
|
|
|
|
|
|
0,220 |
|
|
|
|
|
|
0,200 |
|
|
|
|
|
|
Ax |
|
|
|
|
|
|
0,180 |
|
|
|
|
|
|
0,160 |
|
|
|
|
|
|
0,140 |
|
|
|
|
|
|
0,120 |
|
|
|
|
|
|
0,100 |
|
|
|
|
|
|
0,0800 |
|
|
|
|
|
|
0,060 |
|
|
|
|
|
|
0,040 |
|
|
|
|
|
|
0,020 |
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
Vx |
|
V(Si), мл |
|
Рис. 8. Калибровочный график для определения кремния |
|||||
3. Расчет содержания кремния (массовой доли) в анализируемом образце стали с учетом разбавления анализируемого раствора. Найденное по графику содержание кремния соответствует аликвотной части анализируемого раствора, равной 10 мл, а вся навеска стали растворена в объеме 100 мл. Поэтому масса кремния m(Si), содержащаяся во всей навеске стали, равна
m (Si) = [mх (Si) · 10] · 100 = [2,794 · 10-5/10] · 100 = 2,794 · 10-4 г .
Массовая доля кремния ω (Si) в анализируемой навеске стали m (стали) рассчитывается по формуле:
ω (Si) = [m (Si) / mстали] · 100% = [2,794 · 10-4 / 0,2530)] · 100% = 0,11%.
208
Схема решения задачи №3 (Молекулярно-абсорбционная спектроскопия. Фотоэлектроколориметрия).
1.Записать название темы контрольной задачи.
2.Полностью переписать условие только своего варианта задачи, выделив следующие пункты:
–определяемый элемент;
–метод определения;
–данные для построения калибровочного графика: объемы стандартного раствора и соответствующие им измеренные значения величины оптической плотности;
–значение величины оптической плотности исследуемого раствора Ах;
–значение величины концентрации (титра) стандартного раствора Т;
–объем аликвотной части раствора;
–условия приготовления анализируемого раствора, в частности масса навески образца и общий объем анализируемого раствора.
3.Решить задачу в соответствии с рекомендуемой схемой:
–построить калибровочный график на миллиметровой бумаге, правильно подобрав масштаб с учетом точности измеренных величин;
–найти по калибровочному графику объем Vx, соответствующий измеренному значению величины абсорбции исследуемого раствора Ах;
–рассчитать содержание определяемого компонента (массовую долю) в анализируемом образце с учетом разбавления анализируемого раствора.
209
Атомно-эмиссионный спектральный анализ Атомно-эмиссионный спектральный анализ с фотографической регистра-
цией спектра. Метод трех эталонов
Задача № 4
Аналитическим сигналом в методе АЭС служит интенсивность эмиссионной спектральной линии, которая линейно связана с концентрацией с зависимостью:
I = a с.
Коэффициент a является чисто эмпирической величиной, поэтому только правильный выбор условий атомизации и измерения аналитического сигнала могут обеспечить получение воспроизводимых результатов.
В реальных условиях указанная простая зависимость обычно нарушается вследствие многообразных побочных эффектов, имеющих как оптическую, так и физико-химическую природу.
Оптические (спектральные) помехи связаны со взаимодействием вещества с излучением, физико-химические помехи - со взаимодействием веществ между собой, неполнотой испарения пробы и рядом других физических и химических причин.
Из числа спектральных помех прежде всего следует отметить такие процессы, как самопоглощение, излучение и поглощение фона, наложение атомных спектральных линий.
Самопоглощение проявляется в том, что часть излучения возбужденных атомов может поглощаться невозбужденными атомами того же элемента, которые находятся в периферийной, более холодной части атомизатора. Степень самопоглощения возрастает с увеличением концентрации атомного пара, что приводит к нарушению линейной зависимости I от с, рост интенсивности излучения замедляется и линейность функции нарушается. С учетом самопоглощения зависимость между интенсивностью спектральной линии и концентрацией анализируемого элемента выражается эмпирическим уравнением Ломакина-
Шайбе
I = a с b,
где b - коэффициент самопоглощения. При малых концентрациях b = 1, а при увеличении и концентрации непрерывно меняется от 1 до 0.
210
При работе в достаточно узких концентрационных диапазонах величину b можно считать практически постоянной. В логарифмических координатах зависимость интенсивности от концентрации близка к прямолинейной:
lg I = lg a + b · lg c ,
что позволяет использовать для аналитических целей и нелинейный участок зависимости I от с. Для источников ИСП самопоглощение очень незначительно.
В связи с тем, что интенсивность аналитического сигнала в значительной степени зависит от температуры, для улучшения воспроизводимости в АЭС используют не абсолютную интенсивность аналитической линии, а относительную интенсивность двух линий, а именно линии анализируемого элемента I и линии элемента сравнения (внутреннего стандарта) I0. Такая пара линий на-
зывается аналитической.
Внутренний стандарт в АЭС подбирается так, чтобы его содержание в анализируемом образце и во всех образцах, применяемых для градуировки, было примерно одинаково. Чаще всего для этого используется элемент основы: например, при анализе сталей в качестве внутреннего стандарта используется железо, при анализе медных сплавов - медь и т. д. Относительная интенсивность аналитической пары линий зависит только от концентрации анализируемого элемента.
Основные способы регистрации спектров в АЭС для целей количественного анализа - фотографический и фотоэлектрический. При фотоэлек-
трической регистрации спектра световой сигнал с помощью фотоэлектрических преобразователей (фотоэлементы, фотоэлектронные умножители ФЭУ) преобразуется в электрический сигнал, величина которого пропорциональна интенсивности падающего на детектор светового потока. При фотографической регистрации спектра используются фотопластинки или фотопленки. Степень почернения изображения спектральной линии на пластинке или пленке пропорциональна интенсивности светового потока, падающего на приемник излучения. Степень почернения измеряют с помощью микрофотометра.
Измерение почернения спектральной линии анализируемого элемента проводят по отношению к интенсивности линии элемента сравнения. Полученная разность степеней почернения S, равная разности степени почернения линии определяемого элемента Sопр и элемента сравнения Sсравн , рассчитывается как
S = Sопр - Sсравн .
211
Величина S прямо пропорциональна логарифму концентрации определяемого элемента lg с. На основании данных по рассчитанным величинам S и lg с строят калибровочный график зависимости разности почернений линий определяемого элемента и элемента сравнения от логарифма концентрации определяемого элемента. Калибровочный график позволяет рассчитать содержание анализируемого элемента в исследуемом образце, если для него измерена разность степеней почернения линий определяемого элемента и элемента сравнения.
Для проведения количественного анализа используют два основных метода построения калибровочного графика: метод трех эталонов и метод посто-
янного графика.
Метод трех эталонов состоит в том, что на одну и ту же фотопластинку фотографируют спектры трех эталонов с известным содержанием определяемого элемента и спектр анализируемого образца. При этом в качестве эталонов
могут быть использованы только те образцы, которые по качественному, количественному и структурному составу полностью соответствуют определяемому образцу.
В данном методе сначала измеряют степень почернения выбранных спектральных линий для эталонных и анализируемого образцов. Затем рассчитывают разность степеней почернений линий определяемого элемента и элемента сравнения, вычисляют логарифмы концентраций определяемого элемента для эталонных образцов. По полученным данным строят калибровочный график по трем точкам: зависимость разности почернений линий определяемого элемента и элемента сравнения от логарифма концентрации определяемого элемента.
Далее вычисляют разность степеней почернения спектральных линий определяемого элемента и элемента сравнения для анализируемого образца, спектр которого сфотографирован на ту же пластинку.
По вычисленной разности степеней почернения с помощью калибровочного графика находят логарифм содержания определяемого элемента и пересчитывают его значение на массовую долю определяемого элемента в анализируемом образце.
212

Пример. Определить массовую долю вольфрама в образце стали, используя метод трех эталонов. Для построения калибровочного графика были взяты три эталона с массовой долей вольфрама ω (%) соответственно: 0,78; 1,37; 2,19. При фотометрировании линий вольфрама для трех эталонных образцов получены следующие значения почернений линий S (W): 0,388; 0,472; 0,494. Для линий элемента сравнения железа значения степеней почернения составляют: S (Fe): 0,462; 0,468; 0,424. Для анализируемого образца степень почернения линии вольфрама S (W) составила 0,516, а для элемента сравнения (железа) –
S (Fe) = 0,452.
Решение
Решение задачи включает следующие этапы:
1. Построение калибровочного графика зависимости разности степеней
почернения линий |
определяемого |
элемента |
и элемента |
сравнения |
S = S (W) − S(Fe) |
от логарифма |
концентрации |
определяемого |
элемента |
lg ω (W) для трех эталонных образцов. |
|
|
||
2.Определение по графику логарифма содержания вольфрама, соответствующего вычисленной разности значений степеней почернения линий вольфрама и железа для анализируемого образца.
3.Расчет содержания (массовой доли) вольфрама в анализируемом образ-
це.
Следуя данному порядку приводим решение задачи.
1.Построение калибровочного графика. Для проведения расчетов, необхо-
димых для построения градуировочного (калибровочного) графика, все данные для эталонных образцов, приведенные в условиях задачи, заносим в табл. 8.
|
|
|
Таблица 8 |
|
|
Характеристики эталонных образцов |
|
||
|
|
Эталоны |
|
|
Параметры |
|
|
||
|
|
|
||
1 |
2 |
3 |
||
|
||||
|
|
|
|
|
ώ (W) |
0,780 |
1,370 |
2,190 |
|
|
|
|
|
|
S (W) |
0,388 |
0,472 |
0,494 |
|
|
|
|
|
|
S (Fe) |
0,462 |
0,468 |
0,424 |
|
|
|
|
|
|
213
Для построения графика вычислим значения разностей степеней почернения линий вольфрама и железа по формуле
S = Sопр - Sсравн = S(W) - S(Fe).
S1 = 0,388 - 0,462 = - 0,074
S2 = 0,472 - 0,468 = + 0,004
S3 = 0,494 - 0,424 = + 0,070
Далее вычислим значения логарифмов концентраций (массовых долей) вольфрама
lg ω1 |
(W) = |
lg 0,78 |
= |
- 0,108 |
|
lg ω2 |
(W) |
= |
lg 1,37 |
= |
+ 0,137 |
lg ω3 |
(W) |
= |
lg 2,19 |
= |
+ 0,340 |
На основе полученных вычислений, внесенных в табл. 9, строим калибровочный график зависимости разности степеней почернения спектральных линий определяемого элемента вольфрама трех эталонов от логарифма содержания определяемого элемента в этих эталонах. Полученная зависимость должна быть линейной.
|
|
|
Таблица 9 |
Параметры для построения градуировочного графика |
|||
|
|
|
|
S |
- 0,074 |
0,004 |
0,070 |
|
|
|
|
lg ω (W) |
- 0,108 |
0,137 |
0,340 |
|
|
|
|
214
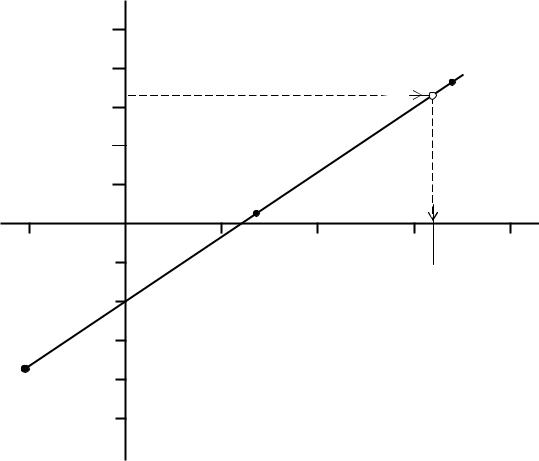
|
+ |
S |
|
|
|
|
0,100 |
|
|
|
|
|
0,080 |
|
|
|
|
|
+ |
Sx |
|
|
|
|
0,060 |
|
|
|
|
|
0,040 |
|
|
|
|
|
0,020 |
|
|
|
|
–0,100 |
+0,100 |
+0,200 |
+0,300 |
+0,400 |
|
–lg ω |
–0,020 |
|
+lg ωx |
+lg ω |
|
|
|
|
|||
|
–0,040 |
|
|
|
|
|
–0,060 |
|
|
|
|
|
–0,080 |
|
|
|
|
|
–0,100 |
|
|
|
|
|
– |
S |
|
|
|
Рис.9. Зависимость разности почернений линий определяемого |
|||||
элемента (W) и элемента сравнения (Fe) от логарифма концентрации (мас- |
|||||
|
совой доли ω) определяемого элемента (W) |
|
|||
2. Определение по графику логарифма содержания вольфрама в анализи- |
|||||
руемом образце. По данным условия задачи вычислим значение |
Sх , соответ- |
||||
ствующего |
разности значений степеней почернения линий вольфрама и железа |
||||
для анализируемого образца: |
|
|
|
||
Sх = Sх (W) - Sх (Fe) = 0,516 - 0,452 = 0,064.
По калибровочному графику найдем соответствующее этому значению Sх значение логарифма содержания вольфрама в анализируемом образце lg ωх (W). Найденное значение равно lg ωх (W) = 0,319 .
215
3. Расчет массовой доли вольфрама в анализируемом образце. Содержа-
ние вольфрама в анализируемом образце находим путем пересчета значения величины логарифма содержания вольфрама на его абсолютное значение
ω (W) = 2,08 %.
Схема решения задачи №4 (Эмиссионный спектральный анализ. Метод трех эталонов).
1.Записать название темы контрольной задачи.
2.Полностью переписать условие только своего варианта задачи, выделив следующие пункты:
–определяемый элемент в анализируемом веществе;
–характеристики трех эталонных образцов для заданного варианта определения: массовые доли определяемого элемента в трех заданных эталонах, степени почернения спектральных линий определяемого элемента и элемента сравнения;
–значения степеней почернения линий определяемого элемента и элемента сравнения в заданном анализируемом образце в соответствии с заданным вариантом.
3.Решить задачу в соответствии с рекомендуемой схемой:
свести в таблицу данные по характеристикам эталонных образцов в соответствии с приведенным примером;
–рассчитать разности степеней почернения линий определяемого элемента и элемента сравнения ∆ S = Sопр - Sсравн для трех эталонных образцов;
–рассчитать логарифмы концентраций определяемого элемента для трех эталонных образцов;
–составить таблицу вычисленных параметров для построения графика;
–построить калибровочный график зависимости разности степеней почернения линий определяемого элемента и элемента сравнения ∆ S от логарифма
216
концентрации определяемого элемента lg с для трех эталонных образцов; калибровочный график построить на миллиметровой бумаге, правильно подобрав масштаб с учетом точности измерения и знаков измеренных величин;
–вычислить разность значений степеней почернения линий определяемого элемента и элемента сравнения для анализируемого образца;
–определить по графику значение логарифма содержания определяемого элемента, соответствующего вычисленной разности значений степеней почернения линий для анализируемого образца;
–рассчитать содержание (массовую долю) определяемого элемента в анализируемом образце.
217

Электрохимические методы анализа Задача 55
Потенциометрический анализ. Прямая потенциометрия. Потенциометрическое титрование
Понятие потенциала рассматривается как способность системы совершать работу. Электродный потенциал определяется как равновесное значение потенциала между металлом и раствором, содержащим его катионы.
Потенциометрия и потенциометрическое титрование основано на существовании зависимости равновесного потенциала электрода от активности (концентрации) определяемого иона.
Зависимость окислительно-восстановительного потенциала Eox / red |
от кон- |
||||
центрации и от температуры выражается уравнением Нернста: |
|
||||
Еоx/red = Е0оx/red + |
RT |
ln |
aox |
, |
(2) |
nF |
|
||||
|
|
a |
|
||
|
|
|
red |
|
|
где Е0оx/red – стандартный окислительно-восстановительный потенциал; R – универсальная газовая постоянная, равная 8,312 Дж/(моль·К); Т – абсолютная температура; F – постоянная Фарадея, равная 96485 Кл/моль; n –число электронов, принимающих участие в электродном процессе; aox и ared – активности окисленной и восстановленной формы вещества.
Активность (или активная концентрация) связана с истинной концентрацией с через величину коэффициента активности γ соотношением
а = γ · с.
Коэффициент активности фактически количественно отражает кажущееся уменьшение концентрации частиц в растворе за счет взаимодействия между противоположно заряженными ионами. В разбавленных растворах эффектом взаимодействия можно пренебречь и считать активную (эффективную) концентрацию равной истинной, то есть а = с.
Cтандартный окислительно-восстановительный потенциал Е0оx/red равен потенциалу системы при активностях компонентов, равных 1, то есть в гипотетически одномолярном растворе при коэффициентах активности, равных 1, при данной температуре и нормальном атмосферном давлении.
5 Вариант контрольной задачи выбирается студентом в зависимости от его шифра.
218
Если подставить в уравнение (2) числовые значения констант, абсолютную температуру 298 К (25 °С) и перейти от натуральных логарифмов к десятичным, то получим:
Еоx/red = Е0оx/red + 0,059 |
lg |
aox |
E0ox / red |
0,059 lg |
[ox] ox |
. |
(3) |
|
|||||||
ared |
|
||||||
n |
|
|
n |
[red] red |
|
||
Для измерения потенциала электрода необходимо составить гальванический элемент из соответствующего индикаторного электрода, потенциал которого является функцией активности определяемого иона, и электрода сравнения, потенциал которого не меняется при изменении активности определяемого иона. Обычно в качестве электродов сравнения используются хлоридсеребряный или каломельный электроды, потенциалы которых по отношению к стандартному водородному электроду точно известны. (Подробно смотри раздел 2.1.2.).
Измерив потенциал индикаторного электрода, можно рассчитать активность (концентрацию) определяемого иона. Этот метод называется прямой по-
тенциометрией.
При применении электрода из вещества, ионы которого содержатся в растворе, расчет производится по уравнению (4)
Е = Е0 + |
0,059 |
lg a i . |
(4) |
|
n |
|
|
Если рассматриваются системы, содержащие и окислинную, и восстановленную форму веществ, то потенциал этой системы выражается уравнением
|
0,059 |
lg |
a |
|
Еоx/red = Е0оx/red + |
n |
ox |
. |
|
a |
||||
|
|
|
red |
|
Косвенная потенциометрия или потенциометрическое титрование ос-
новано на измерении в анализируемом растворе потенциала электрода, меняющегося в ходе протекания химической реакции при изменении концентрации определяемого иона. В ходе титрования потенциал измеряют после добавления каждой порции титранта. При приближении к концу титрования величина потенциала начинает быстро меняться (скачок титрования). Точку конца титрования определяют по самому резкому изменению величины потенциала в этой области.
Экспериментальные данные записываются в виде таблицы, содержащей значения объема прибавляемого титранта Vт и соответствующего значения потенциала E. По полученным данным строится кривая потенциометрического титрования в интегральной форме в координатах Е - Vт, по точке перегиба которой определяется точка эквивалентности Vэкв. (рис. 10,а). Зная концентрацию
219

стандартного раствора и объем титранта, пошедший на титрование, рассчитывают содержание определяемого иона в растворе. Если точку эквивалентности по полученным данным определить сложно (пологая кривая), то точность нахождения конечной точки можно повысить путем дифференцирования кривой титрования, построив ее в виде первой производной ∆E/∆V - V ( рис. 10,б).
Рис. 10. Графический способ нахождения конечной точки титрования по интегральной кривой (а) и по первой производной (б) кривой потенциометрического титрования
В потенциометрическом титровании используют кислотно-основные, окислительно-восстановительные, осадительные и комплексонометрические реакции. При этом можно титровать окрашенные и мутные растворы, анализировать смеси близких по своим свойствам веществ без их предварительного разделения, поскольку при построении кривой титрования по отдельным точкам на ней будет отмечено несколько скачков титрования. Скорость определения при анализе сложных производственных объектов значительно увеличива-
220
ется по сравнению с классическими титриметрическим методами с визуальной индикацией конечной точки титрования.
П р я м а я п о т е н ц и о м е т р и я Расчеты в задачах по прямой потенциометрии основаны на использовании
уравнения Нернста: либо по заданной концентрации необходимо рассчитать потенциал электрода, либо, наоборот, по измеренному значению электродного потенциала необходимо рассчитать концентрацию анализируемого раствора.
Вобоих случаях необходимо использовать следующую схему:
–записать выражение уравнения Нернста;
–выписать из справочных таблиц значение стандартного потенциала для анализируемой системы;
–учесть, что стандартный потенциал водородного электрода, используемого в качестве электрода сравнения, условно принят равным нулю;
–учесть, что в рассматриваемых системах активность можно считать равной концентрации;
–учесть, что при расчетах по уравнению Нернста используется величина молярной концентрации.
П о т е н ц и о м е т р и ч е с к о е т и т р о в а н и е Задача по потенциометрическому титрованию решается по схеме:
–записать уравнения реакции, протекающей в процессе потенциометрического титрования;
–построить кривую титрования в координатах Е - V;
– вычислить отношения ∆E/∆V и записать их в соответствующую таблицу;
–построить на миллиметровой бумаге кривую титрования в координатах ∆Е/∆V – V, правильно подобрав масштаб для более точного определения точки конца титрования;
–определить конечную точку титрования Vэкв. по первому графику и его уточненное значение по второму графику;
–рассчитать массу определяемого элемента в анализируемом растворе;
–рассчитать массовую долю определяемого элемента в анализируемом образце.
221
Пример 1. Прямая потенциометрия. Вычислить электродный потенциал медного электрода, помещенного в раствор сульфата меди, содержащий 1,5955 г CuSO4 в 1000 мл раствора, относительно стандартного водородного электрода.
Решение
Рассчитаем молярную концентрацию раствора сульфата меди
с (CuSO4) = m (CuSO4) / M (CuSO4) = 1,5955 / 159,55 = 0,01 моль/л.
Потенциал стандартного водородного электрода принят равным нулю Е02Н+/Н2= 0 В. Стандартный потенциал пары Cu2+ /Cu равен 0,34 В. Поэтому для расчета потенциала медного электрода, опущенного в раствор его соли, используем уравнение (4):
Е Е0 |
2 |
|
|
0,059 lg a (Cu 2 ) 0,340 |
|
0,059 lg 0,01 |
|
Cu |
|
/ Cu |
|
n |
|
|
2 |
|
|
|
|
|
|
||
|
|
|
0,340 0,059 |
0,281 B . |
|
|
|
222

Пример 2. Потенциометрическое титрование. В навеске сплава массой
1,2500 г определяли содержание хрома потенциометрическим титрованием. При растворении сплава хром окислили до хромовой кислоты H2CrO4. Титрование проводили раствором сульфата железа (II) с концентрацией Т(FeSO4/Cr) = 0,005020 г/мл. Вычислить массовую долю (масс. %) хрома в сплаве по следующим данным потенциометрического титрования (табл. 10).
Таблица 10
Результаты потенциометрического титрования хрома (VI) рабочим раствором железа (II)
V (FeSO4), мл |
E, В |
5 |
600 |
|
|
6 |
610 |
|
|
7 |
620 |
|
|
8 |
635 |
|
|
9 |
660 |
|
|
10 |
690 |
|
|
11 |
725 |
|
|
12 |
765 |
|
|
13 |
805 |
|
|
V(FeSO4), мл |
E, В |
14 |
|
855 |
|
15 |
|
915 |
|
15,2 |
|
935 |
|
15,3 |
|
953 |
|
15,4 |
|
977 |
|
15,5 |
|
982 |
|
16 |
|
990 |
|
17 |
|
995 |
|
20 |
|
997 |
|
|
|
223

Решение
Решение задачи включает следующие этапы:
1.Запись уравнения реакции, протекающей в процессе титрования.
2.Построение кривой титрования в координатах Е - V.
3.Вычисление отношений ∆E /∆V и запись их в соответствующую табли-
цу.
4.Построение кривой титрования в координатах ∆E/∆V - V.
5.Определение конечной точки титрования Vэкв.(FeSO4 ) по первому графику и его уточненного значения по второму графику.
6.Расчет массы хрома в анализируемом растворе.
7.Расчет массовой доли хрома в анализируемом образце сплава.
Следуя указанному порядку приводим решение задачи.
1. Уравнение реакции, протекающей в процессе титрования. Определяе-
мым элементом в сплаве является хром (VI), который титруют рабочим раствором сульфата железа (II). Этому процессу отвечает реакция:
|Cr6+ + 3e = Cr3+ 3|Fe2+ + e = Fe3+
Cr6+ + 3 Fe2+ = Cr3+ + 3 Fe3+
2. Построение кривой титрования в координатах Е - V.
В соответствии с данными условиями построим интегральную кривую зависимости Е - V (рис.11).
224
E, мВ 1000
950
900
850
800
750
700
650
600
550
500
5 |
7 |
9 |
11 |
13 |
15 |
17 |
19 |
V, мл
Рис. 11. Интегральная кривая потенциометрического титрования хрома (VI) рабочим раствором железа (II)
По этой кривой невозможно определить точку конца титрования. Даже при увеличении масштаба и построении только центральной части графика, то есть области скачка титрования (рис. 11, а), эквивалентный объем определить невозможно.
225

E, мВ 1000
950
900
850 
800
14 |
14,5 |
15 |
15,5 |
16 V, мл |
Рис.11, а. Центральная часть интегральной кривой потенциометрического титрования хрома (VI) рабочим раствором железа (II)
Поэтому переходим к построению кривой титрования в виде первой производной функции Е = f (V).
3. Вычисление отношений E/ V и запись их в соответствующую табли-
цу. На основе данных табл. 10 вычислим отношения E/ V и сопоставим их с соответствующими объемами (табл. 11).
226

Таблица 11
Данные для построения первой производной кривой потенциометрического титрования хрома (VI) рабочим раствором железа (II)
V (FeSO4), мл |
E/ V |
V (FeSO4), мл |
E/ V |
|
|
15 |
|
6 |
10 |
60 |
|
|
|
15,2 |
|
7 |
10 |
100 |
|
|
|
15,3 |
|
8 |
15 |
180 |
|
|
|
15,4 |
|
9 |
25 |
240 |
|
|
|
15,5 |
|
10 |
30 |
50 |
|
|
|
16 |
|
11 |
35 |
16 |
|
|
|
17 |
|
12 |
40 |
5 |
|
|
|
20 |
|
13 |
40 |
0.66 |
|
|
|
|
|
14 |
50 |
|
|
|
|
|
|
4. Построение кривой титрования в координатах E / V - V. На основе данных табл.11 построим центральную часть кривой потенциометрического титрования в координатах Е/ V – V (рис.12).
227
∆E/∆V, 250
200
150
100
50
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
14,5 |
15 |
15,5 |
16 |
|||||
|
|
|
|
|
|
Vx |
|
V, мл |
|
Рис.12. Кривая потенциометрического титрования хрома (VI ) рабочим раствором железа(II) в координатах Е/ V - V
5.Определение конечной точки титрования Vэкв.(FeSO4). В данном слу-
чае конечную точку титрования Vэкв.(FeSO4) можно определить только
по последнему варианту кривой титрования (рис.12). В этом случае она определяется очень четко:
Vэкв. (FeSO4 ) = 15,4 мл .
228
6. Расчет массы хрома в анализируемом растворе. По условию задачи из-
вестен титр рабочего раствора сульфата железа по определяемому веществу -
хрому, |
то есть количество граммов хрома, эквивалентное в данной реакции |
1 мл |
рабочего раствора - сульфата железа. Эта величина составляет |
Т (FeSO4/Cr) = 0,005020 г/мл. Эквивалентный объем рабочего раствора сульфата железа найден по графику: Vэкв (FeSO4) = 15,4 мл. Поэтому масса хрома в анализируемом растворе вычисляется по формуле:
m (Cr) = Т (FeSO4/Cr) · Vэкв.(FeSO4 ) = 0,005020 · 15,4 = 0,07731 г.
7. Расчет массовой доли хрома в анализируемом образце сплава. Зная на-
веску сплава mобр и массу хрома m (Cr) в этой навеске, можно рассчитать массовую долю хрома (масс. %) в анализируемом образце:
ω (Cr) = [m (Cr ) / mобр ] · 100 % = [0,07731 / 1,2500] · 100 % = 6,18 %.
Схема решения задачи №5 (Вариант - Прямая потенциометрия и потенциометрическое титрование)
1.Записать название темы контрольной задачи.
2.Полностью переписать условие задачи.
3.Решить задачу в соответствии с приведенными выше рекомендуемыми
схемами решения как для прямой потенциометрии, так и для потенциометрического титрования.
229
Вольтамперометрический метод анализа Полярография
Если в электрохимической ячейке ток возникает в результате самопроизвольной химической реакции, то такая ячейка называется гальваническим элементом. В состоянии химического равновесия электрохимическая реакция протекает в обоих направлениях с одинаковыми скоростями и систему называют равновесной. Потенциал, приобретаемый индикаторным электродом в условиях равновесия, называют равновесным потенциалом Ер.
Как только во внешней цепи начинает протекать электрический ток за счет источника постоянного напряжения, электрохимическая ячейка становится потребителем внешней энергии и будет работать в режиме электролитической ячейки.
Прохождение тока во внешней цепи вызывает отклонение потенциала одного или обоих электродов от равновесного значения Ер, приобретаемого электродом в отсутствие тока во внешней цепи. Это явление называется поляриза-
цией. Зависимость ток - потенциал называется поляризационной кривой.
Методы, основанные на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическими. Классический вариант вольтамперометрии, в котором в качестве индикаторного электрода используется капающий ртутный электрод, называется полярографией. Это название сохранено в память создателя метода чешского ученого Ярослава Гейровского, удостоенного Нобелевской премии за выдающиеся заслуги в развитии теории и практики этого метода.
Полярографический метод позволяет получать качественную и количественную информацию о веществах, окисляющихся или восстанавливающихся на индикаторном микроэлектроде. Он используется для анализа и неорганических веществ, и для органических соединений в различных объектах; этим методом можно одновременно определять до четырех - пяти компонентов; он позволяет получить линейную зависимость тока от концентрации в диапазоне от 10-2 до
10-8 М.
230
Итак, в полярографической ячейке имеются два электрода: поляризующийся индикаторный и неполяризующийся электрод сравнения. Это достигается прежде всего большим различием в площадях поверхности электродов. Площадь индикаторного электрода очень мала и он называется микроэлектродом. В классической полярографии в качестве индикаторного электрода (катода) используется капающий ртутный электрод (ртуть - жидкий металл) с диаметром капилляра 0,05...0,1 мм и периодом капания ртути 3...5 с. В качестве электрода сравнения (анода) используют ртуть, налитую на дно электролитической ячейки или насыщенный каломельный электрод. Поскольку площадь поверхности микроэлектрода во много раз меньше площади поверхности электрода сравнения, то плотность тока на микроэлектроде во много раз (десятки тысяч) больше, чем на электроде сравнения. Поэтому при наложении внешнего напряжения микроэлектрод поляризуется (его потенциал отклоняется от равновесного значения), а потенциал электрода сравнения остается практически постоянным (электрод не поляризуется).
Следовательно, поляризационные кривые, полученные в координатах ток - напряжение, характеризуют зависимость поляризации микроэлектрода от приложенного напряжения. Эта зависимость называется полярограммой. Рабочая область капающего ртутного электрода лежит в диапазоне от + 0,3 до - 1,8 В. Поэтому его использование возможно только для определения ионов достаточно активных металлов. Кроме ртутных, индикаторные микроэлектроды в современных вариантах вольтамперометрии изготавливаются из платины и токопроводящих углеродных материалов (графит, стеклоуглерод).
Классическая полярограмма в схематической форме представлена на рис. 13:
231
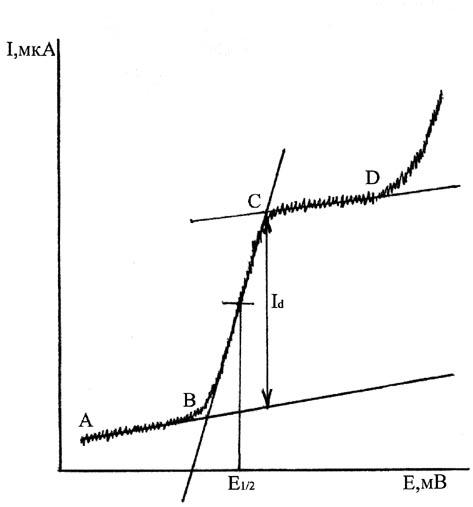
Рис 13. Схематическое изображение классической полярограммы
В ячейку кроме двух указанных электродов помещается анализируемый раствор и индифферентный электролит полярографический фон с концентрацией 0,05...1 М, превышающей концентрацию определяемого иона на 2...3 порядка. Ячейку через калиброванное линейное сопротивление присоединяют к источнику постоянного напряжения и изменяют потенциал со скоростью
2...5 мВ/с.
Форма полярограммы напоминает волну и по традиции называется полярографической волной. На ней можно выделить три основных участка:
1. На начальном участке АВ ток почти не меняется, что свидетельствует о том, что до начала электрохимической реакции ртутный электрод практически идеально поляризуется. Эта область называется областью остаточного тока, основной вклад в который вносит формирование двойного электрического слоя
(конденсаторный ток) и ток разряда электроактивных примесей. Остаточный
232
ток не зависит от концентрации определяемого вещества, и потому его стремятся уменьшить, используя очищенные реактивы и воду.
2. При достижении величины потенциала выделения (точка В) определяемого иона на микроэлектроде начинается электрохимическая реакция вос-
становления определяемого иона металла на поверхности ртутной капли и образования амальгамы:
Men+ + ne + Hg Me (Hg)амальгама .
При этом рост тока опережает возрастание потенциала, то есть электрод деполяризуется. На этом участке необходимо выделить точку, которая соответству-
ет середине и называется потенциалом полуволны Е1/2. Величина потенциа-
ла полуволны не зависит от концентрации определяемого вещества, а оп-
ределяется только его природой. Данные по величинам потенциалов полуволн сведены в специальные справочные таблицы, которые являются основой для качественного анализа исследуемого раствора.
Массоперенос ионов в растворе осуществляется за счет электростатического притяжения ионов полем электрода, диффузии, механической или тепловой конвекции. Конвекционную составляющую можно не учитывать, поскольку она очень мала. Электростатическое притяжение определяемых ионов устраняется при введении фонового электролита, так как его концентрация на несколько порядков выше концентрации определяемого иона. Именно ионы фона в силу их неизмеримо большего количества создают двойной электрический слой у поверхности электрода. В результате определяемые ионы движутся к электроду только за счет диффузии. Обычно скорость электрохимической реакции выше скорости диффузии. Вокруг ртутной капли создается обедненный деполяризатором слой. Поэтому все ионы деполяризатора, достигшие поверхности электрода, немедленно восстанавливаются, и ток достигает предельно-
го значения (точка С).
3. При дальнейшем увеличении напряжения (участок CD) величина тока остается неизменной. Эта область называется областью предельного тока. Поскольку предельный ток определяется только диффузией определяемого иона из объема раствора в обедненный приэлектродный слой, ток называется
233
диффузионным током Id. Предельный диффузионный ток определяется скоростью диффузии определяемого иона к поверхности электрода. Скорость пропорциональна градиенту концентрации иона, то есть разнице между концентрацией иона в толще раствора с (ее можно считать постоянной) и концентрацией в приэлектродном пространстве с0 , равной нулю (все ионы, подходящие к электроду мгновенно разряжаются). Поэтому предельный диффузионный ток Id пропорционален концентрации определяемого иона c:
Id = k · c = 706 n D 1/.2 m 2 /3 t 1/6 c , |
(5) |
|
где k - постоянная величина, |
зависящая от числа электронов n, участвующих |
|
в реакции, коэффициента диффузии D (см2 с-1) , скорости истечения капли |
||
ртути из капилляра m (мг с-1), |
времени жизни ртутной капли |
t (с), концентра- |
ции c (ммоль/л). Величина тока I измеряется в мкА.
Следовательно, величина диффузионного тока, определяемая как высота полярографической волны h, пропорциональна концентрации иона, восстанавливающегося на электроде.
h = Id = k · c .
Это хорошо видно на рис. 14, где представлены полярограммы растворов с концентрацией анализируемого вещества, возрастающей от с1 до с3 , и соответствующим ростом высоты волны от h1 до h3 . При этом потенциал полуволны сохраняет постоянное значение, поскольку он является качественной характеристикой определяемого иона.
234

I, мкА
c3
c2
c1
h1 h2 h3
E1/2 |
E, мВ |
Рис.14. Полярограммы растворов анализируемого вещества различной концентрации
Если ставится задача определения нескольких ионов из одного раствора, то ее можно решить , если потенциалы полуволн Е1/2 отличаются не менее , чем на 0.2...0,3 В, как, например, в случае совместного присутствия в анализируемом растворе ионов меди, свинца и цинка (рис. 15). В этом случае полярографические волны каждого из определяемых элементов появляются последовательно друг за другом и высота волны каждого не зависит от присутствия других элементов.
Итак, основой для идентификации анализируемых ионов в полярографии является величина потенциала полуволны Е1 2 , а количественный полярографический анализ основан на измерении величины диффузионного тока Id, то есть высоты полярографической волны h .
На практике при серийных анализах количественный расчет по полному уравнению (5) не производится вследствие сложного и не всегда возможного определения величин, входящих в уравнение. При количественных определениях пользуются методом калибровочного графика и методом добавок.
235

Метод калибровочного графика основан на построении графика в координатах высота полярографической волны h - концентрация определяемого иона с. Для этого приготавливается серия эталонных (стандартных) растворов с известной концентрацией определяемого элемента сэт (с1, с2, с3, ...), снимаются полярограммы этих растворов, определяются высоты полярографических волн hэт (h1, h2, h3 ..... ) (рис.7). На основании этих данных строится калибровочный график в координатах hэт - сэт . Анализируемый раствор полярографируется в тех же условиях, на полярограмме определяется высота полярографической волны hх и по графику определяется соответствующая ей величина сх ..
Рис. 15. Полярограмма последовательного разделения меди, свинца и цинка на ртутно-капельном электроде
Метод добавок используется при определении очень малых концентраций или в тех случаях, когда состав фона анализируемого раствора точно не известен или трудно воспроизводим. В этом случае сначала снимается полярограмма исследуемого раствора, по ней определяется высота волны анализируемого компонента hх . Затем к исследуемому раствору добавляется строго определен-
236

ный объем концентрированного раствора анализируемого компонента Vs с известной концентрацией сs, раствор снова полярографируется и измеряется высота полярографической волны анализируемого раствора с добавкой hх+s. Измеренная высота полярографической волны раствора с добавкой hх+s обусловлена суммарным содержанием анализируемого элемента в исследуемом растворе вместе с добавкой. Следовательно, для первой полярограммы
hх = kcх ,
а для второй полярограммы
hх+s = k(cх+сs).
Поскольку значение величины k постоянно , то hх /сх = hх+s /(cх+сs).
Из этого уравнения можно рассчитать величину cх.
cx hx hs xcs hx
Пример 1 (Полярография. Метод калибровочного графика).
При полярографировании растворов одинаковых навесок стандартных образцов стали, содержащей никель, были получены следующие данные по высотам полярографических волн (табл. 12).
Таблица 12
Результаты полярографирования стандартных образцов стали
№ образца |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
э(Ni), % |
0,10 |
0,20 |
0,30 |
0,40 |
0,55 |
hэ, мм |
6 |
12 |
18 |
25 |
35 |
Для определения содержания никеля в неизвестном образце была взята
237
навеска стали той же массы, растворена в тех же условиях. Полярограмма полученного раствора снята в тех же условиях. Высота полярографической волны для исследуемого раствора hx оказалась равной 26 мм. Определить массовую долю никеля (Ni), (% масс.).
Решение
Решение задачи включает следующие этапы:
–Построение калибровочного графика.
–Определение по графику содержания никеля в исследуемом образце стали по результатам измерения высоты полярографической волны.
Следуя указанному порядку, приводим решение задачи
1.Построение калибровочного графика. По данным условиям строим калибро-
вочный график в координатах высота полярографической волны hs – концентрация стандартных растворов s (Ni), % (рис.16).
238
h, мм |
|
|
|
|
|
40 |
|
|
|
|
|
30 |
|
|
|
|
|
hx |
|
|
|
|
|
20 |
|
|
|
|
|
10 |
|
|
|
|
|
0,10 |
0,20 |
0,30 |
0,40 |
0,50 |
0,60 |
|
|
|
ωx |
|
ω (Ni), % |
Рис. 16. Калибровочный график для определения никеля |
|
||||
2. Определение по графику содержания никеля в исследуемом образце стали по результатам измерения высоты полярографической волны.
В соответствии с условием измеренная величина высоты полярографической волны hx =26 мм. По графику эта величина соответствует массовой доле никеля в анализируемом образце стали, равной (Ni) = 0,41 %.
Пример 2 (Полярография. Метод добавок).
Для полярографического определения содержания марганца в стали методом добавок навеску образца массой 1,250 г растворили и после соответствующей обработки довели объем до 100 мл. Для снятия полярограммы взяли 10 мл этого раствора, довели фоновым раствором до 50 мл; измеренная высота полярографической волны равна 20 мм. После добавления в анализируемый рас-
239
твор 2 мл стандартного раствора сульфата марганца с концентрацией c (1/2 MnSO4) = 0,02500 моль/л высота волны увеличилась до 32 мм. Определить массовую долю марганца в анализируемом образце стали.
Решение
Решение задачи включает следующие этапы:
–пересчет молярной концентрации эквивалента стандартного раствора сульфата марганца на более удобный для данных расчетов способ выражения концентрации через титр рабочего раствора по определяемому веществу - марганцу;
–составление выражений для h х и h х+э по данным условия;
–составление уравнения для расчета массовой концентрации марганца сх (Mn) в исследуемом растворе;
–вычисление массы марганца в анализируемой навеске образца m (Mn);
–вычисление массовой доли марганца в анализируемой стали.
Следуя указанному порядку, приводим решение задачи.
1. Пересчет молярной концентрации эквивалента стандартного раствора сульфата марганца на титр рабочего раствора по определяемому веществу – марганцу.
Титр рабочего раствора по определяемому веществу - это масса определяемого вещества, эквивалентная в данной реакции 1 мл рабочего раствора. Поэтому
Т(MnSO4/Mn) = [c(1/2 MnSO4)·M(1/2Mn)]/1000 = [0,025·(1/2 55)]/1000 = 0,0006875 г/мл.
2. Составление выражений для h х и h х+э по данным условия. В соответст-
вии с данными условия можно записать для первой полярограммы
hх = 20 = kcх ,
а для второй полярограммы -
240
hх+s = 32 = k(cх+сs). |
|
|||||
Поскольку значение величины k |
постоянно, то |
|
||||
hх /сх = hх+s /(cх+ сs). |
|
|||||
3. Составление уравнения для |
расчета |
массовой |
концентрации марганца |
|||
сх (Mn) в исследуемом растворе. |
Оно должно быть основано на уравнении: |
|||||
с |
|
|
hxcs |
. |
(6). |
|
х = |
h |
|
h |
|||
|
|
x s |
|
x |
|
|
Для этого следует рассчитать концентрацию сs в полярографируемом растворе с учетом разбавления эталонного раствора до 50 мл :
cs |
T (KMnO4 /Mn) |
Vs = |
0,0006875 2 |
= 0,0000275г/мл. |
50 |
50 |
Подставляем все известные числовые данные в уравнение (6)
сx |
|
hxcs |
|
22 0,0000275 |
0,0000605 6,05 10 5 |
г/мл. |
|
h |
|
32 22 |
|||||
|
|
h |
x |
|
|
||
|
x s |
|
|
|
|
||
4. Вычисление массы марганца в анализируемой навеске образца m (Mn).
Учитывая объем аликвотной части 10 мл, объем полярографируемого раствора с фоном 50 мл и суммарный объем приготовленного раствора 100 мл, получаем возможность рассчитать массу марганца m (Mn):
m (Mn) = 6,05 10 5 50 100 3,02 10 2 г . 10
5. Вычисление массовой доли марганца (Mn),% в анализируемой стали.
Расчет массовой доли производим с учетом исходной навески образца mстали:
(Mn,%) =[ m (Mn)/ mстали] 100 = [3,02 10-2 / 1,250] 100=2,42 % .
Схема решения задачи №5 (Электрохимические методы анализа. Вариант - Полярография)
241
М е т о д к а л и б р о в о ч н о г о г р а ф и к а. Записать название темы контрольной задачи.
2.Полностью переписать условие своего варианта задачи, выделив следующие пункты:
–определяемый элемент;
–метод определения;
–данные для построения калибровочного графика: содержание анализируемого элемента в стандартных образцах и соответствующие им измеренные значения высоты полярографической волны;
–значение высоты полярографической волны для исследуемого раствора hx ;
–условия приготовления анализируемого раствора, в частности массу навески образца и общий объем анализируемого раствора.
3.Решить задачу в соответствии с рекомендуемой схемой:
–построить калибровочный график на миллиметровой бумаге, правильно подобрав масштаб с учетом точности измеренных величин;
–найти по калибровочному графику значение содержания определяемого элемента в исследуемом образце соответствующее измеренному значению величины высоты полярографической волны hх;
–рассчитать содержание определяемого компонента (массовую долю) в анализируемом образце с учетом разбавления анализируемого раствора.
Ме т о д д о б а в о к
1.Записать название темы контрольной задачи.
2.Полностью переписать условие своего варианта задачи, выделив следующие пункты:
–определяемый элемент;
–метод определения.
3.Решить задачу в соответствии с рекомендуемой схемой:
242
– составить выражения для h х и для h х+э в соответствии с данными условия;
–вычислить значение концентрации определяемого элемента в исследуемом образце сх , соответствующее измеренному значению величины высоты полярографической волны h х.
–рассчитать содержание определяемого компонента (массовую долю) в анализируемом образце с учетом разбавления анализируемого раствора.
Косвенная вольтамперометрия: амперометрическое титрование
Амперометрический метод анализа (или амперометрическое титрование) основан на классической полярографии и использует линейную зависимость между величиной предельного тока и концентрацией вещества, восстанавливающегося или окисляющегося на электроде. Само определяемое вещество не обязательно должно быть электроактивным. Им может быть и титрант, и продукт реакции.
Поэтому проведению титрования предшествует вольтамперометрическое исследование, в ходе которого устанавливают условия определения. Прежде всего подбирается электрод, на котором может быть электроактивным хотя бы один из участников реакции: определяемое вещество, титрант или продукт реакции. В качестве индикаторного электрода в амперометрическом титровании чаще всего используются вращающиеся платиновый или графитовый электроды. Ртутный капельный электрод используется редко. Далее определяется потенциал электрода, при котором обеспечивается линейная зависимость между током электроактивного вещества и его концентрацией. Кривая титрования строится в координатах I(сила тока) - V(объем титранта) на основании измерения силы тока после прибавления нескольких порций титранта до и после достижения точки конца титрования. Кривая титрования имеет различный вид в зависимости от того, какой из компонентов реакции является электроактивным
( рис. 17).
243
а) |
б) |
в) |
Рис. 17. Возможные формы кривых амперометрического титрования
Если на электроде окисляется или восстанавливается определяемое вещество, концентрация которого при взаимодействии с титрантом уменьшается, то на кривой титрования наблюдается спад вплоть до точки эквивалентности (рис.17,а). После этого ток остается постоянным. Если электроактивным веществом является титрант, то ток сначала сохраняется постоянным, практически близким к нулю, пока в растворе присутствует определяемое вещество, так как все добавляемое количество титранта расходуется на реакцию с определяемым веществом. Как только все количество определяемого вещества израсходовано, ток начинает расти за счет накопления избытка титранта (рис.17,б). В случае электроактивного продукта реакции ток начинает расти сразу же после прибавления первой порции титранта и увеличивается до тех пор, пока не израсходуется все количество определяемого вещества. При дальнейшем прибавлении титранта значение величины тока сохраняется постоянным, поскольку не меняется количество продукта реакции (рис. 17, в).
Таким образом при любом варианте титрования точка конца титрования, соответствующая объему титранта А, эквивалентного количеству определяемого вещества В, определяется как точка пресечения двух прямых, из которой опускают перпендикуляр на ось абсцисс и по ней отмечают значение эквивалентного объема титранта VA. Следовательно, расчет содержания анализируемого вещества m(B) в исследуемом растворе производится как при любом титриметрическом определении с использованием титра по определяемому
244

веществу TA/B и значения величины объема рабочего раствора VА, полученного в ходе титрования, по формуле:
m (B) = ТА / В · VA.
При проведении амперометрического титрования могут быть использованы все типы аналитических реакций.
Пример. При амперометрическом определении содержания цинка в литейной бронзе навеску сплава массой 1,020 г растворили и перевели раствор в мерную колбу на 100 мл. 10 мл приготовленного раствора цинка амперометрически оттитровали свежеприготовленным раствором K4[Fe(CN)6] c титром по цинку равным 0,002445 г/мл. При титровании получены следующие данные
(табл. 13):
Таблица 13
Результаты амперометрического титрования цинка раствором ферроцианида калия
Объем титранта V, мл |
0,2 |
0,4 |
0,6 |
0.8 |
1,0 |
1,5 |
2,0 |
2,5 |
Ток I, мк А |
70 |
70 |
77 |
100 |
120 |
172 |
228 |
282 |
Построить график по результатам титрования и вычислить массовую долю цинка в анализируемом образце сплава.
Решение
Решение задачи включает следующие этапы:
1.Запись уравнения реакции, протекающей в процессе титрования.
2.Построение кривой титрования в координатах I - V.
3.Определение конечной точки титрования Vэкв ( K4[Fe(CN)6] ).
4.Расчет содержания цинка в титруемом растворе.
5.Расчет массовой доли цинка в анализируемом образце сплава.
245
Следуя указанному порядку, приводим решение задачи. 1. Уравнение реакции, протекающей в процессе титрования:
3 Zn2 + + 2 K+ + 2 [Fe(CN)6]4- = K2Zn3[Fe(CN)6]3 .
Определяемый элемент - цинк Zn2 +. Титрант – ферроцианид калия K4[Fe(CN)6].
2. Построение кривой титрования в координатах I – V.
Данные таблицы используем для построения графика: аргументом функции является объем рабочего раствора V. Значения его величины наносим на ось абсцисс. По оси ординат откладываем значения соответствующих величин силы тока I. Масштаб графика должен отвечать точности измерений. Проводим две прямые до пересечения друг с другом и определяем эквивалентный объем
( рис. 18).
3. Определение конечной точки титрования VA ( K4[Fe(CN)6] ).
Точка пересечения прямых на графике является точкой эквивалентности и соответствует значению Vэкв = 0,6 мл.
246
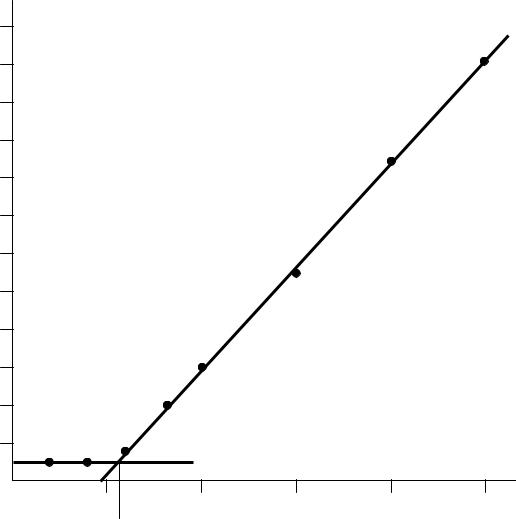
I, мкА |
|
|
|
|
|
|
300 |
|
|
|
|
|
|
280 |
|
|
|
|
|
|
260 |
|
|
|
|
|
|
240 |
|
|
|
|
|
|
220 |
|
|
|
|
|
|
200 |
|
|
|
|
|
|
180 |
|
|
|
|
|
|
160 |
|
|
|
|
|
|
140 |
|
|
|
|
|
|
120 |
|
|
|
|
|
|
100 |
|
|
|
|
|
|
80 |
|
|
|
|
|
|
60 |
|
|
|
|
|
V, мл |
|
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
|
|
|
Vэкв |
|
|
|
|
Рис. 18. |
Кривая амперометрического титрования при определении цинка |
|||||
4. Расчет содержания цинка в титруемом растворе.
Для определения содержания цинка в титруемом растворе используем формулу:
m (B) = TA B · VA .
По условию титр ферроцианида по цинку равен 0,002445 г/мл, эквивалентный объем составляет 0,6 мл . Поэтому содержание цинка в титруемом растворе равно
m (Zn) = 0,002445 · 0,6 = 0,001467 г .
5. Расчет массовой доли цинка в анализируемом образце сплава.
247
Вычисленное значение величины массы цинка соответствует его содержанию в 10 мл анализируемого раствора, а вся навеска растворена в 100 мл. Масса навески анализируемой бронзы составляет 1,020 г. Следовательно, массовую долю цинка в бронзе ω (Zn) вычисляем по формуле:
ω (Zn) = |
0,001467 100 |
100 |
1,44 % . |
|
10 |
1,020 |
|
|
|
|
|
|
||
Схема решения задачи №5 ( Вариант - Амперометрическое титрование):
1.Записать название темы контрольной задачи.
2.Полностью переписать условие задачи.
3.Решить задачу в соответствии с рекомендуемой схемой для амперометрического титрования:
–записать уравнение реакции, протекающей в процессе титрования;
–построить на миллиметровой бумаге кривую титрования в координатах I - V , подобрав масштаб в соответствии с диапазоном данных условия;
–определить конечную точку титрования Vэкв;
–рассчитать содержание анализируемого элемента в титруемом растворе;
–рассчитать массовую долю элемента в анализируемом образце.
Кулометрический метод анализа. Электрогравиметрия
Кулонометрия основана на использовании законов Фарадея для определения количества вещества, которое прореагировало или образовалось при протекании электродной реакции:
1. Количество вещества, электропревращенного в процессе электролиза (восстановленного или окисленного), прямо пропорционально количеству электричества, протекшего через электролит.
248
2. При протекании одинакового количества электричества через разные электролиты выделяются или растворяются количества веществ, прямо пропорциональные их электрохимическим эквивалентам.
Электрохимический эквивалент - это масса вещества, выделившегося на электроде или растворившегося с него при протекании через электролит единицы количества электричества, то есть 1 Кл.
Для выделения в процессе электролиза 1 моль эквивалентов любого вещества требуется количество электричества, равное 1 фарадею, который состав-
ляет 96458 Кл. |
|
Масса электрохимически окисленного или восстановленного |
вещества |
может быть вычислена по формуле: |
|
т = М Q / n F , |
(7) |
где т – масса вещества, г, выделившегося в ходе электролиза; M – молярная или атомная масса, г · моль-1; Q – измеренное количество электричества, Кл, равное произведению силы тока на время Q = I · t (1 Кл = 1 А·с); n – число электронов; F – число Фарадея, электрохимический эквивалент моля, равное
96485 Кл·моль-1.
Кулонометрический анализ возможен при следующих условиях:
–в результате электрохимического окисления или восстановления должен образовываться продукт известной степени окисления;
–взаимодействие электронов с ионами или молекулами определяемого вещества должно протекать стехиометрично, со 100 %-ным выходом по току (без побочных реакций);
–определение должно удовлетворять требуемой аналитической точности.
Кулонометрические определения проводятся в виде прямой кулономет-
рии и в виде кулонометрического титрования.
Прямая кулонометрия основана на непосредственном электропревращении определяемого вещества на электроде. Поэтому метод можно исполь-
зовать для определения только электроактивных веществ. Прямая кулонометрия проводится либо при постоянной силе тока (гальваностатически), либо при
249
постоянном потенциале (потенциостатически). Метод имеет высокую точность, однако и в гальваностатическом, и в потенциостатическом варианте проведения анализа трудно исключить протекание побочных реакций.
Если определяемое вещество не является электроактивным, то его можно определить с помощью кулонометрического титрования. В этом варианте проведения анализа определяемое вещество количественно реагирует с электрогенерируемым титрантом. Вспомогательное вещество для генерации титранта берется в избытке, что обеспечивает 100%-ную эффективность тока. На протяжении всего процесса остаются постоянными концентрация титранта и потенциал окислительно-восстановительной пары, что исключает побочные реакции. Для установления конечной точки титрования можно использовать как визуальные индикаторы, так и различные физико-химические методы (например, потенциометрию, амперометрию). В ходе кулонометрического титрования определяется сила тока для генерирования титранта и время, необходимое для достижения точки конца титрования.
Кулонометрически можно проводить кислотно-основное титрование (генерированием ионов ОН- из воды при восстановлении ее на катоде или ионов Н+ при анодном окислении воды), окислительно-восстановительное, осадительное и комплексонометрическое титрование.
Пример. С целью определения содержания примеси железа в алюминии использовали кулонометрическое титрование ионов железа (III) электровосстанавливаемыми ионами олова (II). Для этого растворили навеску алюминия массой 1,0000 г. В ходе растворения железо окислилось до Fe3+. Титрование проводили при постоянной силе тока 5,0 мА в течение 95 с. Определить массовую долю (%) железа в алюминии.
Решение
Задача включает следующие этапы:
1.Запись уравнения реакции, протекающей в процессе титрования ионов железа (III) электровосстанавливаемыми ионами олова (II).
2.Расчет массы железа, вступившего в реакцию с оловом.
3.Расчет массовой доли железа в анализируемом образце алюминия.
250

Следуя данному порядку, приводим решение задачи.
1. Запись уравнения реакции, протекающей в процессе титрования. Опре-
деляемыми ионами являются ионы железа (III), которые титруются электровосстанавливаемыми ионами олова (II):
2 Fe3 e Fe2
Sn2 2e Sn4
2Fe3+ +Sn2+ =2Fe2+ +Sn4+
2. Расчет массы железа, вступившего в реакцию с оловом. Расчет произ-
водится на основе уравнения (1), описывающего закон Фарадея ; сила тока выражается в А, время электролиза - в с , число электронов, участвующих в реакции восстановления железа, в соответствии с уравнением полуреакции равно единице. Поэтому масса железа т (Fe) равна:
т (Fe) = МQ / nF = (55,85·5·10-3 · 95) / (1 ·96485) = 0,000275 г.
3. Расчет массовой доли железа ω (Fe) в анализируемом образце алюми-
ния. Учитывая массу образца алюминия m (Al) и найденную массу железа
т(Fe), вычисляем его массовую долю в анализируемом образце ω (Fe)
ω(Fe) = [т (Fe) / m (Al)] · 100% = [0,000275 / 1,0000] · 100 = 0,0275%.
Схема решения задачи №5 (Вариант - Кулонометрия и кулонометрическое титрование).
1.Записать название темы контрольной задачи.
2.Полностью переписать условие задачи.
3.Решить задачу в соответствии с рекомендуемой схемой:
–записать уравнения реакции, протекающей в процессе кулонометрического титрования;
–рассчитать массу определяемого вещества;
–рассчитать массовую долю определяемого вещества в анализируемом образце.
Теоретические задания
Теоретические задания 1, 2 и 3 выполняются каждым студентом не зависимо от номера его шифра в соответствии с содержанием каждого задания. В каждом задании необходимо привести принципиальную схему соответствующего анализатора и кратко описать его возможности.
251
4.3. Текущий контроль Тренировочные тесты
Тест №1 (к Введению)
1.Вид анализа, который позволяет получить информацию по содержанию хрома, вольфрама, ванадия, марганца, углерода в анализируемом образце стали, называется
a.функциональный
b.элементный
c.фазовый
d.молекулярный
e.локальный
2.Вид анализа, который позволяет получить информацию по содержанию хрома, вольфрама, ванадия, марганца, углерода в карбиде хрома при анализе стали, называется
a.функциональный
b.элементный
c.фазовый
d.молекулярный
e.локальный
3.Определение содержания углерода по ходу плавки производится мето-
дами
a.арбитражного анализа
b.экспресс-анализа
c.маркировочного анализа
d.непрерывного анализа
e.дистанционного анализа
4.Аналитический контроль производства (технический анализ) включает
a.локальный анализ поверхности
b.экспресс – анализ по ходу плавки
c.маркировочный анализ
d.контрольный анализ
e.непрерывный анализ
5.Если для проведения анализа израсходовано от 1 до 10 мл раствора, то используемый вид анализа называется
a.макроанализом
b.микроанализом
c.полумикроанализом
d.ультрамикроанализом
e.техническим анализом
252
Тест №2 ( к Разделу 1)
1. При анализе смеси катионов в качестве группового реагента для отделения катионов Ca(II), Sr(II), Ba(II), Pb(II) может быть использован
a. H2SO4 b. HCl
c.HNO3
d.H2S
e.KOH
2.Фактор эквивалентности
a.показывает число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной кислотноосновной реакции или одному электрону в данной окислительновосстановительной реакции
b.это то же, что и эквивалент
c.равен молярной массе вещества
d.равен эквивалентной массе вещества
e.равен числу электронов в данной окислительновосстановительной реакции
3.Запись с (1/5 KMnO4) = 1 моль/л характеризует раствор, содержащий в
1л раствора
a.1 моль молекул перманганата калия (при проведении реакции его восстановления в кислой среде)
b.1 моль молекул перманганата калия (при проведении реакции его восстановления в щелочной среде)
c.1 моль эквивалентов перманганата калия (при проведении реакции его восстановления в кислой среде)
d.1 моль молекул перманганата калия (при проведении реакции его восстановления в любой среде)
e.1/5 моль молекул перманганата калия (при проведении реакции его восстановления в любой среде)
253
4.Титр раствора по определяемому веществу показывает массу
a.определяемоговещества, содержащуюсяв1 млстандартногораствора.
b.определяемоговещества, эквивалентную1 млстандартногораствора.
c.определяемоговещества, вступающуювреакцию с1 млстандартного раствора.
d.стандартноговещества, содержащуюсяв1 млраствора
e.определяемоговещества, котораясодержитсяв1 легораствора
5.На титрование навески в 0,1133 г химически чистого Na2С2O4 в кислой среде пошло 20,75 мл раствора KMnO4. Определить формулу для расчета молярной концентрации эквивалента рабочего раствора.
a. c(1/5 KMnO4 ) |
|
|
m(Na2C2O4 ) |
|
1000 |
|||||
|
M (1/5 KMnO4 ) |
V (KMnO4 ) |
||||||||
|
|
|
|
|
|
|
||||
b. c(1/2KMnO4 )= |
|
|
|
|
m(Na2C2O4 ) |
1000 |
||||
|
M (1/2Na2C2O4 ) V (KMnO4 ) |
|||||||||
|
|
|
|
|
|
|||||
c. c(1/5KMnO4 ) = |
|
m(Na |
2C2O4 ) |
|
|
|
|
|
||
|
|
V (KMnO4 ) |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
d. c(1/5KMnO4 ) = |
|
|
|
m(Na2C2O4 ) |
|
|
1000 |
|||
|
M (1/2Na2C2O4 ) |
V (KMnO4 ) |
|
|||||||
|
|
|
|
|
|
|||||
e. c(1/5 KMnO4 ) |
|
|
m(1/ 2 Na |
2C2O4 ) |
|
|
|
1000 |
||
|
M (1/ 2 Na2C2O4 ) V (KMnO4 ) |
|||||||||
|
|
|
|
|
||||||
254

Тест №3 (к Разделу 2)
1. Если аналитический сигнал исследуемой пробы Sx , а сигнал пробы с добавкой Sx ýò , то для расчета концентрации анализируемого раствора cx методом добавок необходимо использовать формулу
a. ñx Scýò SxS
x ýò x
b.cx (cýò Sx ) / Sx ýò
c.ñx (Sx ýò Sx ) c Sx ýò
d. cx Sx cýò Sýò
e. ñx cýò SSx ýò x
2.Правильными формулами, связывающими пропускание Т, оптическую плотность (абсорбцию) А с величинами концентрации с, молярного коэффициента поглощения и толщины поглощающего слоя l, являются:
a.A lc
b.lgT lc
c.lg A lc
d.A lgT lc
e.A lgT
3.В качестве источников излучения в атомно-абсорбционной спектроскопии используются:
a.лампы с полым катодом
b.пламя ацетилен-воздух
c.пламя ацетилен-закись азота
d.графитовый электротермический атомизатор типа кюветы Львова
e.электрическая дуга
255

4.Законы электролиза, установленные Фарадеем, выражаются формулой:
a. m |
I t M |
|
; |
|
n 96485 |
||||
|
|
|||
b. m |
I M n |
; |
||
t 96485 |
||||
|
|
|
||
c.m I t ;
M 96485
d.m 96485 M ;
I t n
e.m I t 96485 ,
M
где m - масса вещества, электропревращенного в процессе электролиза; I-- сила тока, А; t- время электролиза, с; M - молярная масса вещества, г; n- число электронов, участвующих в реакции электропревращения.
5.Качественным хроматографическим параметром является
a.сумма площадей всех хроматографических пиков
b.высота хроматографического пика
c.время удерживания
d.площадь хроматографического пика
e.геометрическая форма пика
256
Тест №4 (к Разделу 3)
1.Количественную информацию о валовом элементном составе сплавов можно получить методом
a.атомно-эмиссионного спектрального анализа
b.атомно-эмиссионного спектрального анализа в вакуумной области спектра
c.методом Оже-электронной спектроскопии
d.электронно-зондового рентгеноспектрального микроанализа
e.хромато-масс-спектрометрическим методом.
2.Для анализа поверхности и поверхностных слоев твердого тела можно использовать методы
a.атомно-эмиссионного спектрального анализа с источником индук- тивно-связанной плазмы
b.газовой хроматографии
c.атомно-эмиссионного спектрального анализа в вакуумной области спектра
d.рентгеновской фотоэлектронной спектроскопии
e.масс-спектрометрии вторичных ионов
3.Для идентификации и определения структуры полимерных материалов используются методы
a.ИКспектроскопии
b.кулонометрии
c.хромато-масс-спектрометрии
d.атомно-абсорбционного анализа
e.окислительно-восстановительного титрования
4.Для определения содержания макрокомпонентов можно использовать методы
a. гравиметрии
b. атомно-эмиссионного спектрального анализа c. титриметрии
d. молекулярно-абсорбционной спектроскопии в видимой и ультрафиоле-
товой области спектра
e. рентгенофлуоресцентного анализа
5. Предварительное концентрирование микрокомпонентов для получения информации элементного характера необходимо при использовании методов
a.атомно-эмиссионного спектрального анализа
b.искровой масс-спектрометрии
c.молекулярно-абсорбционной спектроскопии
d.вольтамперометрии
e.масс-спектрометрия вторичных ионов
257
4.4 Итоговый контроль Примеры вопросов для подготовки к зачету
1.Способы приготовления и стандартизации рабочих растворов, общие положения и их использование в различных методах титриметрии.
2.Основные виды титрования: прямое, обратное, заместительное, - и алгоритмы расчетов при использовании этих методов.
3.Использование методов титриметрии в аналитическом контроле машиностроительной отрасли и металлургии.
4.Гравиметрический анализ, основные операции при проведении анализа, использование метода для текущего контроля, арбитражного, маркировочного анализа в аналитической службе контроля производства.
5.Метод молекулярно-абсорбционной спектроскопии в видимой, ультрафиолетовой и инфракрасной областях спектра и его использование в аналитическом контроле машиностроительной отрасли.
6.Метод атомно-абсорбционной спектроскопии, его преимущества и недостатки по сравнению с методом молекулярно-абсорбционной спектроскопии.
7.Атомно-эмиссионный спектральный анализ и возможности его использования при визуальной, фотографической и фотоэлектрической регистрациях спектра.
8.Методы количественного эмиссионного анализа при фотографической регистрации спектра.
9.Атомно-эмиссионный спектральный анализ с источником индуктивносвязанной плазмы, его возможности при элементном анализе материалов в мащиностроении.
10.Инверсионная вольтамперометрия и ее использование для анализа микрокомпонентов.
11.Методы хромато-масс-спектрометрии в аналитической службе машиностроительной отрасли.
12.Кулонометрические анализаторы на углерод и серу.
258
ПРАВИЛЬНЫЕ ОТВЕТЫ НА ТРЕНИРОВОЧНЫЕ ТЕСТЫ
№ |
Раздел |
Номера вопросов |
1 |
2 |
3 |
4 |
5 |
теста |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
Введение |
правильный ответ |
b |
c |
b |
b, c, d |
c |
|
|
|
|
|
|
|
|
2 |
Раздел 1 |
правильный ответ |
a |
a |
c |
b |
d |
|
|
|
|
|
|
|
|
3 |
Раздел 2 |
правильный ответ |
c |
a, d |
a |
a |
c |
|
|
|
|
|
|
|
|
4 |
Раздел 3 |
правильный ответ |
a |
d, e |
a, c |
a, c, e |
a, c, d |
|
|
|
|
|
|
|
|
259
