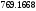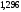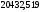отчет по хим.3 (восстановлен)
.docxМинистерство образования и науки РФ
Национальный минерально-сырьевой университет «Горный»
Отчет
по лабораторной работе
Исследование кинетики химических реакций и химического равновесия.
Выполнил: студент группы ГНГ-12 Сляднева Д.А.
Проверил: Луцкий Д.С.
Цель работы: изучить зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие.
Общие сведения.
Средняя скорость реакции равна изменению молярной концентрации реагента в единицу времени при постоянстве объема системы.
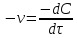 ,
где минус означает убыль качества
исходных веществ.
,
где минус означает убыль качества
исходных веществ.
 ,
где [A] и [B]
– молярные концентрации реагентов; k
– коэффициент пропорциональности,
называемый константой скорости
реакции.
,
где [A] и [B]
– молярные концентрации реагентов; k
– коэффициент пропорциональности,
называемый константой скорости
реакции.
Зависимость скорости реакции от концентрации реагирующих веществ определяется кинетическим уравнением. Эту зависимость устанавливают при постоянной температуре, изменяя концентрацию одного из реагирующих веществ. Зависимость скорости реакции от температуры описывается эмпирическим правилом Вант-Гоффа(1) и уравнением Аррениуса(2).
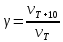 (1)
(1)
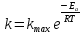 (2)
(2)
Большинство химических реакций являются обратимыми. Все обратимые процессы протекают не полностью, а лишь до состояния равновесия, которое характеризуется константой химического равновесия.
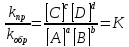 – закон действующих масс, где К –
константа химического равновесия,
которая зависит от температуры и природы
реагентов, но не зависит от концентрации
последних.
– закон действующих масс, где К –
константа химического равновесия,
которая зависит от температуры и природы
реагентов, но не зависит от концентрации
последних.
Изменение внешних условий вызывает смещение равновесия. Если изменения вызвали рост концентрации продуктов реакции, то равновесие сместиться в сторону прямой реакции. Напротив, уменьшение выхода продукта означает смещение равновесия в сторону обратной реакции. Основой утверждений служит принцип Ла-Шателье: «Равновесие смещается в сторону реакции, ослабляющей оказываемое на систему внешнее воздействие».
Содержание протокола
Опыт 1.Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.
|
№ пробирки |
С(Na2S2O3), отн.ед. |
Время реакции τ, с |
|
1 |
1(4) |
31 |
|
2 |
2(8/4) |
28 |
|
3 |
3(12/4) |
21 |
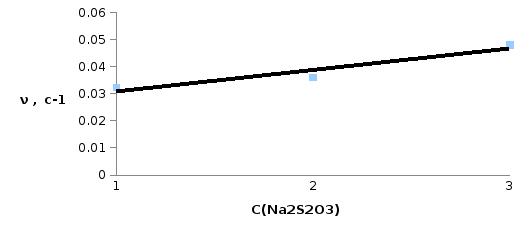
|
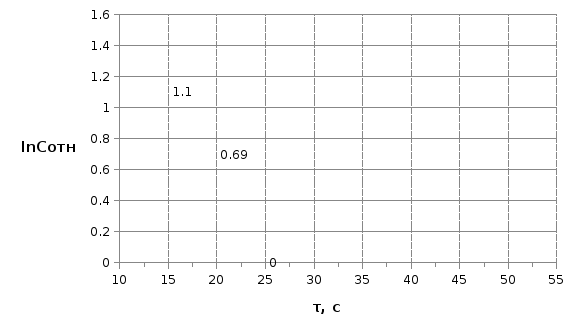
Номер пробирки |
С(Na2S2O3), отн.ед. |
InCотн=In(Сi/С1) |
Время реакции τ, с |
Скорость реакции ν =1/ τ, с-1 |
|
1 |
1(4) |
0 |
31 |
0,0323 |
|
2 |
2(8/4) |
0,693 |
28 |
0,036 |
|
3 |
3(12/4) |
1,1 |
21 |
0,048 |
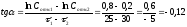
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, (1)
H2S2O3 = S↓+H2O+SO2↑. (2)
Опыт 2.
Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
|
№ п/п |
Температура Т, К |
Время реакции τ, с |
Скорость реакции ν =1/ τ, с-1 |
γ |
Еа, кДж/моль |
|
1 |
290 |
42 |
0,0323 |
1,104 |
|
|
2 |
301 |
31 |
0,036 |
||
|
|
|
||||
|
3 |
312 |
17
|
0,048 |
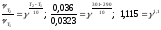
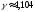
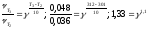
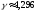

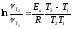
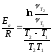 ;
;
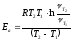
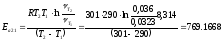
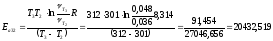
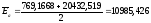
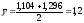
Опыт 5.
|
Номер пробирки |
Состав системы |
Добавленный реактив |
Наблюдения |
|
1 |
7капель 0,0025 н. FeCl3 2 капли 0,0025 н. NH4CNS |
Нет |
|
|
2 |
FeCl3 |
раствор стал ярче |
|
|
3 |
NH4CNS |
раствор стал ярче |
|
|
4 |
NH4Cl |
раствор посветлел |
FeCl3+3NH4CNS = Fe(CNS)3 + 3NH4Cl
Fe3+ 3Cl-+3NH4+ +3CNS- = Fe(CNS)3 + 3NH4+ +3Cl-
Fe3+ +3CNS- = Fe(CNS)3
При добавлении к реакционной системе хлорида железа и роданида аммония равновесие смещается в сторону продуктов реакции.
Вывод: изучили зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомились с влиянием концентрации реагентов на химическое равновесие.
Санкт-Петербург
2012