
Исследование реакций в растворах электролитов
.doc

ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«НАЦИОНАЛЬНЫЙ МИНЕРАЛЬНО-СЫРЬЕВОЙ УНИВЕРСИТЕТ «ГОРНЫЙ»
Лабораторная работа № 2
По дисциплине: _____Химия ______________________________
(наименование учебной дисциплины согласно учебному плану)
Тема: «Исследование реакций в растворах электролитов»_ __
Выполнила: студентка гр. РСК-12 ______________ /Карнаухова Виктория Владимировна/
(подпись) (Ф.И.О.)
Дата: 05.10.2012
Проверила: ______________ /Лобачёва Ольга Леонидовна /
(подпись) (Ф.И.О.)
Санкт-Петербург
2012 год.
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения.
Общие сведения.
Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Количественно способность электролита распадаться на ионы характеризуют степенью диссоциации
£ = n/n0
По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Мильные электролиты в растворе диссоциируют практически полностью, слабые – частично.
Особенности реакций обмена: реагируют только те ионы, которые в итоге образуют: молекулы слабых электронов; осадки малорастворимых веществ или газы.
Порядок выполнения работы
Опыт 1. Образование малорастворимых оснований.
1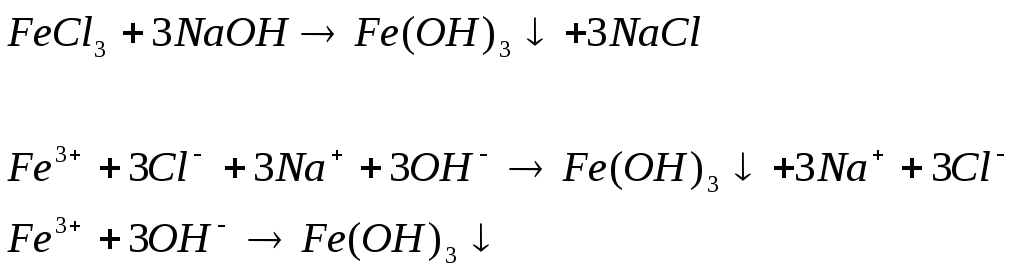 .
.
Наблюдаем осадок оранжевого цвета
2 .
.
Наблюдаем осадок синего цвета
3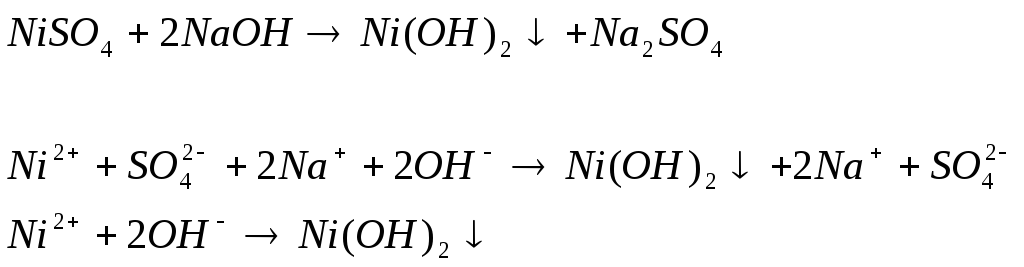 .
.
Наблюдаем осадок бледно-зелёного цвета
Вывод: реакции получились, т.к. образовались малорастворимые основания и слабые электролиты.
Опыт 2.Растворение малорастворимых оснований.
1.
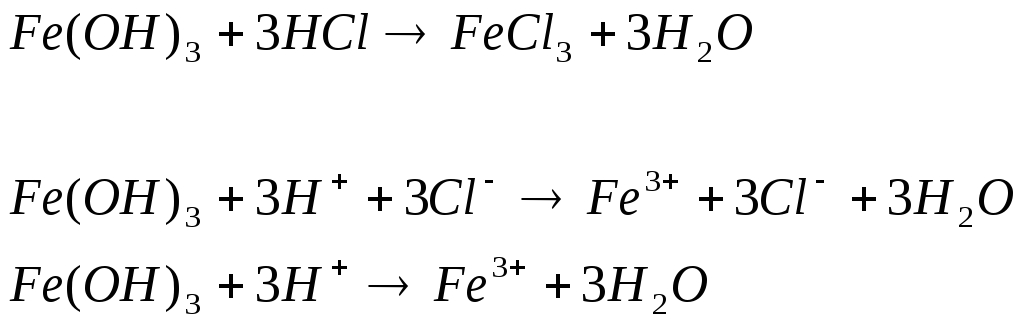
Наблюдаем растворение осадка и образование исходного вещества и воды
2 .
.
Наблюдаем растворение осадка и образование воды
3 .
.
Наблюдаем растворение осадка и образование воды
Вывод: растворились в кислоте потому, что образовался ещё более слабый электролит-вода
Опыт 3. Образование малорастворимых солей.
А)
-
 (реакция
«Золотого дождя»)
(реакция
«Золотого дождя»)
Выпадает осадок жёлтого цвета
![]()
![]()
2.Рb(NO3)2
+BaCl2
![]() PbCl2
+
Ba(NO3)2
PbCl2
+
Ba(NO3)2![]()
Выпадает осадок белого белого цвета
Pb2+
+ 2NO3-
+
Ba2+
+ 2Cl-
![]() Pb2+
+ 2Cl -
+Ba(NO3)2
Pb2+
+ 2Cl -
+Ba(NO3)2![]()
Ba2+
+ 2NO3-![]() Ba(NO3)2
Ba(NO3)2![]()
Вывод: реакции идут, т.к. образуются малорастворимые в воде вещества.
Опыт 4.Изучение свойств амфотерных гидроксидов.
А)
1.
![]()
Наблюдаем выпадение осадка белого цвета
![]()
![]()
2.
![]()
Наблюдаем растворение осадка и получение исходного вещества
![]()
![]()
3.
Zn(OH)2
+ 2NaOH(в
изб.)
![]() Na2
Na2![]() Zn(OH)4
Zn(OH)4![]()
При
избытке NaOH осадок
растворяется![]()
Вывод: Гидроксид в кислой среде реагирует как основание, а в щелочной как кислота.
Опыт 5. Образование малодиссоциированных соединений.
![]()
Появляется резкий специфический запах
Получается
нашатырный спирт (![]() )
)
![]()
![]()
![]()
Вывод: реакция идёт, т.к. образуется вода и выделяется газ- аммиак в результате разложения гидроксида аммония.
Опыт 6. Образование комплексов.
1.![]()
Образование осадка голубого цвета
![]()
![]()
2.![]() ( NH4)2
( NH4)2![]() Cu(OH)4
Cu(OH)4![]()
Образование раствора голубого цвета
Опыт 7. Образование газов.
1.
![]()
Наблюдается выделение газа (СО2-угарный газ), цвет раствора не изменяется.
![]()
![]()
2.
Na2S
+ H2SO4
![]() Na2SO4
+H2S
Na2SO4
+H2S![]()
Выделяется запах тухлых яиц
2Na+
+ S2-
+ 2H+
+SO42-
![]() 2Na++SO42-
+
H2S
2Na++SO42-
+
H2S![]()
![]()
2H++
S2-
![]() H2S
H2S![]()
Вывод: Соединения неустойчивы, т.к. образуются слабые электролиты.
Вывод: Во время проведения лабораторной работы изучили образование и растворение осадков, образование малорастворимых солей, газов, комплексов, изучили свойства амфотерных гидроксидов. Таким образом мы ознакомились с практическими выводами теории электролитической диссоциации.
