
- •1. Расчет ионной силы раствора Краткие теоретические сведения
- •Примеры решения задач Пример 1.
- •Задачи для решения
- •2. Кислотно-основные свойства растворов электролитов
- •2.1. Равновесия в растворах сильных кислот и оснований
- •2.1.1. Расчет рН в растворах сильных кислот и оснований
- •Пример 4.
- •Задачи для решения
- •2.2. Равновесия в растворах слабых кислот и оснований
- •2.2.1. Расчет рН в растворах слабых кислот и оснований
- •Пример 11.
- •Задачи для решения
- •2.3.1. Расчет рН в растворе гидролизующейся соли
- •Пример 14.
- •2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся соли
- •Пример 16.
- •2.4. Равновесия в буферных растворах
- •Пример 17.
- •Задачи для решения
- •3. Равновесия в насыщенных растворах
- •3.1. Общие сведения
- •3.2. Растворимость в бинарной системе соль - вода
- •Пример 22.
- •3.3. Растворимость в многокомпонентной системе с индифферентным электролитом
- •Пример 23
- •Пример 24.
- •3.4. Растворимость в многокомпонентной системе с одноименными ионами
- •Пример 25.
- •Задачи для решения
2.3.1. Расчет рН в растворе гидролизующейся соли
рН в растворе гидролизующейся соли определяется природой слабого электролита. При гидролизе соли, образованной сильным основанием и слабой кислотой, гидролизуется анион слабой кислоты. В растворе появляются ионы ОН, поэтому среда щелочная, рН > 7.
![]() ,
(2.17)
,
(2.17)
Если соль, образована слабым основанием и сильной кислотой, то гидролизуется катион слабого основания:
![]() ,
(2.18)
,
(2.18)
в растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
Гидролиз является обратимым процессом и имеет ступенчатый характер. Термодинамической характеристикой гидролиза является его константа равновесия – константа гидролиза.
Константу гидролиза проще всего вычислить через значение константы диссоциации слабого электролита по уравнению:
![]() ,
(2.19)
,
(2.19)
Первой константе гидролиза соответствует последняя константа диссоциации, последней константе гидролиза – первая константа диссоциации, в чем нетрудно убедиться, сравнивая состав (по кислотным остаткам) реакций диссоциации и гидролиза для фосфорной кислоты:
|
гидролиз |
диссоциация | ||
|
1 |
|
3 |
|
|
2 |
|
2 |
|
|
3 |
|
1 |
|
Обычно константа гидролиза по второй ступени во много раз меньше, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН обычно учитывают только первую ступень гидролиза, пренебрегая последующими его ступенями. Ионная сила раствора гидролизующейся соли в этом случае может быть вычислена без учета реакции гидролиза по концентрации соли.
В случае гидролиза по аниону (2.17) константа
равновесия запишется следующим образом:
![]()
 (2.24)
(2.24)
где
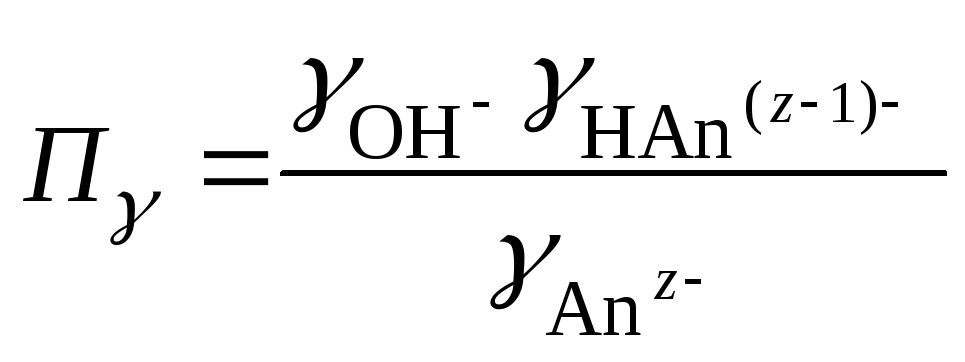 – произведение коэффициентов активности.
– произведение коэффициентов активности.
Концентрация ионов
![]() вычисляется по уравнению:
вычисляется по уравнению:
 ,
(2.25)
,
(2.25)
где Сi– моляльная концентрация гидролизующегося иона.
При гидролизе по катиону (2.18) константа
равновесия запишется следующим образом:
![]()
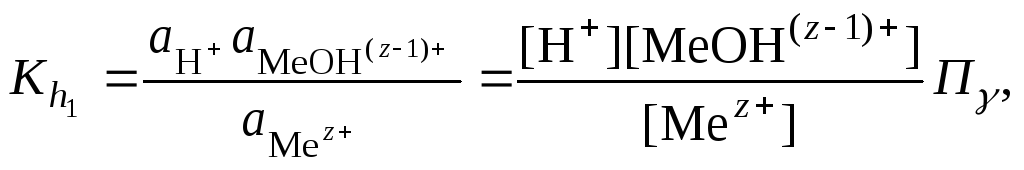 (2.26)
(2.26)
где
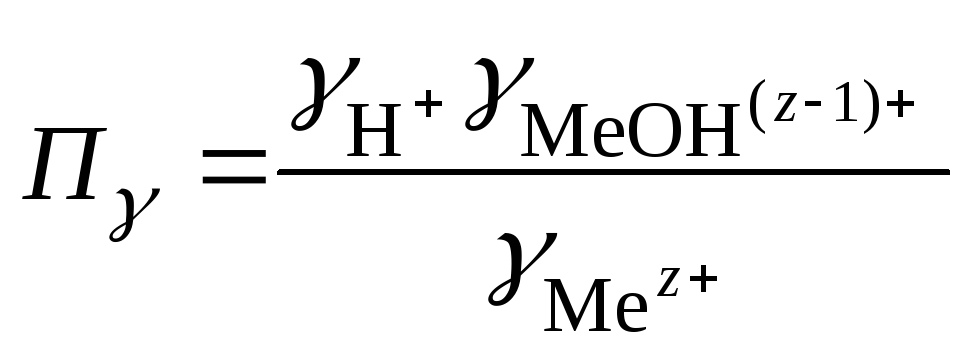 – произведение коэффициентов активности.
– произведение коэффициентов активности.
Концентрация катионов водорода вычисляется по уравнению:
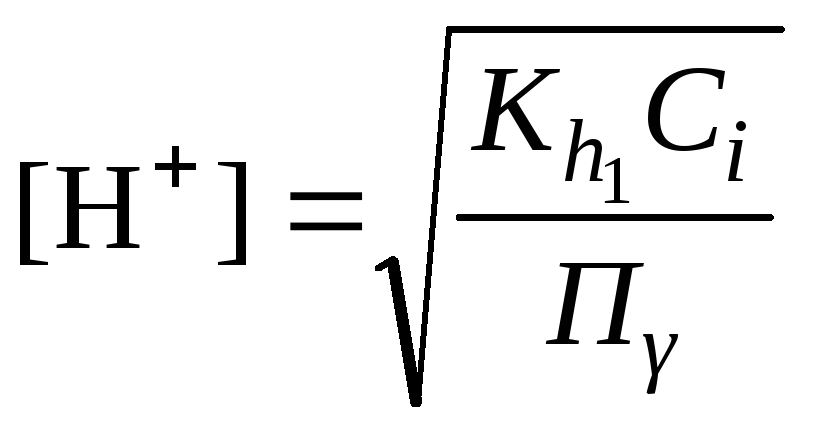 .
(2.27)
.
(2.27)
Пример 14.
Вычислить рН раствора сульфата аммония
концентрацией 3 % при 25°С;
![]() .
.
Решение. 1. Вычислить моляльную концентрацию сульфата аммония
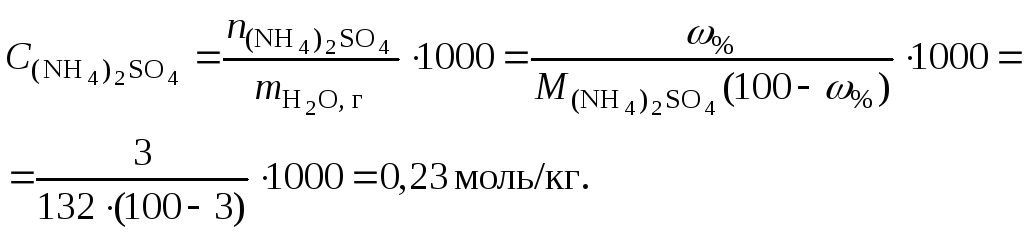
2. Вычислить ионную силу раствора, используя концентрацию соли
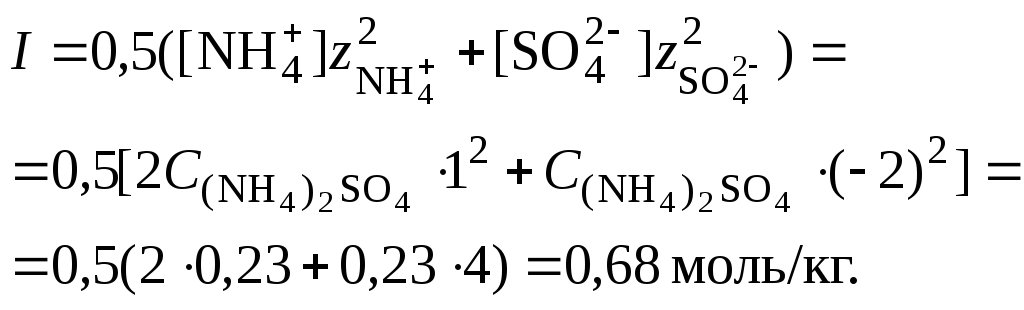
3. Составить ионное уравнение гидролиза сульфата аммония:
![]()
4. Составить уравнение константы гидролиза
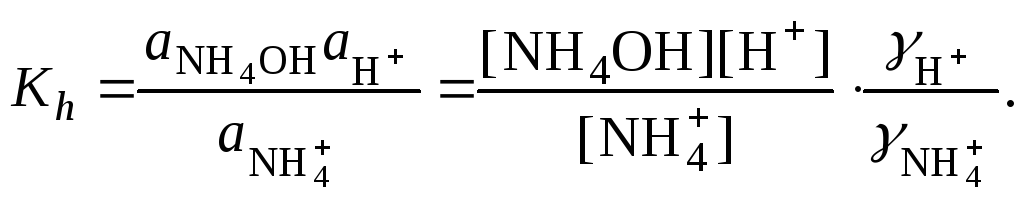
![]() и
и![]() .
.
5. Вычислить константу гидролиза
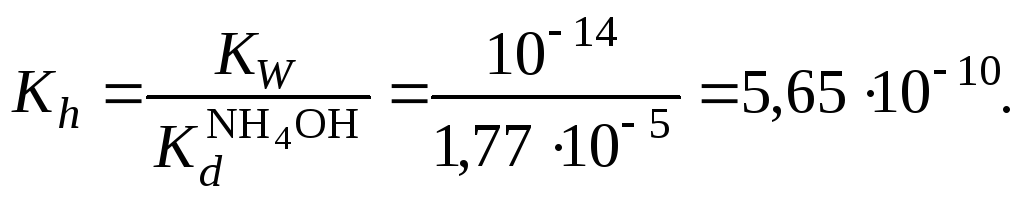
6. Вычислить концентрацию катионов водорода
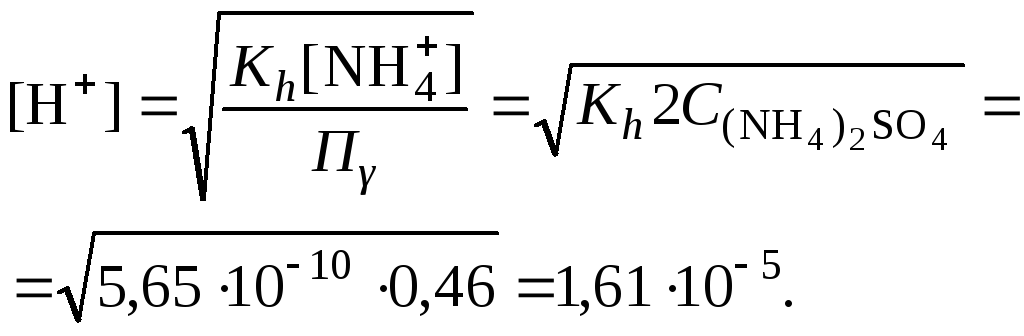
7. Рассчитать коэффициент активности катионов водорода
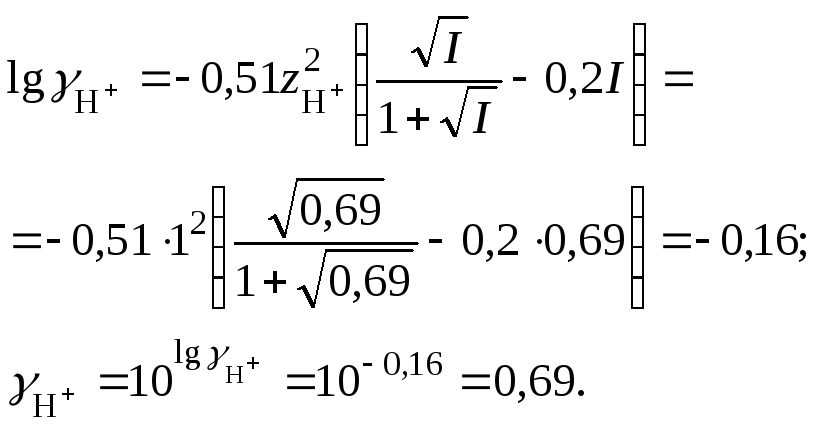
8. Вычислить рН раствора
![]()
2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся соли
Для детального исследования и математического моделирования гидролиза необходим расчет равновесного ионно-молекулярного состава раствора гидролизующейся соли. Равновесный состав рассчитывается при решении системы уравнений, состоящей из уравнений констант гидролиза по всем ступеням, уравнений баланса масс, баланса зарядов, расчета ионной силы раствора и коэффициентов активности. Для соли, гидролизующейся по аниону по двум ступеням состава Me2Anтакая система уравнений будет выглядеть следующим образом.
Уравнения гидролиза аниона соли и их константы:
![]()
![]()
![]()
![]()
уравнение баланса масс
![]()
уравнение баланса зарядов:
![]()
уравнение расчета ионной силы раствора:
![]()
уравнения расчета коэффициентов активности:
![]() ,
,
![]() ,
,
уравнение расчета произведения коэффициентов активности
![]()
