
- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
2.1. Примеры решения задач
Пример 1.Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях.
Решение.1. Порядковый номер брома – 35, следовательно атом серы имеет 35 электронов. Бром находится в четвертом периоде периодической системы, следовательно, АО сn= 1, 2 и 3 заполнены полностью. Бром относится кp-элементам, следовательно, заполнен 4s-подуровень. В ряду 4p-элементов бром – пятый элемент, следовательно, на 4p-подуровне – 5 электронов. Таким образом, электронная формула брома1s22s22p63s23p44s23d104p5.
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т. е. 4s-, 4p- и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет следующий вид:
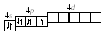
втаком состоянии бром имеет валентность 1, которой соответствуют степени окисления1, +1.
3. При затрате некоторой энергии спаренный p-электрон перейдет на свободнуюd-орбиталь – первое возбужденное состояние брома:
Br*: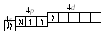
втаком состоянии бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободнуюd-орбиталь – второе возбужденное состояние брома:
Br**: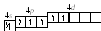
втаком состоянии бром имеет валентность 5, которой соответствует степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободнуюd-орбиталь – третье возбужденное состояние брома:
Br**: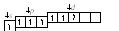
втаком состоянии бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2.Составить электронные формулы атома селена в состоянияхSe2иSe+4и графические схемы заполнения электронами валентных орбиталей.
Решение. 1. Cоставим электронную формулу атома селена (см. пример 1) 1s22s22p63s23p64s23d104p4и графическую схему заполнения электронами валентных орбиталей
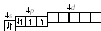
2. Для получения Se2необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского):

Электронная формула Se2: 1s22s22p63s23p64s23d104p6.
3. Для получения Se+4необходимо от атома селена убрать четыре электрона с 4p-орбитали:

Электронная формула Se+4: 1s22s22p63s23p64s23d104p0.
Пример 3.Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д. И. Менделеева принадлежит данный элемент.
Решение. Согласно правилу Клечковского 3d-элементы находятся в четвертом периоде таблицы Д.И. Менделеева. На данной орбитали находится 6 электронов, значит это шестой по счету среди 3d-элементов, т. е. железо. Полная электронная формула которого 1s22s22p63s23p64s23d6.
2.2. Задачи для решения
I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
B,Al,Th.
Po,Ba,Lu.
Mg,Pm,Be.
Br,Co,Hf.
C, Tm, As.
Nd, Ca, V.
Ta, O, Ce.
Y, Rb, S.
At, Xe, Lr.
Cs, U, H.
Cl, Cu, Bi.
Na, Ac, Fe.
Pb, Ra, Dy.
Ag, Re, In.
Cd, K, Pa.
P, Se, Li.
Yb, Mn, Sn.
Mo, La, N.
Pu, Ni, Sb.
Au, Np, Rn.
Cr, Tl, Cm.
Si, I, Zr.
Tb, Sr, Bk.
Fr, Ti, W.
He, Hg, Gd.
Pt, Ne, Sm.
Ga, Ru, Ho.
Sc, Pr, Os.
Ar, Ir, Eu.
Zn, Rh, Er.
Kr, Pd, Am.
Ge, Cf, F.
II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
Li+, C+2.
O2, F.
Na+, N3.
Ca+2, C+4.
Al+3, B3.
C4, Ba+2.
S+6, P3.
P+5, Cl1.
I+5, Fe+3.
Be+2, Co+3.
Cr+6, Cu+2-.
I, P+3.
Cr+3, Br+3.
Ag+, Sn+4.
Zn+2, S2.
K+, Fe+2.
Zr+4, Pb+2.
N+5, Br.
Ni+2, Cl+5.
Se2, Cs+.
Te2, Sr+2.
Bi+3, Si4.
B+3, Sc+2.
Mg+2, Mn+7.
Cd+2, Sn+2-.
Nb+3, Hg+.
Tl+, V+3.
Ti+4, Mn+2.
Os+3, Au+3.
Rb+, Ce+3.
Fr+1, Y+3.
H+, Re+7.
III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д. И. Менделеева принадлежит данный элемент.
4d1.
3d10.
4s13d10.
5d2.
6p2.
6s14f145d10.
4s23d5.
4s13d5.
7s26d1.
5d3.
6s24f2.
6p1.
5s14d5.
4f3.
6d15f3.
5s24d5.
5d8.
5s14d10.
5s24d10.
5s2.
5p3.
6p4.
4d6.
5d6.
5f5.
5d7.
5f2.
4d7.
5d14f7.
4f10.
4d8.
5p6.
