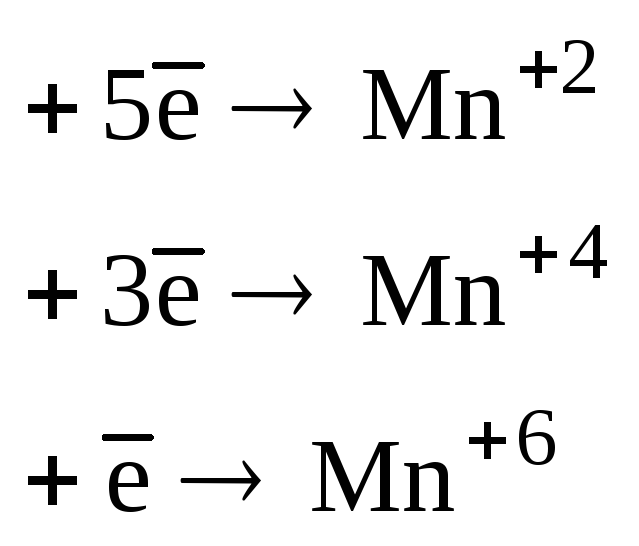- •1. Основные классы неорганических соединений. Номенклатура
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Кислоты
- •1.4. Соли
- •1.5. Задачи для решения
- •2. Строение атома
- •1S2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f (лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
- •2.1. Примеры решения задач
- •2.2. Задачи для решения
- •4. Основные понятия и законы химии
- •4.1. Моль, молярная масса
- •4.2. Основные газовые законы
- •4.3. Закон эквивалентов
- •4.4. Примеры решения задач
- •4.5. Задачи для решения
- •5. Растворы
- •5.1. Концентрации растворов
- •5.1.1. Примеры решения задач
- •5.1.2. Задачи для решения
- •Задачи на приготовление раствора
- •5.2. Коллигативные свойства растворов
- •5.2.1. Закон Рауля
- •5.2.2. Изменение температур фазовых переходов растворов
- •5.2.3. Осмотическое давление
- •5.2.4. Примеры решения задач
- •5.2.5. Задачи для решения
- •5.3. Водородный показатель
- •5.3.1. Расчет рН в растворах сильных кислот и оснований
- •5.3.2. Расчет рН в растворах слабых кислот и оснований
- •5.3.3. Примеры решения задач
- •5.3.4. Задачи для решения
- •5.4. Гидролиз
- •Соль образована одним слабым электролитом
- •5.4.1. Примеры решения задач
- •5.4.2. Задачи для решения
- •5.5. Равновесия в буферных растворах
- •5.5.1. Примеры решения задач
- •5.5.2. Задачи для решения
- •5.6. Равновесия в насыщенных растворах
- •5.6.1. Растворимость в бинарной системе соль - вода
- •5.6.2. Растворимость в многокомпонентной системе с одноименными ионами
- •5.6.3. Условия образования осадков
- •5.6.4. Примеры решения задач
- •5.6.5. Задачи для решения
- •6.Окислительно-восстановительные реакции
- •6.1. Примеры решения задач
- •6.2. Задачи для решения
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Оглавление
6.Окислительно-восстановительные реакции
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов.
Окислениемназывается процесс отдачи электронов, авосстановлениемпроцесс принятия электронов. Окисление и восстановление взаимосвязаны.
Окислителемназывается вещество, атомы которого принимают электроны, при этом он восстанавливается.Восстановителемназывается вещество, атомы которого отдают электроны, при этом он окисляется.
Все окислительно-восстановительные реакции классифицируют следующим образом:
1. Межмолекулярные реакции. Это реакции, в которых окислитель и восстановитель являются различными веществами.
![]() ,
,
где Mn+4– окислитель, Cl–1– восстановитель.
![]() .
.
2. Реакции внутримолекулярного окисления. Это реакции, которые протекают с изменением степеней окисления атомов различных элементов одного и того же вещества.
![]() ,
,
где Mn+7– окислитель, а O-2– восстановитель.
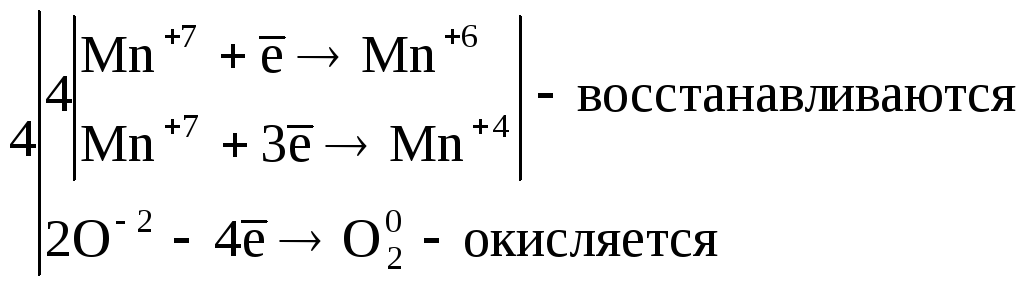
3. Реакции диспропорционирования. В этих реакциях и окислителем и восстановителем является элемент находящийся в промежуточной степени окисления в составе одного и того же вещества.
![]() ,
,
где Cl20– окислитель и восстановитель.
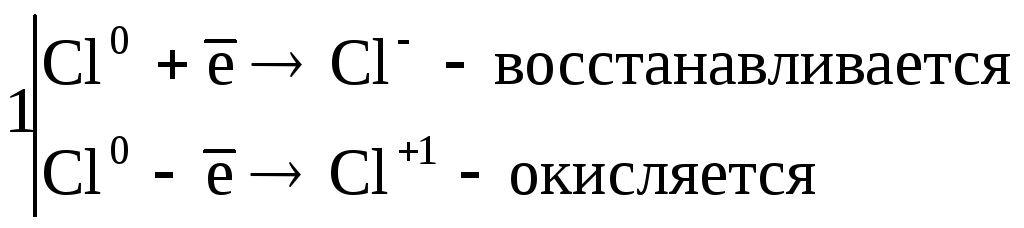
О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления элементов, выполняющих эти функции.
Элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Некоторые окислители и восстановители приведены ниже.
|
Окислители |
Схемы реакций |
|
KMnO4 |
|
|
|
|
|
H2O2 |
|
|
Восстановители |
Схемы реакций |
|
H2S и ее соли, Na2S2O3 |
|
|
НГ и их соли |
|
|
Cr+3 |
|
|
HNO2 и ее соли. |
|
|
H2SO3 и ее соли. |
|
|
H2O2 |
|
6.1. Примеры решения задач
Пример 1. составить электронную схему и закончить уравнение реакции:FeSO4+K2Cr2O7 +H2SO4→ …
Решение. Степени окисления изменяются у железаFe+2и хромаCr+6. Составим уравнение баланса электронов, причем расчет ведем на два атома хрома (по числу атомов в молекулеK2Cr2O7):
 6
Fe+2
– ē → Fe+3
6
Fe+2
– ē → Fe+3
 1
2Cr+6
+ 6ē→ 2Cr+3
1
2Cr+6
+ 6ē→ 2Cr+3
6 Fe2++ 2 Cr+6→ 2 Cr+3+ 6 Fe+3
Расставим полученные коэффициенты в левую и правую части исходного уравнения. Учитывая, что реакция протекает при избытке серной кислоты, конечным продуктом реакции будут сульфаты всех металлов. Водород образует воду. Недостаток сульфат-ионов слева компенсируют семью молями серной кислоты. В последнюю очередь уравнивают реакцию по водороду (7 Н2О). Проверку следует вести по кислороду (по 59 атомов слева и справа).
Окончательно
6 FeSO4 + K2Cr2O7 + 7 H2SO4 →
→ 3 Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 + 7 H2O
Пример 2. Закончить и уравнять реакцию:
С6Н12О6+ КМnО4+ Н2SО4→ СО2+ …
Решение. Необходимо составить схему процесса. В кислой среде перманганат- ион восстанавливается до иона марганца со степенью окисления +2. Для уравнивания числа атомов кислорода добавляют воду или ионы Н+в кислой среде или ОНв щелочной:
МnО4+ 8 Н+ + 5 e→ Мn2++ 4 Н2О
Восстановитель С6Н12О6окисляется до СО2, согласно полуреакции:
С6Н12О6+ 6 Н2О24 e→ 6 СО2+ 24 Н+
Приводим число электронов к наименьшему общему кратному, в примере к 120. Для этого уравнения полуреакций домножают на соответствующие коэффициенты, в примере на 24 и 5. Суммируют уравнения полуреакций, сокращая одинаковые члены в левой и правой частях. В результате получают ионное уравнение реакции:
5 С6Н12О6+ 24 МnО4 + 72 Н+→ 30 СО2+ 24 Мn2++ 66 Н2О
Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
5 С6Н12О6+24 КМnО4+36 Н2SO4= 30 СО2+24 МnSO4+66 Н2О+12 К2SО4