
- •18. Ароматические углеводороды (арены). Строение бензола. Номенклатура. Способы получения. Химические свойства: реакции замещения, окисления, присоединения.
- •19. Механизм электрофильного замещения в ароматическом ядре. Реакции электрофильного замещения: сульфирование, нитрование, алкилрование, ацилирование, галогенирование.
- •21. Нитроалканы и нитроарены. Строение нитрогруппы. Получение. Химические свойства. Применение.
- •22. Амины и ароматические и алифатические. Влияние строения аминов на их основность. Получение. Получение анилина. Химические свойства аминов. Отдельные представители и их применение.
- •23. Карбоновые кислоты. Номенклатура. Строение. Способы получения карбоновых кислот. Химические свойства. Механизм этерификации. Отдельные представители и их применение.
- •24. Двухосновные карбоновые кислоты. Способы получения. Химические свойства. Отдельные представители и их применение.
- •25. Ароматические одно – и двухосновные кислоты (бензойная и фталевые кислоты). Способы получения. Химические свойства. Отдельные представители и их применение.
- •26. Непредельные кислоты. Номенклатура, изомерия, строение и способы получения, химические свойства. Применение. Отдельные представители. Акриловые и метакриловые кислоты.
- •27. Фуран. Получение, строение, химические свойства. Применение.
- •Строение
- •Получение фурана
- •Химические свойства
- •Применение
- •Применение
- •29. Пиррол. Получение, строение, химические свойства. Применение.
- •Строение
- •Получение
- •Химические свойства
- •Применение
- •30. Шестичленные гетероциклы с одним гетероатомом. Пиридин. Получение, строение и химические свойства. Применение. Строение
- •Получение
- •Химические свойства
- •Применение пиридина
- •31. Соединения со смешанными функциями. Оксокислоты. Номенклатура, изомерия, строение, способы получения, химические свойства. Применение. Отдельные представители.
- •32. Соединения со смешанными функциями. Гидроксикислоты. Номенклатура, изомерия (структурная и оптическая), строение и способы получения, химические свойства. Применение. Отдельные представители.
- •33. Производные карбоновых кислот. Сложные эфиры и амиды. Номенклатура, изомерия, строение и способы получения, химические свойства. Применение. Отдельные представители.
- •34. Производные карбоновых кислот. Ангидриды и галогенангидриды. Номенклатура, изомерия, строение и способы получения, химические свойства. Применение. Отдельные представители.
18. Ароматические углеводороды (арены). Строение бензола. Номенклатура. Способы получения. Химические свойства: реакции замещения, окисления, присоединения.
Ароматические соединения (арены) — циклические органические соединения, которые имеют в своём составе ароматическую систему связей. Они могут иметь насыщенные или ненасыщенные боковые цепи.
Первый представитель ароматических углеводородов – бензол – имеет состав C6H6. Это вещество было открыто М.Фарадеем в 1825 г.Состав C6H6 по соотношению атомов углерода и водорода отвечает формуле CnH2n-6.
Строение:

Каждый атом углерода находится в sp2-гибридизации. Валентный угол равен 120º LС-Н = 1,09 Å, LС-С = 1,39 Å. Негибридизованные р-орбитали располагаются перпендикулярно плоскости кольца и при боковом перекрывании образуют единую π- молекулярную орбиталь над и под плоскостью цикла. Такое строение обеспечивает чрезвычайную устойчивость бензола.
Номенклатура:
Название аром. углеводородам дается как производное от бензола.
![]()
метилбензол (толуол)
Если есть 2 заместителя, то их можно назвать как орто-, мета- и пара-производные.

мета-хлорбромбензол
Если в кольце присутствует 3 и более заместителей, то их положение обозначается только цифрами. Во всех случаях названия заместителей перечисляются в алфавитном порядке.
Получение:

Химические свойства:
Бензол не дает характерных для непредельных соединений реакций; он, например, не обеспечивает бромной воды и раствора KMnO4, т.е. в обычных условиях не склонен к реакциям присоединения, не окисляется.
Бензол в присутствии катализаторов вступает в характерные для предельных углеводородов реакции замещения, например, с галогенами:
C6H6+ Cl2→ C6H5Cl + HCl
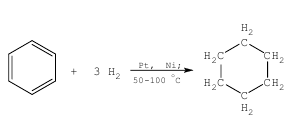
В определенных условиях бензол может вступать и в реакции присоединения. Там, в присутствии катализаторов он гидрируется, присоединяя 6 атомов водорода:
C6H6+ 3H2→ C6H12
Под действием света бензол медленно присоединяет 6 атомов галогена:
C6H6+ 3Cl2→ C6H6Cl6
Нитрование:

Сульфирование:

Алкилирование по Фриделю-Крафтсу:

Окисление:


Озонолиз:



19. Механизм электрофильного замещения в ароматическом ядре. Реакции электрофильного замещения: сульфирование, нитрование, алкилрование, ацилирование, галогенирование.
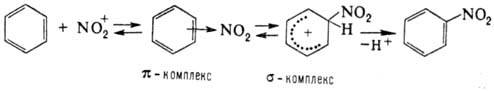
Механизм реакции SEAr или реакции ароматического электрофильного замещения состоит из трех стадий.
На первом этапе происходит присоединение электрофильной частицы к бензольному кольцу и образуется π-комплекс:

На втором — π-комплекс переходит в δ-комплекс:
![]()
На третьем — δ-комплекс под действием нуклеофильного агента распадается:

Нитрование:
Сульфирование:

Алкилирование:
Галогенирование:

20. Электронодонорные и электроноакцепторные заместители. Правило ориентации в бензольном ядре при электрофильном замещении. Согласованная и несогласованное влияние заместителей. Отдельные представители и их применение.
|
Орто- и Пара-ориентанты (ориентанты I рода) |
Мета-ориентанты (ориентанты II рода) |
|
-OH, -OR |
-NO2, -CN |
|
Alk: -CH3, -C2H5 и т.д. |
-COOH, -COH |
|
AR: -C6H5 и т.д. |
-COOR, -COR |
|
-NH2, -NHR, -NR2, -CONHR |
-SO3H, -SO3R |
|
Hal: -F, -Br, -Cl, -I |
|
Существенной особенностью реакций для получения и превращений производных ароматических углеводородов является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направление реакций замещения в бензольном ядре, называют правилами ориентации.
Реакционная способность того или иного атома углерода в бензольном кольце определяется следующими факторами: 1) положением и природой уже имеющихся заместителей; 2) природой действующего агента; 3) условиями проведения реакции. Решающее влияние имеют два первых фактора.
Заместители в бензольном кольце можно разделить на две группы.
Электронодонорные заместители (первого рода) – это группировки атомов, способные отдавать электроны. К ним относятся OH, OR, RCOO, SH, SR, NH2, NHR, NHCOR, -N=N-, CH3, CH2R, CR3, F, Cl, Br, I.
Электроноакцпторные заместители (второго рода) – это атомные группировки, способные оттягивать, принимать электроны от бензольного ядра. К ним относятся SO3H, NO2, CHO, COR, COOH, COOR, CN, CCl3 и т. д.
Действующие на ароматические соединения полярные реагенты можно разделить на две группы: электрофильные и нуклеофильные. Наиболее характерны для ароматических соединений процессы алкилирования, галогенирования, сульфирования и нитрования. Эти процессы идут при взаимодействии ароматических соединений с электрофильными реагентами.
Заместители первого рода (кроме галогенов) облегчают реакции с электрофиьными реагентами, причем они ориентируют новый заместитель в орто- и пара-положения.
Заместители второго рода затрудняют реакции с электрофильными реагентами: они ориентируют новый заместитель в мета-положение. В то же время эти заместители облегчают реакции в нуклеофильными реагентами.
Если в бензольном кольце есть заместители, то электронная плотность перераспределяется и становится неравномерной. Донорные заместители повышают электронную плотность кольца в орто- и пара-положениях. Акцепторные заместители понижают электронную плотность в этих положениях из-за значительного отрицательного мезомерного и индуктивного эффектов.
При наличии в кольце 2-х заместителей они могут направлять следующие заместители либо в одно и то же положение, либо в разные. Если оба ориентанта одного рода, то положение следующего заместителя определяет более сильный. В случае, если ориентанты не отличаются по силе, то образуется смесь продуктов.
Среди ориентантов I рода самыми сильными являются аминопроизводные, затем ароматические, самые слабые галогенпроизводные.
Среди ориентантов II рода самый сильный –NO2, затем -HSO3, далее -COOH.

