
- •Дисциплина: Органическая химия
- •1. Предельные углеводороды (алканы). Номенклатура. Изомерия. Основные способы получения. Химические свойства: реакции радикального замещения (Sr) и расщепления. Применение.
- •5. Реакции полимеризации диенов. Натуральный и синтетический каучуки. Строение, получение и применение их в промышленности.
- •6. Сопряженные диены. Химические свойства: реакции присоединения, окисления, димеризации, диеновый синтез. Полимеризация.
- •Электрофильное присоединение галогеноводородов
- •Присоединение галогенов
- •8. Номенклатура, изомерия, строение, способы получения и химические свойства предельных галогенпроизводных. Отдельные представители.
- •1. Гидролиз гпу:
- •9. Реакции нуклеофильного замещения предельных галогенпроизводных. Механизмы sn1 и sn2, закономерности их протекания. Химические свойства
- •Механизм sn2
- •Механизм sn1
- •10. Реакции элиминирования предельных галогенпроизводных. Механизмы е1 и е2. Химические свойства полигалогенпроизводных. Применеие галогенпроизводных. Отдельные представители.
- •11. Непредельные и ароматические галогенпроизводные. Способы получения, строение и химические свойства. Ариновые механизмы замещения в ароматическом ряду.
- •1. Галогенирование
- •1. Прямое галогенирование
- •2. Хлорметилирование
- •12. Одноатомные спирты. Номенклатура. Строение. Способы получения. Химические свойства. Отдельные представители и их применение. Общая характеристика. Номенклатура
- •Получение. Свойства
- •13. Двух- и трехатомные спирты. Способы получения. Химические свойства. Отдельные представители и их применение.
- •14. Одноатомные и двухатомные фенолы. Номенклатура. Способы получения. Химические свойства. Отдельные представители и их применение. Строение. Номенклатура
- •16. Альдегиды и кетоны. Химические свойства: реакция конденсации, реакции с азотсодержащими соединениями. Отдельные представители и их применение.
- •Отдельные представители альдегидов и кетонов
- •17. Дикарбонильные соединения. Получение, химические свойства, применение. Отдельные представители.
1. Гидролиз гпу:

2. Взаимодействие с алкоголятами

3. Взаимодействие с солями синильной кислоты:

1- изонитрил( вторичные, третичные ГПУ), 2-нитрил( первичные ГПУ).
4. С нитритом серебра.

1 – алкилнитрит, первичные ГПУ, 2 – нитроалкан , третичные ГПУ
5. Взаимодействие с серебряными солями карбоновых кислот.

6. Взаимодействие с NH3 и аминами( р-ция Гофмана)


7. Взаимодействие с металлами:

8. Восстановление ГПУ:
Если восстановитель водород, реакция идет при повышенном давлении

9. Реакции элиминирования:

Отдельные представители:
В технике из галогеналкилов наибольшее применение имеют хлористый метил и хлористый этил. Их получают хлорированием соответствующих предельных углеводородов. Хлористый этил получают также присоединением сухого хлористого водорода к этилену в присутствии хлорида железа FeCl}.
В химической промышленности хлористый метил и хлористый этил применяются как алкилирующие средства. Хлористый этил применяется в больших количествах для получения антидетонатора тетраэтилсвинца (ТЭС), а также в медицине для кратковременного наркоза и для местной анестезии (обезболивания), в частности, в зубоврачебной практике.
9. Реакции нуклеофильного замещения предельных галогенпроизводных. Механизмы sn1 и sn2, закономерности их протекания. Химические свойства
Химические свойства алкилгалогенидов обусловлены разрывом связей С - Галоген.
Наиболее легко реакции замещения протекают для иодпроизводных. Механизм процесса - нуклеофильное замещение (SN).

По современным представлениям реакции нуклеофильного замещения могут протекать по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2.
Механизм sn2
Этот механизм характерен для первичных алкилгалогенидов.

Реакция замещения происходит в результате постепенного вытеснения старой группы новой группой. Образование новой и разрыв старой связи происходит одновременно.

В переходном состоянии центральный атом гибридизован, как в алкенах, все его связи находятся в одной плоскости, а входящая и уходящая группы находятся за и перед плоскостью молекулы. Нуклеофильная атака осуществляется с тыла.

Механизм sn1
Мономолекулярный механизм характерен для первичных алкилгалогенидов и галогенидов аллильного и бензильного типа.

При мономолекулярном механизме сначала происходит ионизация связи углерод - галоген, а затем нуклеофил быстро взаимодействует с карбкатионом.

Первая стадия определяет скорость процесса в целом, на этой стадии происходит медленная диссоциация бромистого трет.бутила, поэтому скорость реакции не зависит от концентрации нуклеофила.

Соединения с вторичными радикалами могут реагировать по двум механизмам.
10. Реакции элиминирования предельных галогенпроизводных. Механизмы е1 и е2. Химические свойства полигалогенпроизводных. Применеие галогенпроизводных. Отдельные представители.
Реакция элиминирования (отщепление)
Элиминирование может классифицироваться как α-, β- и γ - элиминирование.

Наиболее часто встречающимся типом реакций отщепления является β-элиминирование. α-Элиминирование может протекать по механизму Е2 и Е1.
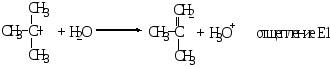
 Реакции
Е2
Реакции
Е2
Реакции Е2 протекают при действии на галогеналканы сильных оснований (спиртовой раствор КОН):
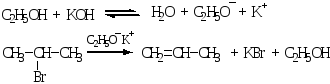
Реакции Е2 часто конкурируют с SN2.
Кинетика реакций отщепления Е2 описывается уравнением второго порядка: v = k [(CH3)2CHBr][C2H5O-]
Энергетическая диаграмма реакции Е2
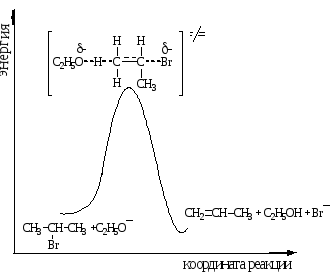
Реакция Е2 представляет собой одностадийный согласованный процесс β-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Н и образование π-связи происходят одновременно.
Реакция Е2 подчиняется правилу Зайцева: протон отщепляется преимущественно от наименее гидрогенизированного Сβ-атома:
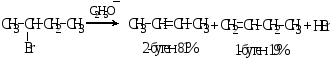
Реакции Е1
Реакции Е1 часто конкурируют с SN1 и подчиняются тем же закономерностям.
Механизм элиминирования Е1 включает 2 стадии: отщепление галогена с образованием карбкатиона и отщепление протона от атома углерода (Сβ), соседнего с катионным центром (Сα):
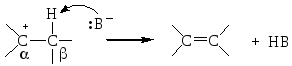
Как видно из схемы, для удаления протона необходимо основание.
Реакция Е1 также протекает по правилу Зайцева.
Химические свойства полигалогенпроизводных:
Все реакции моногалогенпроизводных:
1. Гидролиз:

Геминальные ГПУ менее реакционно способны и реагируют при более жестких условиях в присутствие серной кислоты при нагревании:

Применение:
Четыреххлористый углерод.
Применяется как негорючий растворитель, в частности при тушении пожаров, если горят жидкости с плотностью ниже 1 – легче воды.
1. Служит для получения фреона-12.
2. Применяется для проведения химических анализов в лабораториях нефтехимической отрасли (определение нефтепродуктов в оборотных и сточных водах, в качестве экстрагента).
1,2- Дихлорэтан.
1. Исходный продукт для синтеза хлористого винила в промышленности пластмасс (дешевый, но ядовитый растворитель).
2. В промышленности 1,2-дихлорэтан используется как растворитель жиров, восков, смол,парафинов и других веществ.
3. Его применяют и в химических лабораториях для экстракции многих органическихвеществ из водных растворов.
4. 1,2-Дихлорэтан используется для извлечения жира из шерсти животных, для химчистки одежды.
Гексахлорэтан.
1. Применяется как инсектицид (хранится в запаянном капилляре) – средство для борьбы с вредными насекомыми, в агрономии.
2. Применяется в ветеренирии, в качестве глистогонного средства.
3. В производстве дымовых шашек.
4. Используется в производстве хладона-113.
5. В производстве таблеток для дегазации помещений и местности.
Большое применение в технике охлаждения получили полифторхлоруглеводороды (фреоны). Фреона – очень устойчивые соединения, они не гидролизуются и поэтому не корродируют металл; используются как хладогенты, как растворители инсектофунгецидов для образования аэрозолей и как промежуточные продукты в синтезе фторпроизводных.
Важное применение получил фторотан СF3 – CHClBr – бесцветная тяжелая жидкость с запахом, напоминающим хлороформ. Это одно из самых эффективных средств для общего наркоза. Имеет ряд преимуществ перед хлороформом: мало токсичен, почти не дает стадии возбуждения, наркоз быстро проходит.
