- •Дисциплина: Органическая химия
- •1. Предельные углеводороды (алканы). Номенклатура. Изомерия. Основные способы получения. Химические свойства: реакции радикального замещения (Sr) и расщепления. Применение.
- •5. Реакции полимеризации диенов. Натуральный и синтетический каучуки. Строение, получение и применение их в промышленности.
- •6. Сопряженные диены. Химические свойства: реакции присоединения, окисления, димеризации, диеновый синтез. Полимеризация.
- •Электрофильное присоединение галогеноводородов
- •Присоединение галогенов
- •8. Номенклатура, изомерия, строение, способы получения и химические свойства предельных галогенпроизводных. Отдельные представители.
- •1. Гидролиз гпу:
- •9. Реакции нуклеофильного замещения предельных галогенпроизводных. Механизмы sn1 и sn2, закономерности их протекания. Химические свойства
- •Механизм sn2
- •Механизм sn1
- •10. Реакции элиминирования предельных галогенпроизводных. Механизмы е1 и е2. Химические свойства полигалогенпроизводных. Применеие галогенпроизводных. Отдельные представители.
- •11. Непредельные и ароматические галогенпроизводные. Способы получения, строение и химические свойства. Ариновые механизмы замещения в ароматическом ряду.
- •1. Галогенирование
- •1. Прямое галогенирование
- •2. Хлорметилирование
- •12. Одноатомные спирты. Номенклатура. Строение. Способы получения. Химические свойства. Отдельные представители и их применение. Общая характеристика. Номенклатура
- •Получение. Свойства
- •13. Двух- и трехатомные спирты. Способы получения. Химические свойства. Отдельные представители и их применение.
- •14. Одноатомные и двухатомные фенолы. Номенклатура. Способы получения. Химические свойства. Отдельные представители и их применение. Строение. Номенклатура
- •16. Альдегиды и кетоны. Химические свойства: реакция конденсации, реакции с азотсодержащими соединениями. Отдельные представители и их применение.
- •Отдельные представители альдегидов и кетонов
- •17. Дикарбонильные соединения. Получение, химические свойства, применение. Отдельные представители.
Отдельные представители альдегидов и кетонов
Формальдегид СН2=О (муравьиный альдегид, метаналь).
Представляет собой бесцветное горючее вещество с острым раздражающим запахом. Растворим в воде, обычно используется в виде 33-40 % водного раствора, который называют формалином. Вырабатывают формальдегид в больших количествах. Он применяется в производстве пластмасс. Полиформальдегид с большим молекулярным весом – ценный синтетический материал, используемый в качестве заменителя металлов. В кожевенной промышленности формальдегид применяется для дубления кожи, в медицине и санитарии – для дезинфекции. В с/х формальдегид используется для протравливания семян перед посевом (уничтожают паразитические споры). Так как формальдегид образуется при неполном сгорании различных органических веществ, то он содержится в дыме угля, дерева; на этом основано консервирующее действие дыма при получении мясных и рыбных копченостей.
Ацетальдегид СН3—СН=О (уксусный альдегид, этаналь).
Представляет собой бесцветную легколетучую, легковоспламеняющуюся жидкость с сильным характерным запахом прелых яблок. Хорошо растворим в воде. Используют ацетальдегид для многих промышленных синтезов. Особенно важно окисление его в уксусную кислоту, превращение в этилацетат (по реакции Тищенко); может быть восстановлен в этиловый спирт.
Ацетон СН3—СО—СН3 (диметилкетон).
Бесцветная, легковоспламеняющаяся жидкость с довольно приятным запахом. Смешивается с водой. Ацетон является ценным растворителем (в производстве лаков, искусственного шелка, взрывчатых веществ) и исходным веществом в синтезе разнообразных органических соединений.
В последнее время в технике большое значение приобрело применение ацетона для получения так называемого кетена. Кетен – газообразное вещество, очень реакционноспособное. Применяется для получения уксусного ангидрида и ряда других ценных продуктов, в частности, очень хорошего пищевого консерванта – сорбиновой кислоты.
17. Дикарбонильные соединения. Получение, химические свойства, применение. Отдельные представители.
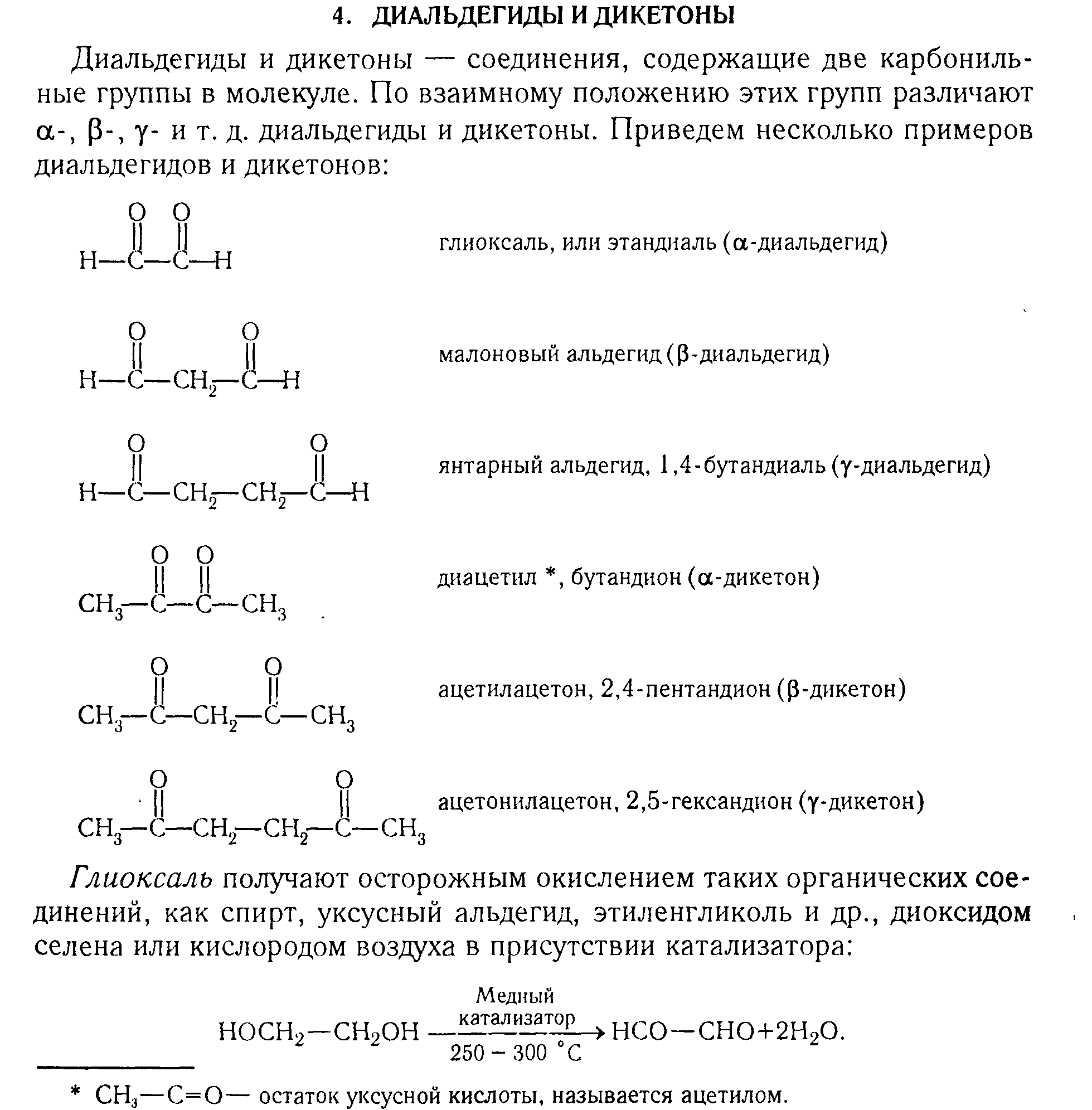
ДИКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, орг. соед., содержащие в молекуле две карбонильные группы С=О. К ним относятся диальдегиды, дикетоны, кетоальдегиды, альдегидо- и кетокислоты (и их производные) и т. п. Помимо св-в, характерных для карбонильных соед., дикарбонильные соединения проявляют специфич. св-ва, зависящие от взаимного расположения групп СО.
a-Дикарбонильные соединения (1,2-дикарбонильные соединения) RCOCOR'. Карбонильные группы обычно обнаруживают ярко выраженную электроф. реакц. способность. Для них характерна циклизация при действии бифункциональных нуклеофилов (напр., ур-ние 1) и соед. 3-валентного Р (2). Связь С—С между группами СО обычно сравнительно легко расщепляется, напр., при фотолизе (3) или действии нуклеофилов (4). Для a-диальдегида (глиоксаля)и a-кетоальдегидов характерна внутримол. Канниццаро реакция, для ароматич. a-дикетонов (бензилов) - бензиловая перегруппировка.
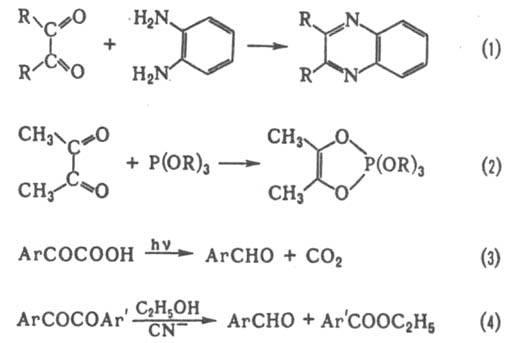
Осн. способы получения a-дикарбонильных соединений - окисление монокарбонильных соед. (5) или их a-замещенных производных, напр. ацилоинов (6), производных ендиолов (7), гликолей и др.; ароматич. a-дикетоны получают также из ароматич. соед. и оксалилхлорида по р-ции Фриделя - Крафтса.
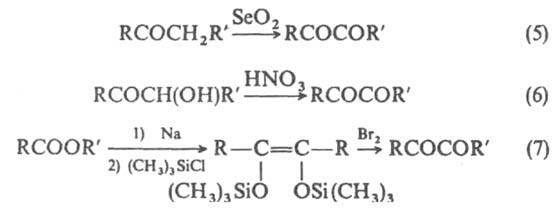
Нек-рые a-дикарбонильные соединения, напр., метилглиоксаль СН3СОСНО, пировиноградная к-та СН3СОСООН, участвуют в обмене в-в в живых организмах. Диацетил обусловливает запах сливочного масла; его производное - диметилглиоксим применяется как аналит.реагент. a-Дикарбонильные соединения используют в орг. синтезе для получения гетероциклич. соед.
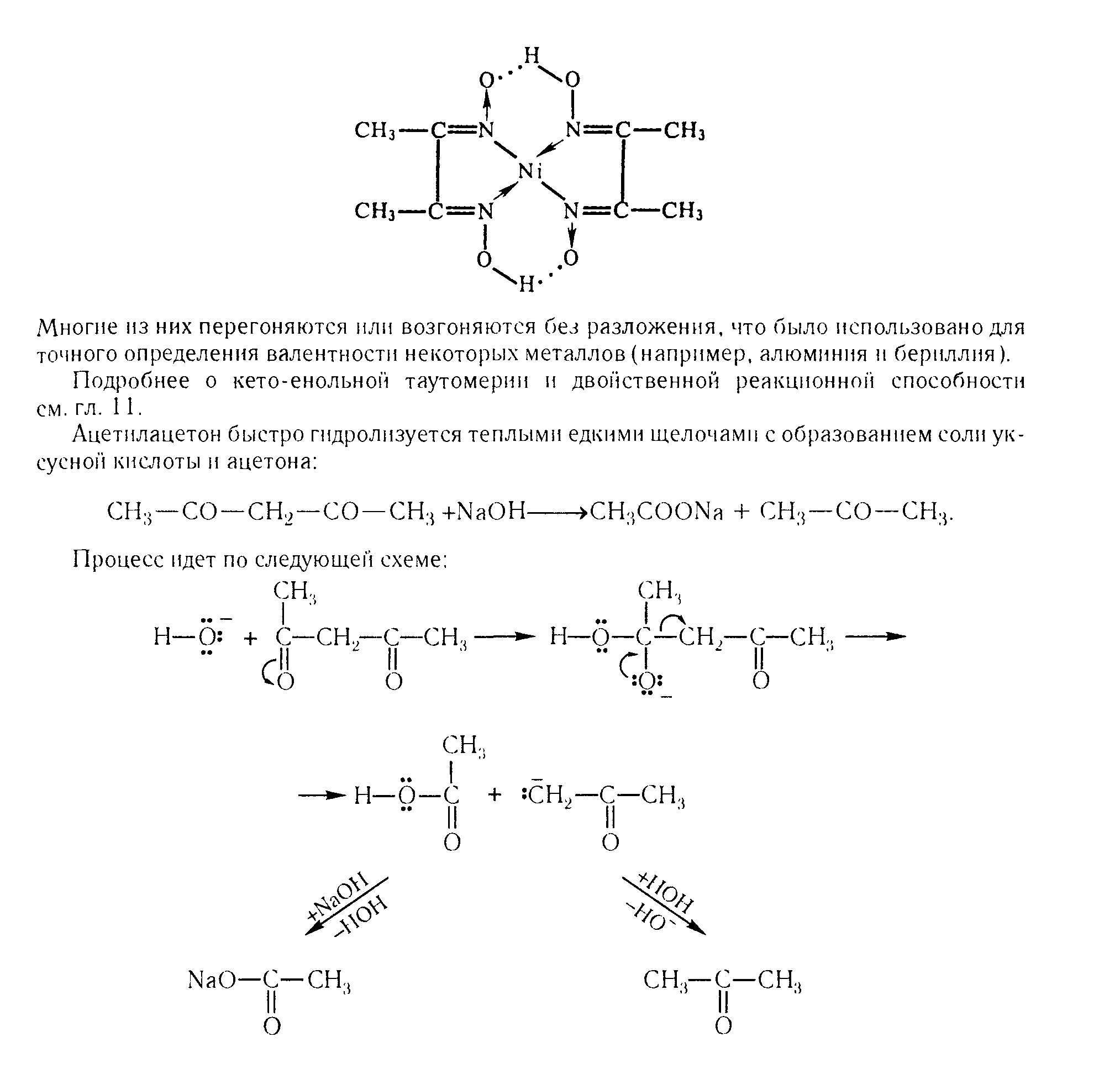
b-Дикарбонильные соединения (1,3-дикарбонильные соединения) RCOC(R:R':)COR'. Соед. с R: и(или) R': = Н - сравнительно сильные СН-кислоты. Для них характерна легкая енолизация с образованием цис-енолов (в хелатной форме с внутримол. водородной связью), реже -транс-енолов :
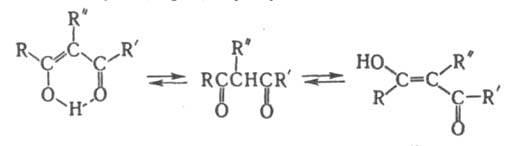
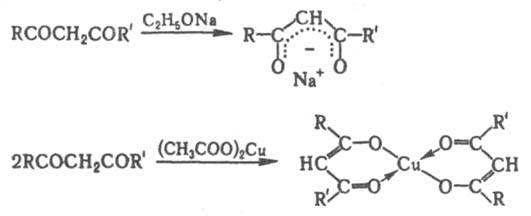
Наличие электроноакцепторных заместителей, напр., в случае полифтор-b-дикетонов, увеличивает кислотность кетоформы и способствует енолизации, а введение объемистых заместителей затрудняет ее. b-Дикарбонильные соединения легко образуют еноляты щелочных металлов, а с солями двух- и поливалентных металлов - прочные внутрикомплексные еноляты, содержащие хелатный цикл (см. b-Дикетонаты металлов), напр.:
Благодаря образованию енолятов b-дикарбонильные соединения в присут. оснований вступают в конденсации типа альдольной, р-ции Кнёвенагеля, Михаэля и т. п., легко алкилируются и ацилируются с образованием С- или О-производных (соотношение продуктов зависит от строения b-дикарбонильного соединения, природы основания и реагента, полярности р-рителя), напр.:
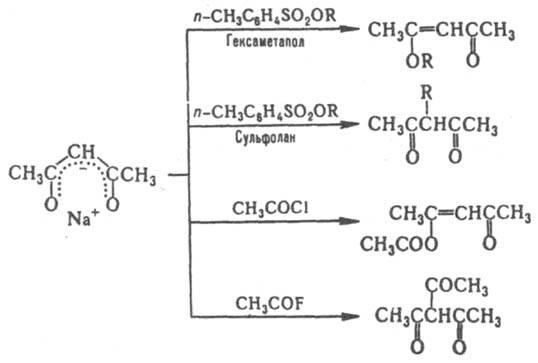
При действии избытка сильного основания на 1,3-дикарбонильные соединения, у к-рых имеются a- и g-атомы Н, образуются соли, содержащие дианионы этих дикарбонильных соединений; в этом случае атака электрофила направляется на g-атом С, напр.:
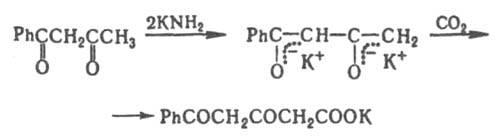
Под действием сильных оснований в жестких условиях расщепляется связь С—С ("кислотное расщепление" ацетоуксусного эфира). Взаимод. b-дикарбонильных соединений с бифункциональными нуклеофилами получают пяти-, шести- или семичленные гетероциклы, напр.:
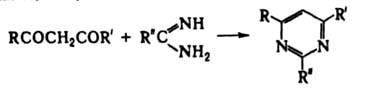
b-Дикарбонильные соединения получают гл. обр. Клайзена конденсацией, а также аналогичными р-циями из производных енолов, напр.:

b-Дикарбонильные соединения широко применяют в орг. синтезе (см., напр., Ацетоуксусный эфир ) для получения лек. ср-в, красителей и др. b-Дикетоны используют для разделения и анализа РЗЭ и актиноидов. См. также Ацетилацетон, Гексафторацетилацетон,Индандионы, Теноилтрифторацетон, Трифторацетилацетон.
g-Дикарбонильные соединения (1,4-дикарбонильные соединения)
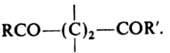
При дегидратации, действии H2S или NH3 образуют соотв. замещенные фураны, тиофены или пирролы:
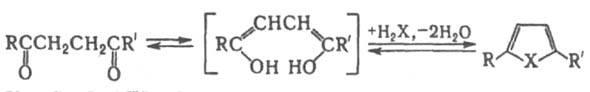
(X = О, S, NH). Внутримол. р-ция типа кротоновой конденсации приводит к замещенным циклопентенонам:
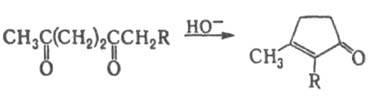
g-Дикарбонильные соединения получают окислит. димеризацией карбонильных соед. (напр., ур-ние 8) или соответствующих производных енолов (9), присоединением альдегидов к a, b-ненасыщенным карбонильным соед. (10), гидролизом замещенных фуранов(11).
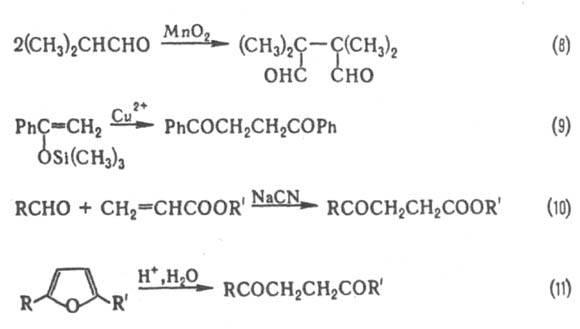
Используют g-дикарбонильные соединения в орг. синтезе, напр., для получения жасмона, простагландинов, пиретроидов, гетероциклич. соединений.
d- и e-Дикарбонильные соединения (1,5- и 1,6-дикарбонильные соединения)
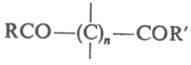 (п
= 3,4).
(п
= 3,4).
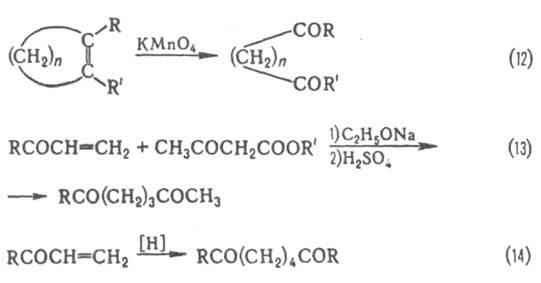
При значит. удалении одной карбонильной группы от другой их взаимное влияние уменьшается; по реакц. способности дикарбонильные соединения с такими группами не отличаются от монокарбонильных соед., однако появляется возможность образования циклов, напр.:
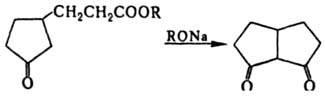
Эти дикарбонильные соединения образуются, напр., при окислит. расщеплении ненасыщенных алициклич. соед. (ур-ние 12).d-Дикарбонильные соединения получают также по р-ции Михаэля (13), а e-дикарбонильные соединения - гидродимеризацией a,b-ненасыщенных карбонильных соед. (14):