
- •Дисциплина: Инженерная химия
- •2. Технологические критерии эффективности химико-технологических процесса (производительность, интенсивность, степень превращения для различных видов реакций, селективность, выход продукта).
- •3. Принципы составления материальных и тепловых балансов химических реакций.
- •4. Эмпирические методы расчета тепловых эффектов.
- •Рассмотрим, например простую обратимую химическую реакцию:
- •7. Исследование кинетики гомогенных химических реакций. Реакторы периодического действия с постоянным и переменным объемом реакционной массы, реакторы идеального вытеснения.
- •8. Особенности исследования кинетики гомогенных каталитических процессов.
- •9. Кинетика гетерогенно - каталитических процессов.
- •10. Основные стадии и кинетические особенности гетерогенно- каталитических процессов.
- •12. Кинетика гетерофазных химических. Процессов в системах газ-жидкость, жидкость-жидкость (несмешивающиеся). Диффузионная, кинетическая и переходная области гетерофазного процесса.
- •14. Общие положения, понятие о химических реакторах, классификация химических реакторов: периодические, непрерывнодействующие и полупериодические реакторы.
- •15. Общие положения, понятие о химических реакторах, классификация химических реакторов: изотермические, адиабатические и политропные реакторы, реакторы смешения и вытеснения.
- •18. Расчет изотермических реакторов для проведения процессов в системах г-ж, ж-ж(н), аппараты колонного типа, система смеситель-сепаратор, модели смещения фаз в реакторах полупериодического действия.
- •20. Основы расчета реакторов с неидеальным потоком движения реакционной среды, использование ячеечной и диффузионной модели для расчета реальных реакторов.
- •Проектные уравнения реакторов, работающих в политропном режиме
- •Проектные уравнения реакторов, работающих в адиабатическом режиме
- •Проектные уравнения реакторов, работающих в изотермическом режиме
- •Оптимальный температурный режим и способы его осуществления в промышленных реакторах
- •1) Простые необратимые реакции
- •2) Обратимые химические реакции
- •Тепловая устойчивость химических реакторов
4. Эмпирические методы расчета тепловых эффектов.
1.
Эмпирический метод расчета газообразных
веществ (при 25оС)
![]() по Коновалову:
по Коновалову:
![]() ;ккал/моль;
;ккал/моль;
![]() –теплота
сгорания органических соединений до
CO2
и H2O,
–теплота
сгорания органических соединений до
CO2
и H2O,
48,8 – коэффициент, выражающий теплоту полного сгорания в расчетах на 1 г атома кислорода;
10,6 – коэффициент, учитывающий теплоту конденсации;
m – число атомов кислорода, необходимое для полного сгорания вещества;
n – число молей воды, которое образуется в результате сгорания;
![]() -
поправочная величина для всех предельных
органических соединений
-
поправочная величина для всех предельных
органических соединений
![]() =0;
для не предельных
=0;
для не предельных![]() .
Значение постоянно для всего гомологического
ряда и растет с повышением не предельности.
.
Значение постоянно для всего гомологического
ряда и растет с повышением не предельности.![]() ,
,![]() .
.
2.
Расчет
![]() для
жидких веществ (Т=250)по
Карашу:
для
жидких веществ (Т=250)по
Карашу:
![]() ,
ккал/моль
,
ккал/моль
С – число атомов углерода в соединении;
Н – число атомов водорода в соединении;
Р – число частично смещенных электронов в соединении;
![]() -
число одноименных заместителей;
-
число одноименных заместителей;
![]() -
соответствующее данному заместителю
тепловая поправка.
-
соответствующее данному заместителю
тепловая поправка.
3.Расчет
![]() по энергии связи:
по энергии связи:
![]() ;
;
εi, εj – энергия связи;
n – число твердых атомов в исходном веществе;
Qвозг – тепловая возгонка для данного элемента.
4. Эмпирический метод расчета теплоемкости:
![]() ;
Дж/моль*К
;
Дж/моль*К
ni – число атомов;
Сi – атомная теплоемкость.
5. Термодинамическая вероятность протекания химических процессов. Расчет равновесной степени превращения и равновесного состава реакционной массы по константе равновесия, законы смещения равновесий. Принцип Ле-Шателье.
При теоретическом исследовании сложных процессов часто возникает необходимость установить какие реакции из нескольких обратимых термодинамически наиболее вероятны и в каком направлении будет протекать реакция.


Мерой
сродства реагентов к химическому
взаимодействию в изобарно-изотермических
условиях служит энергия Гиббса

 ,
которую рассчитывают, либо определяют
на основе экспериментальных данных по
уравнению:
,
которую рассчитывают, либо определяют
на основе экспериментальных данных по
уравнению:

Для
расчета
 в стандартных условиях используют
уравнение:
в стандартных условиях используют
уравнение:

 ,
,
где
 - энергия Гиббса веществ, участвующих
в химической реакции при стандартной
температуре;
- энергия Гиббса веществ, участвующих
в химической реакции при стандартной
температуре; -
стехиометрические коэффициенты в
уравнении реакции для продуктов реакции
и исходных реагентов соответственно;
-
стехиометрические коэффициенты в
уравнении реакции для продуктов реакции
и исходных реагентов соответственно; -
тепловой эффект реакции при данной
температуре;
-
тепловой эффект реакции при данной
температуре; - изменение энтропии реакции при данной
температуре; Т-температура реакции.
- изменение энтропии реакции при данной
температуре; Т-температура реакции.
Изменение энтропии реакции при данной температуре можно рассчитать по уравнению:

Стандартное
значение
 находят по разности между энтропией
конечных продуктов и исходных веществ.
находят по разности между энтропией
конечных продуктов и исходных веществ.

 ,
,
где
 -
энтропия химических веществ участников
реакции при стандартной температуре;
-
энтропия химических веществ участников
реакции при стандартной температуре;
Термодинамическая
вероятность протекания химических
реакций определяется величиной и знаком
энергии Гиббса. При
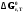 < 0 наиболее вероятное течение прямой
реакции (справа налево); при
< 0 наиболее вероятное течение прямой
реакции (справа налево); при > 0 наиболее вероятное течение обратной
реакции (слева направо); при
> 0 наиболее вероятное течение обратной
реакции (слева направо); при »
0 существует равновесие реакции. Для
реальных условий
»
0 существует равновесие реакции. Для
реальных условий
 рассчитывают по уравнению Темкина-Шварцмана.
рассчитывают по уравнению Темкина-Шварцмана.
Если
 >>0
– реакция не протекает самопроизвольно.
>>0
– реакция не протекает самопроизвольно.
Если
 <<0
– реакция протекает самопроизвольно.
<<0
– реакция протекает самопроизвольно.
Таким образом, рассчитав величину энергии Гиббса для всех реакций, которые теоретически возможны в рассматриваемом сложном и (или) обратимом процессе и сравнивая их, можно установить термодинамически наиболее вероятную реакцию. Если этой реакцией является целевая реакция, то остается подобрать такие параметры технологического режима, которые будут обеспечивать наивысшую степень превращения сырья (наибольший выход продукта). Подбор параметров для обратимых реакций можно проводить при известном значении константы равновесия.
Для расчета константы равновесия в изобарно-изотермических условиях используют уравнение изотермы Вант-Гоффа:

 ,
,
 ,
,
где Кр - константа равновесия, R-универсальная газовая постоянная.
Если рассчитанное значение Кр << 1, то равновесие в системе смещено в сторону образования исходных реагентов (выход продукта мал). При Кр>>1, равновесие в системе смещено в сторону образования продуктов реакции (выход продукта велик). Если Кр »1, то система находится в состоянии равновесия.
В
изохорно - изотермических процессах
этот же анализ проводят на основе энергии
Гельмгольца
 .
.
Все обратимые химические реакции во времени стремятся к равновесию, при котором скорости прямого и обратного процессов уравновешиваются, в результате чего соотношение компонентов в реакционной массе остается неизменным, пока в системе не изменяются параметры технологического режима (температура, давление, концентрации компонентов). При изменении параметров технологического режима равновесие в системе нарушается и самопроизвольно переходит в новое состояние, которое характеризуется новым соотношением компонентов реакционной массы.
Зная значения константы равновесия, можно легко рассчитать состав реакционной массы обратимых химических реакций и определить максимально возможный (теоретический) выход целевого продукта или равновесную степень превращения.
Целью расчета равновесного состава является количественное определение содержания компонентов реакционной массы в состоянии равновесия. По этим данным можно рассчитать материальный и тепловой баланс, составить кинетическую модель, а так же рассчитать реактор для обратимых химических реакций.
В основе этих процессов лежит закон действующих масс.
