
- •(ЧитГу)
- •Индивидуальные домашние задания по химии
- •1. Классы неорганических соединений
- •12,73 Г г раствора, тогда г
- •Вариант 2
- •Вариант 5
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •2. Химический эквивалент
- •Решение. Эквивалент есть количество вещества и выражается в молях.
- •Решение. Эквивалентную массу koh рассчитаем по формуле:
- •Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
- •3. Строение атома
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 1
- •Вариант 5
- •Вариант 17
- •Вариант 18
- •5. Химическая термодинамика
- •Вариант 9
- •Вариант 1
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •11. Свойства металлов
- •Вариант 11
- •Вариант 21
- •Библиографический список
- •672039, Чита, ул. Александрово-Заводская, 30
3. Строение атома
Пример 1. Напишите электронные формулы атомов углерода и серы и формулы соединений их с кислородом и водородом.
Решение.Электронная формула атома углерода 6С 1s22s22p2, он имеет четыре валентных электрона, для него характерны степени окисления +2, +4, –4 (до восьмиэлектронного внешнего уровня не достает 4 электрона). С+2О – оксид углерода(II), С+4O2 – оксид углерода(IV), C-4H4 – метан. Электронная формула атома серы 16S 1s22s2p63s23p4. Для серы характерны степени окисления –2, +4, +6. S+4O2 – оксид серы(IV), S+6O3 – оксид серы(VI), H2S–2 – гидрид серы (II).
Пример 2. Изобразите электронные и электронно-графические формулы атомов 5В и 21Sc. Укажите валентные электроны. К какому семейству относятся атомы данных элементов?
Решение. Электронная формула атома бора 5В 1s22s22p1
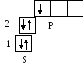 валентные
электроны
валентные
электроны
Ответ: бор относится к р – элементам
21Sc 1s22s22p63s23p63d14s2
Ответ: скандий относится к d-элементам.
Пример 3. Рассчитайте среднюю массу атома хлора.
Решение. Молярная масса атома хлора равна 35,45 г моль-1. 1 моль любого вещества содержит 6,02 · 10 23 (число Авогадро, NА) структурных единиц, например, атомов.
6,02 · 1023 атомов хлора имеют массу 35,45 г
1 атом >>>>>>>>>>>>>>>> Х
Х=![]()
Ответ: mCl = 5,8910 –23 г.
Пример 4.
Рассчитайте радиус
атома магния
![]() Mg=1,74
г
см -3.
Mg=1,74
г
см -3.
Решение.
В
твердом
состоянии атомы многих металлов образуют
так называемую плотнейшую упаковку. В
плотнейшей упаковке атомы (шары) занимают
74 % объема. Объем одного атома V=
![]() ,
один моль атомов (NА)
имеет объем Vмоль
=
,
один моль атомов (NА)
имеет объем Vмоль
=
![]() см 3.
Этот объем составляет 74 % молярного
объема Vмоль.
Отсюда
см 3.
Этот объем составляет 74 % молярного
объема Vмоль.
Отсюда
![]() =
0,74Vмоль
= 0,74
=
0,74Vмоль
= 0,74![]() ,
где АMg
– молярная масса магния.
,
где АMg
– молярная масса магния.
АMg
= 24,3 г ∙
моль-1.
r
=
![]()
![]()
Ответ: rMg = 0,16 нм.
Пример 5. Из какого числа атомов состоят 1г и 1 см3 магния?
Решение. 6,021023 атомов магния имеют массу 24,3 г
Х >>>>>>>>>>>>>>>>>>>>>> 1г
Х =
![]()
Плотность магния ρ = 1,74 г см –3, следовательно, 1 см 3 имеет массу 1,74 г.
6,0210 23 атомов магния имеют массу 24,3 г
Y >>>>>>>>>>>>>>>>>>>>>>>>> 1,74 г
Y
=
![]()
Ответ: n1 = 2,48 10 22 ат; n2 = 4,31 10 22 ат.
Вариант 1
Напишите электронные формулы атомов с зарядом ядра 8 и 19. Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
Почему у элементов седьмой группы марганца преобладают металлические свойства, а у хлора – неметаллические? Ответ мотивируйте, исходя из электронного строения атома этих элементов. Напишите формулы высших оксидов элементов и соответствующих им гидроксидов.
Рассчитайте среднюю массу атомов циркония и гафния.
Вариант 2
Какие орбитали атома заполняются электронами раньше 4d или 5s; 6s или 5p? Почему? Составьте электронную формулу атома элемента, порядковый номер которого 21.
Почему у элементов пятой группы ванадия преобладают металлические свойства, а у фосфора – неметаллические? Ответ мотивируйте, исходя из электронного строения атома этих элементов. Напишите формулы высших оксидов элементов и соответствующих им гидроксидов.
Рассчитайте среднюю массу атомов водорода и селена.
