
-
Трехмерная структура протеинкиназ
В настоящее время описана кристаллическая структура нескольких протеинкиназ, способных осуществлять фосфорилирование как остатков серина и треонина (Ser/Thr-протеинкиназы), так и остатков тирозина (Tyr-киназы). Несмотря на то что эти ферменты имеют разную субстратную специфичность, регулируются различными низкомолекулярными соединениями и взаимодействуют с разными регуляторными белками, трехмерная структура их каталитического участка имеет много общих черт.
Каталитический домен (то есть участок молекулы белка, обеспечивающий собственно перенос фосфата с АТФ на белок) большинства протеинкиназ состоит как бы из двух долей, соединенных гибким шарниром (рис. 2). Верхняя N-концевая доля содержит в своем составе пять антипараллельных Р-структурных участков (характерных элементов укладки полипептидной цепи белка, подробно описанных в [1]). Эти элементы изображены в виде пронумерованных красных стрелок на рис. 2, а. Помимо этого в состав N-концевой доли входит от одной до трехотносительно коротких а-спиралей (характерная укладка полипептидной цепи, напоминающая скрученную пружину, изображенная в виде спиралей красного цвета на рис. 2, а). Эта N-концевая часть молекулы белка отвечает за связывание АТФ (или другого нуклеозидтрифосфата) и его правильную ориентацию относительно каталитического и белоксвязывающего центров. Нижняя С-концевая большая по своим размерам часть каталитического домена содержит пять относительно длинных а-спиральных участков (D, E, F, G и H на рис. 2, а), которые формируют своеобразный фундамент для всего каталитического домена. Две доли каталитического домена соединены шарниром, который сформирован из трех коротких Р-структурных участков (стрелки 6, 7и 8на рис. 2, а), соединенных гибкими петлями и иногда короткими а-спиралями. В петле между Р-структурными участками 6 и 7 располагается собственно каталитический участок. Короткий Р-структурный участок (стрелка 9 на рис. 2, а) и участок полипептидной цепи, соединяющий восьмой Р-структурный участок (стрелка 8 на рис. 2, а, б) со спиралью F, участвуют в связывании белкового субстрата. Кроме того, в некоторых случаях в этом участке полипептидной цепи располагаются остатки, которые могут подвергаться фосфорилированию. Таким образом, в трехмерной структуре каталитического домена большинства протеинкиназ есть как бы две доли, соединенные гибким шарниром. Верхняя доля обеспечивает связывание АТФ, а нижняя — связывание белкового субстрата. Катализ осуществляется при участии аминокислотных остатков, расположенных в шарнирном участке.
Подробный анализ трехмерной структуры белка достаточно сложен, поэтому обратимся к упрощенному двухмерному изображению каталитического домена Ser/Thr-протеинкиназ (рис. 2, б). На рисунке четко видны две части каталитического домена: содержащая преимущественно Р-структурные участки N-концевая часть (отмечена красным цветом) и содержащая преимущественно а-спирали С-концевая часть (отмечена синим цветом). Катализ становится возможным только в том случае, если участки связывания АТФ (Р на рис. 2, б), каталитический центр (К на рис. 2, б), центр связывания ионов магния (М на рис. 2, б) и центр связывания белка-субстрата (Т на рис. 2, б) будут правильным образом ориентированы относительно друг друга. Таким образом, регулируя подвижность шарнира, соединяющего две доли каталитического домена, или влияя на ориентацию каталитического и белоксвязывающего участков, можно регулировать активность протеинкиназ. Например, фосфорилирование остатков треонина и тирозина, расположенных в петле, соединяющей восьмой Р-структурный участок и спираль F (рис. 2, б), фиксирует правильную ориентацию двух долей каталитического домена протеинкиназы, регулируемой специальными белками циклинами, а также МАР-киназы (Mitogen Activated Protein kinase, то есть протеинкиназы, активируемой факторами, управляющими процессами клеточного деления, митогенами). Поэтому фосфорилирование этих протеинкиназ сопровождается значительным увеличением их ферментативной активности.
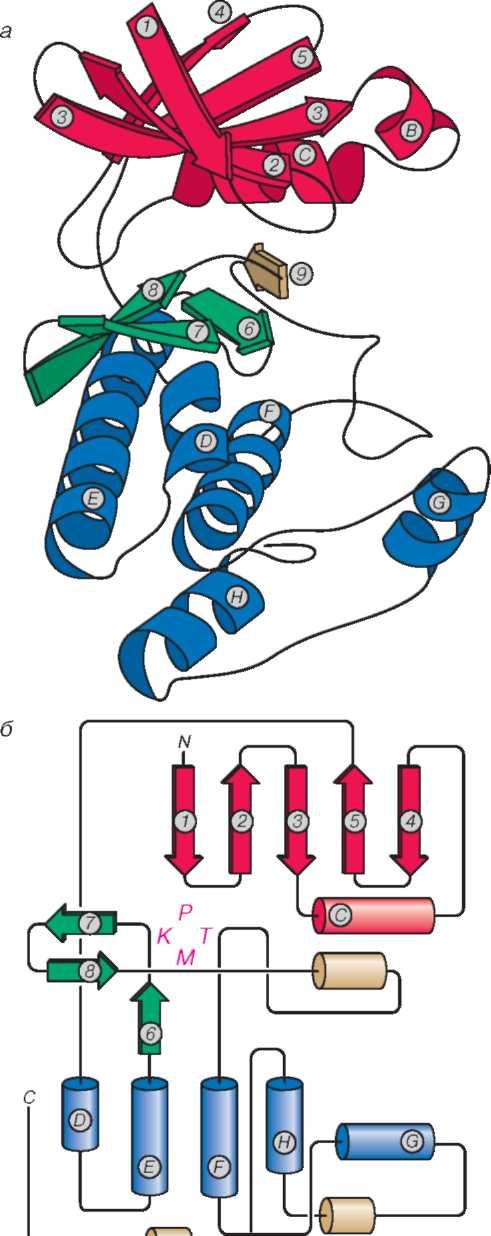
Рис. 2 Структура протеинкиназы
В рассмотренных примерах проанализировано строение каталитического домена двух Ser/Thr-протеинкиназ. Активность этих ферментов (цАМФ-зависимой протеинкиназы и циклинзависимой протеинкиназы) регулируется путем фосфорилирования определенных участков, расположенных вблизи активного центра, и путем взаимодействия со специфическими белками-регуляторами (специальной ингибиторной регуляторной субъединицей в случае цАМФ-зависимой протеинкиназы и специальных активаторов — циклинов в случае циклинзависимой протеинкиназы).
