
- •Практическое занятие №10. Задание к занятию №10.
- •1. Входной контроль знаний:
- •2. Основные вопросы темы:
- •3. Лабораторно-практические работы:
- •2.2. Нормы белка в питании у детей. Азотистый баланс, его виды, значение.
- •2.3. Переваривание белков и всасывание аминокислот в желудочно-кишечном тракте. Нарушение
- •2.4. Гниение белков в кишечнике. Пути использования аминокислот в организме после всасывания.
- •2.5. Декарбоксилирование и трансаминирование, биологическое значение. Диагностическое значение
- •2.6. Дезаминирование окислительное и непрямое аминокислот.
- •3. Лабораторно-практические работы:
- •3.1. Методика определения аминного азота в сыворотке крови нингидриновым методом.
- •Практическое занятие №11. Задание к занятию №11.
- •1. Входной контроль знаний:
- •2. Основные вопросы темы:
- •3. Лабораторно-практические работы:
- •2.2. .Биосинтез мочевины как основной механизм предотвращения накопления аммиака. Клиническое
- •2.3. Синтез креатина, креатин-фосфата, значение этого синтеза для организма. Клиническое
- •2.4. Особенности обмена отдельных аминокислот (глицин, метионин, глутаминовая и аспарагиновая
- •2.5. Нарушения в обмене отдельных аминокислот.
- •2.6. Патология азотистого обмена.
- •3. Лабораторно-практические работы:
- •Практическое занятие №12. Задание к занятию №12.
- •1. Входной контроль знаний:
- •2.2. Распад пуриновых и пиримидиновых нуклеотидов до конечных продуктов в тканях.
- •2.4. Заболевания, связанные с нарушением обмена нуклеотидов: подагра, синдром Леша-Нихена.
- •Лабораторно-практические работы:
- •Контрольная работа № 8 (Модуль 2)
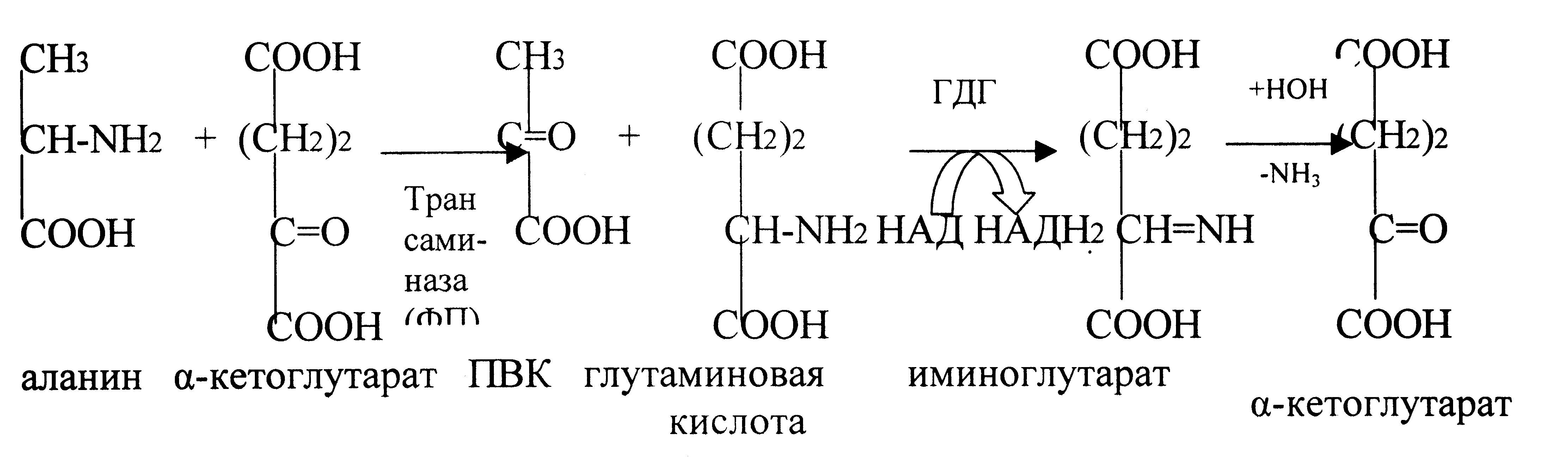
2.6. Дезаминирование окислительное и непрямое аминокислот.
Дезаминирование – процесс потери аминокислотой аминогруппы. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
1. Окислительное дезаминирование.

 NН
NН
СООН – СН2 – СН2 – С – СООН
Н
 ООС–СН2-
СН2
- СН – СООН
ООС–СН2-
СН2
- СН – СООН
 NН2
NН2


 О
О
ГДГ +НОН СООН-СН2-СН2-С-СООН
г

 лутаминовая
кислота иминоглутаратNН3
+ -
лутаминовая
кислота иминоглутаратNН3
+ -
α-кетоглутаровая кислота
 НАД
НАД
НАДН2
Остальные аминокислоты подвергаются непрямому дезаминированию.
2. Непрямое дезаминирование – это процесс дезаминирования путем трансаминирования.
3. Лабораторно-практические работы:
3.1. Методика определения аминного азота в сыворотке крови нингидриновым методом.
ПРИНЦИП МЕТОДА:
Свободные α-аминокислоты образуют с нингидрином фиолетовое окрашивание, интенсивность которого прямо пропорциональна количеству свободных аминокислот.
ХОД РАБОТЫ:
В центрифужную пробирку отмеривают 1 мл сыворотки и 1 мл 1Н СН3СООН, хорошо перемешивают, закрывают пробкой и кипятят 20 мин в водяной бане. Центрифугируют 20 мин 1500 об/мин. 0,4 мл центрифугата помещают в мерные пробирки, затем прибавляют 4 мл фосфатного буфера (рН=6,8) и 0,5 мл 1% водного раствора нингидрина. Содержимое пробирки перемешивают и ставят в кипящую водяную баню. Окраска развивается в течение 40 мин, переходя от буровато-грязного цвета к лиловому и дальше к фиолетовому. Пробирки охлаждают и доводят объем дистил. водой до 7 мл. Колориметрируют при зеленом светофильтре в кювете шириной слоя 5 мл. Количество аминного азота находят по прилагаемой таблице. Норма составляет 2,96 ± 0,1 мг%.
Практическое занятие №11. Задание к занятию №11.
Тема: Обмен и функции аминокислот.
Учебные и воспитательные цели:
-Общая цель занятия: научить использовать знания о различных процессах, в ходе которых может
образовываться аммиак, о механизмах его обезвреживания, знать биосинтез и роль креатина, креатин-
фосфата в синтезе АТФ, а также уметь использовать эти знания в практической деятельности врача.
- Частные цели:
уметь определять количество мочевины в сыворотке крови, креатинина в моче и выделять
креатин из мышечной ткани.
1. Входной контроль знаний:
1.1. Тесты.
1.2. Устный опрос.
1.3. Реферативные сообщения.
2. Основные вопросы темы:
2.1. Образование аммиака в организме и пути его обезвреживания. Гипераммониемия.
2.2. Биосинтез мочевины как основной механизм предотвращения накопления аммиака. Клиническое
значение определения мочевины.
2.3. Синтез креатина, креатин-фосфата, значение этого синтеза для организма. Клиническое
значение определения креатинина.
2.4. Особенности обмена отдельных аминокислот (глицин, метионин, глутаминовая и аспарагиновая
кислоты, триптофан, фенилаланин).
2.5. Нарушения в обмене отдельных аминокислот.
2.6. Патология азотистого обмена.
