
- •Номенклатура и изомерия
- •Изомерия аминов
- •Методы получения аминов
- •2. Восстановление нитросоединений, нитрилов, оксимов и гидразонов.
- •3. Восстановление амидов кислот.
- •2. Химические свойства.
- •2.2. Кислотность аминов.
- •2.2. Реакции бензольного кольца.
- •Se -реакции
- •Катехоламины
- •Основные термины
- •Эталонное решение задач
- •I. Эталонное решение задач первого типа.
- •Решение.
- •II. Эталонное решение задач второго типа.
- •III. Эталонное решение задач третьего типа.
- •IV. Эталонное решение задач четвёртого типа.
- •Решение.
- •V. Эталонное решение задач пятого типа.
- •Решение.
- •Решение.
- •Аминокислоты
- •Номенклатура
- •Классификация аминокислот
- •1. Моноаминомонокарбоновые.
- •2. Гидроксилсодержащие:
- •1. Аминокислоты с неполярными (гидрофобными) радикалами.
- •2. Аминокислоты с полярными (гидрофильными) радикалами.
- •3. Аминокислоты с отрицательно заряженными радикалами.
- •4. Аминокислоты с положительно заряженными радикалами
- •Способы получения α-аминокислот в условиях in vitro.
- •Физические свойства аминокислот
- •Изоэлектрическая точка аминокислот
- •Химические свойства аминокислот Амфотерность аминокислот
- •Реакции карбоксильной группы
- •1. Образование внутрикомплексных солей.
- •3. Образование хлорангидридов.
- •2. Алкилирование аминокислот.
- •3. Действие азотистой кислоты (дезаминирование in vitro).
- •4. Взаимодействие с альдегидами.
- •5. Взаимодейстивие с динитрофторбензолом (днфб).
- •Реакции функциональных групп, содержащихся в радикалах аминокислот
- •1. Реакции сульфгидрильной (тиоловой) группы.
- •2. Реакции гидроксильной группы – реакции элиминирования.
- •3. Реакции гуанидильной группы.
- •Специфические реакции α-аминокислот
- •Реакции аминокислот in vivo
- •1. Дезаминирование аминокислот
- •2. Переаминирование (трансамнирование).
- •3. Декарбоксилирование аминокислот.
- •4. Реакции гидроксилирования и карбоксилирования.
- •5. Восстановительное аминирование.
- •6. Альдольное расщепление.
- •Пептиды
- •Строение полипептидной цепи и пептидной связи
- •Hоменклатура пептидов
- •Кислотно-основные свойства пептидов
- •Определение структуры пептидов
- •Синтез пептидов
- •Классификация белков
- •1. Простые белки (протеины).
- •Структура белков
- •Конформация белков
- •Вторичная структура
- •1. Α-Спираль.
- •1) Пролин.
- •2) Одинаково заряженные радикалы.
- •3) Объёмные радикалы.
- •2. Β-складчатая структура.
- •Третичная структура
- •Четвертичная структура белков
- •Кислотно-основные свойства белков. Изоэлектрическая точка.
- •Оптические свойства белков
- •Коллоидные свойства белков
- •Денатурация белков
- •Качественные реакции на аминокислоты, пептиды и белки.
- •Задача №9
- •Задача№13
- •Решение.
- •Задача №14
- •Решение.
- •Задача №15
- •Решение.
- •Задача№16
- •Решение.
- •Задача № 17
- •Решение.
- •Задача №18
- •Решение.
- •Литература Основная
- •Дополнительная
- •Содержание
- •I.Амины
- •II. Аминоспирты
- •III.Аминокислоты
- •IV.Пептиды
- •V. Белки
- •Часть II Амины, аминоспирты, аминокислоты, белки
- •Часть II Амины, аминоспирты, аминокислоты, белки
Качественные реакции на аминокислоты, пептиды и белки.
1) Реакция с нингидрином.
В присутствии нингидрина раствор аминокислоты окрашивается в сине-фиолетовый цвет.
2) Биуретовая реакция.
Эта реакция используется для обнаружения пептидных связей в белках и пептидах. При нагревании пептидов или белков в щелочном растворе с сульфатом меди появляется сине-фиолетовая окраска.
3) Ксантопротеиновая реакция
Используется для обнаружения ароматических и гетеро-циклических аминокислотных остатков Исследуемые соединения с концентрированной азотной кислотой образуют нитросоединения, окрашенные в желтый цвет.
4) Реакция с ацетатом свинца.
Используется для обнаружения белков, содержащих цистеин. В щелочной среде образуется черный осадок сульфида свинца.
5) Реакция с диметиламинобензальдегидом (реакция Эрлиха).
Используется для качественного и количественного определения триптофана. В растворе, подкисленном серной кислотой, появляется красно-фиолетовое окрашивание.
Эталонные решения ЗАДАЧ
Задача № 1
Гидролитическое расщепление L-аспарагина до L-аспарагиновой кислоты, при участии фермента аспарагиназы, используется в медицине при лечении лейкозов. Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если аспарагин, содержащейся в плазме крови, разрушить реакцией гидролиза, происходит нарушение метаболизма в лейкозных клетках. Напишите реакцию гидролитического превращения L-аспарагина в L-аспарагиновую кислоту проекционными формулами Фишера.
Решение.

Задача № 2
Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН = 6.
Определите направление движения аминокислот при электрофорезе, если изоэлектрические точки этих аминокислот соответственно равны значениям pH: 6,0; 6,0; 9,8; 10,8; 5,7 и 3,2.
Решение.
В изоэлектрической точке (pI рН) суммарный заряд α-аминокислоты равен нулю. В данных условиях такое соотношение выполняется для аланина, глицина и серина и эти аминокислоты в электрическом поле перемещаться не будут.
При рН > pI преобладает анионная форма и аминокислота (в данном случае глутаминовая кислота) будет перемещаться к аноду.
В случае, когда рН < pI в растворе преобладает катионная форма, поэтому лизин и аргинин будут перемещаться к катоду.
Задача № 3
Даны три аминокислоты: аспарагиновая, лизин и глицин. Определить, в какой среде кислой, нейтральной или щелочной будут находиться изоэлектрические точки (И.Э.Т) этих кислот по сравнению с глицином, для которого рI = 6.
Решение.
У аспарагиновой кислоты И.Э.Т. будет находиться в более кислой среде, чем у глицина, так как для подавления диссоциации второй кар-боксильной группы требуется дополнительное количество ионов H+.
У лизина И.Э.Т. будет находиться в более щелочной среде, чем у глицина, так как для предотвращения образования второй NH3+ группы требуется дополнительное количество ионов OH.
Задача №4
Написать уравнения реакций аланина:
а) с водным раствором щелочи;
б) с водным раствором соляной кислоты;
в) с бензоилхлоридом в щелочной среде.
Решение.

Задача №5
Написать уравнения реакций лейцина:
а) с уксусным ангидридом;
б) с нитритом натрия в среде соляной кислоты;
в) с этиловым спиртом в среде серной кислоты;
г) с карбобензоксихлоридом.
Решение.
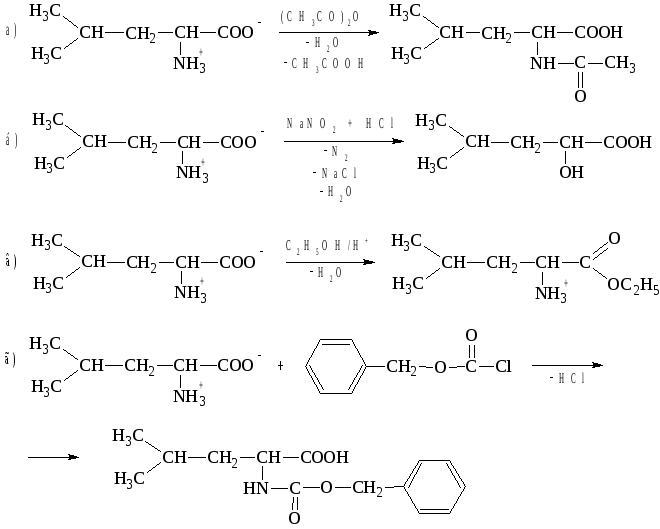
Задача № 6
В сильнощелочном растворе аминокислота
существует в виде аниона и содержит две
основные группы:NH2
и
сильнощелочном растворе аминокислота
существует в виде аниона и содержит две
основные группы:NH2
и
СОО. Учитывая тот факт, что константы основности для NH2-группы и карбоксилат-аниона R СОО соответственно равны 6,3∙105 и 2,5∙1012, определите, какая из этих групп будет более основной и к какой группе будет предпочтительно присоединяться протон при прибавлении к раствору кислоты. Какое соединение при этом образуется?
Решение.
Из приведенных констант основности следует, что аминогруппа является более сильным основанием, чем карбоксильный ион (6,3∙105 > 2,5∙1012), поэтому при добавлении кислоты протон будет присоединяться к аминогруппе, образуя биполярный ион:

Задача №7
В сильнокислом растворе аминокислота существует в виде катиона и содержит две кислотые группы: NH3+ и СООН. Учитывая, что константы кислотности для NH3+ и СООН групп соответственно равны 1,6∙1010 и 4∙103, определите, какая из этих групп будет более кислой и какая из них будет легче отдавать протон при прибавлении к исходному раствору щелочи. Какое соединение при этом образуется?
Решение.
Из приведенных констант кислотности следует, что карбоксильная группа является более сильной кислотой, чем NH3+ ион, так как Kа( NH3+) = 1,6∙1010 < Kа( СООН) = 4∙103, поэтому при добавлении щелочи карбоксильная группа будет отдавать протон, образуя биполярный ион:

Задача№8
При взаимодействии первичной аминогруппы с азотистой кислотой выделяется азот, по объёму которого по методу Ван-Слайка определяют число аминогрупп в кислоте.
При обработке равных количеств (по 0,001 моль) трех различных аминокислот получили (при н.у.):
а) в первом случае 22,4 мл азота;
б) во втором случае 44,8 мл азота;
в) в третьем случае азот не выделялся вообще.
Какие возможные аминокислоты были взяты для этих экспериментов?
Решение.
Рассчитаем количество азота, выделившихся в первом и втором опытах:
а)

Таким образом, из 0,001 моль аминокислоты выделилось 0,001 моль азота. Следовательно, это может быть любая моноамино-карбоновая кислота (одно- или двухосновная).
б)
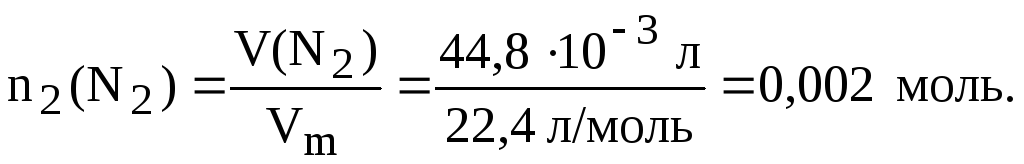
В этом опыте количество выделившегося азота вдвое больше количества исходной кислоты. Следовательно, аминокислота содержит две аминогруппы (это может быть, в частности, лизин или орнитин).
в) В этом опыте азот не выделился вообще, следовательно, аминокислота не содержала свободной первичной аминогруппы. Например, это может быть иминокислота пролин.
