
- •1. Основные понятия
- •1.1. Современное состояние микроэлектроники
- •1.1.1. Роль электроники в мировой сфере производства и потребления
- •1.1.2. Зачем России своя электроника
- •1.2.1. Классификация интегральных микросхем
- •1.2.2. Технологические операции
- •1.2.3. Элементы микросхем
- •1.2.4. Проблемы в производстве
- •Контрольные вопросы
- •2. Материалы электронной компонентной базы
- •2.1. Классификация материалов
- •2.2. Классификация полупроводниковых материалов
- •2.2.1. Собственные и примесные полупроводники
- •2.2.3. Полупроводниковые соединения
- •Контрольные вопросы
- •3. Конструкции и технологические последовательности изготовления полупроводниковых приборов и ИС
- •3.1. Развитие технологии производства изделий электронной техники
- •3.2. Методы изоляции элементов монолитных биполярных ИС
- •3.3. Методы изоляции МДП-транзисторов
- •Контрольные вопросы
- •4. Химическая обработка и травление кремниевых пластин
- •4.1. Жидкостная очистка поверхности пластин
- •4.2. Травление
- •4.3. Пористый кремний
- •Контрольные вопросы
- •5. Плазменная обработка и травление материалов электронной компонентной базы
- •5.1. Ионное травленне
- •5.2. Плазмохимическое травление
- •5.3. Реактивное ионное травление
- •Контрольные вопросы
- •6. Термическая диффузия
- •6.1. Процессы диффузионного легирования
- •6.2. Уравнение диффузии
- •6.2.1. Диффузия из одной полуограниченной области в другую
- •6.2.2. Факторы, влияющие на величину коэффициента диффузии
- •6.3. Моделирование процессов диффузии в твердом теле
- •6.3.1. Диффузия из одной полуограниченной области в другую
- •6.3.2. Количество примеси, введенной из источника неограниченной мощности
- •6.3.3. Диффузия из слоя конечной толщины
- •6.3.4. Диффузия из бесконечно тонкого слоя (точечный источник)
- •6.6. Формула Пуассона
- •6.7. Диффузия в прямоугольное окно
- •6.8. “Разгонка” примеси. Многостадийная диффузия
- •6.9. Диффузия примеси в гетерогенной системе
- •6.10. Диффузия в область ограниченных размеров
- •6.11. Определение зависимости D(N)
- •6.12. Результирующее примесное распределение
- •6.13. Методы диффузионного легирования
- •6.13.1 Диффузия из пленок, наносимых на поверхность полупроводника
- •6.13.2 Диффузия в ампуле
- •6.13.3 Диффузия в потоке газа-носителя
- •6.13.4 Метод параллельного источника
- •6.14. Источники диффузанта
- •6.14.2 Алюминий (Al), галлий (Ga) и индий (In)
- •6.14.3 Фосфор (P) мышьяк (As) и сурьма (Sb)
- •6.14.4 Эффект вытеснения коллекторного перехода
- •6.14.5 Другие диффузанты
- •6.15. Выбор легирующей примеси
- •Контрольные вопросы
- •7. Ионное легирование
- •7.1. Общие принципы процесса ионной имплантации
- •7.2. Пробеги и дисперсии пробегов ионов
- •7.2.1. Распределение пробегов ионов
- •7.2.2. Боковое рассеяние ионов
- •7.2.3. Ионное каналирование
- •7.3. Влияние радиационных дефектов
- •7.4. Отжиг дефектов ионно-имплантированных слоев
- •7.4.1. Примеры профилей распределения ионов
- •7.4.2. Лазерный и электронно-лучевой отжиг
- •7.5. Влияние технологических факторов
- •7.5.1. Диффузия имплантированных примесей
- •7.5.2. Технология маскирования при ионной имплантации
- •7.5.3. Гетерирование
- •7.6. Преимущества и недостатки ионного легирования
- •Контрольные вопросы
- •8. Методы создания диэлектрических слоев
- •8.1. Термическое окисление
- •8.2. Осаждение пленок диоксида кремния
- •8.3. Получение пленок нитрида кремния
- •8.4. Плазмохимическое осаждение
- •8.5. Особенности окисления некоторых материалов
- •8.6. Воспроизведение рельефа поверхности
- •Контрольные вопросы
- •9. Термическое окисление кремния
- •9.1. Методы получения пленок оксида кремния
- •9.2. Механизмы окисления кремния
- •9.3. Кислород в кремнии
- •9.4. Свойства и применения пленок оксида кремния
- •9.5. Модель процесса
- •9.6. Перераспределение примеси при окислении
- •9.7. Особенности технологии МДП структур
- •9.7.1. Влияние режимов окисления и термообработок на свойства МДП структур на основе кремния
- •9.7.2. Механизмы нестабильности МДП структур
- •9.7.3 Методы повышения стабильности МДП структур
- •Контрольные вопросы
- •10. Методы литографии
- •10.1. Электронно-лучевая литография
- •10.2. Рентгеновская литография
- •10.3. Ионно-лучевая литография
- •10.4. Сравнение и тенденция развития процессов литографии
- •Контрольные вопросы
- •11. Технология фотолитографии
- •11.1. Стандартная фотолитография
- •11.2. Процесс переноса изображения в фотолитографии
- •11.3. Фотолитография в глубоком ультрафиолете
- •11.4. Волновые эффекты при экспонировании
- •Контрольные вопросы
- •12. Физико-химические основы технологии эпитаксиальных слоев
- •12.1. Эпитаксия из газовой фазы
- •12.1.2. Реакторы установок эпитаксиального наращивания
- •12.1.3. Легирование и автолегирование эпитаксиальных слоев
- •12.1.4. Технология процесса эпитаксии кремния
- •12.2. Молекулярно-лучевая эпитаксия
- •12.3. Эпитаксия кремния на изолирующей подложке
- •12.4. Получение эпитаксиальных слоев полупроводниковых соединений
- •Контрольные вопросы
- •13. Технология многоуровневой металлизации
- •13.1. Термическое испарение в вакууме
- •13.1.1. Физические основы термического вакуумного напыления
- •13.1.2. Конденсация вещества на подложке
- •13.1.3. Оборудование процесса термического вакуумного напыления
- •13.1.4. Распределение толщины пленки по подложке
- •13.2. Методы ионно-плазменного распыления
- •13.2.1. Механизмы распыления вещества потоком ионов
- •13.2.2. Ионно-плазменное распыление на постоянном токе (катодное распыление)
- •Контрольные вопросы
- •14. Монтажно-сборочные операции
- •14.1. Разделение пластин на кристаллы
- •14.2. Присоединение кристаллов к корпусу
- •14.2.1. Присоединение кристалла к основанию корпуса
- •14.2.2. Присоединение выводов
- •14.2.3. Герметизация
- •14.3. Монтаж приборов в корпус
- •Контрольные вопросы
- •15. Контрольные операции
- •15. 1. Функциональный контроль приборов
- •15.2. Испытания и измерения
- •15.2.1. Контроль технологического процесса
- •15.2.2. Причины брака
- •15.2.3. Методы контроля толщины пленок
- •15. 3. Заключительные операции
- •15.3.1. Герметизация кристалла
- •15.3.2. Контроль герметичности
- •Контрольные вопросы
19
некоторые переходные металлы, соли железа, кобальта, никеля и редкоземельных элементов.
Ферромагнетики – это вещества, обладающие большой положительной магнитной восприимчивостью, которая значительно зависит от напряженности внешнего магнитного поля и температуры. Важнейшей особенностью является их способность намагничиваться в слабых магнитных полях. К ферромагнетикам относятся вещества сложного состав на основе оксидов железа и двухвалентных (или одновалентных – реже) металлов.
Антиферромагнетики – это вещества с небольшой положительной магнитной восприимчивостью, которая значительно зависит от температуры. При нагревании они переходят в парамагнитное состояние. Такими материалами является хром, марганец, редкоземельные элементы.
Ферримагнетики – это вещества, обладающие высокой магнитной восприимчивостью, зависящей от магнитного поля и температуры. Магнитные свойства ферримагнетиков обусловлены нескомпенсированным антиферромагнетизмом. Такими материалами являются оксидные соединения – ферриты.
2.2. Классификация полупроводниковых материалов
Классификацию полупроводниковых материалов проводят по различным признакам. Наиболее широко применяется классификация, в основу которой положен химический состав материала. В соответствии с этим различают органические и неорганические полупроводники. В свою очередь неорганические полупроводниковые материалы делятся на простые и сложные. Простыми называют полупроводники, состоящие, в основном, из атомов одного химического элемента, например: бор В, кремний Si, фосфор Р, сера α–S, германий Gе, мышьяк Аs, серое олово α–Sn, сурьма β–Sb, селен Sе, теллур Те. Сложными называют полупроводники, состоящие из атомов двух или большего числа химических элементов, например: соединения типа AIV– ВIV (сульфид свинца РbS, теллурид свинца РbТе); AII–ВIV (сульфид кадмия СоdS; селенид кадмия СdSe; окись цинка ZnO; сульфид цинка ZnS); AIII–ВV (антимонид алюминия АlSb; антимонид галлия GаР; арсенид галлия ПаAs; фосфид галлия GаР; антимонид индия InSb; арсенид индия InAs; фосфид индия InР).
Кроме неорганических веществ полупроводниковыми свойствами обладают также и некоторые органические вещества, такие как бензол, нафталин и т. д.
В зависимости от агрегатного состояния вещества различают кристаллические, аморфные и жидкие полупроводники.
Иногда в качестве отдельных классов рассматривают очень узкозонные полупроводники, оксидные полупроводники, магнитные полупроводники и т.д., учитывая специфичность физических процессов, в них протекающих.
20
2.2.1. Собственные и примесные полупроводники
Собственный полупроводник – полупроводник, не содержащий примесей или с концентрацией примеси настолько малой, что она не оказывает существенного влияния на удельную проводимость полупроводника. При температуре абсолютного нуля в собственном полупроводнике отсутствуют носители заряда, так как валентная зона полностью занята электронами (там нет дырок), а в зоне проводимости нет электронов. При температурах выше абсолютного нуля некоторые электроны валентной зоны могут быть переброшены в зону проводимости – возможна тепловая генерация пар носителей заряда, в зоне проводимости передаются свободные электроны, а в валентной зоне –дырки.
В каждом случае возбуждения в собственном полупроводнике одновременно создаются два носителя заряда с противоположными знаками.
Энергия, необходимая для разрыва ковалентной связи и образования пар свободных носителей заряда, определяется шириной запрещенной зоны собственного полупроводника Е. При отсутствии внешнего электрического поля дырка, как и электрон, беспорядочно перемещается (мигрирует) по кристаллу. Миграция дырки осуществляется за счет поочередного перехода электронов под действием тепловых колебаний решетки из одной связи в другую, т. е. за счет поочередного перемещения валентных электронов в валентной зоне. Подвижности электронов и дырок не одинаковы. Электроны и дырки обладают различной инерционностью при движении в поле кристаллической решетки полупроводника, т. е. они отличаются различными эффективными массами. Эффективная масса носителя заряда обратно пропорциональна ширине той зоны, в которой он находится. Так как ширина разрешенных зон возрастает по мере увеличения энергии, зона проводимости обычно бывает шире валентной зовы. Этим и объясняется то, что эффективная масса дырок больше, чем электронов. Следовательно, собственная электропроводность полупроводников имеет слабо преобладающий электронный характер.
В качестве примера собственного полупроводника рассмотрим монокристаллы кремния и германия, являющиеся элементами IV группы периодической системы элементов Д. И. Менделеева, ширина запрещенной зоны которых составляет при 300 К 1,16 и 0,74 эВ соответственно.
Германий имеет более низкую температуру плавления (937 °С) по сравнению с кремнием (1420°С), его легче приготовлять и очищать, поэтому он широко использовался в большинстве первых твердотельных электронных приборов. Однако к настоящему времени его почти полностью заменил более распространенный в природе кремний.
В твердом состоянии эти материалы имеют кристаллическую решетку типа алмаза – пространственная симметрия Oh5(Fd3m). В этой структуре каждый атом связан с четыPbмя другими атомами ковалентной связью (структура
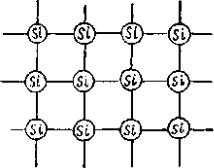
21
внешней оболочки кремния 3s23p2).; германия–4s24p2). На рис 2.1 приведено схематическое изображение кристаллической решетки кремния (германия)
Рис. 2.1
Процесс образования электронов и дырок в полупроводнике существенно отличается от рассмотренного выше при наличии небольшой концентрации дефектов кристаллической решетки, образующих локальные энергетические уровни, располагающиеся внутри запрещенной зоны полупроводника. Концентрация этих дефектов должна быть очень малой, чтобы исключить возможность их взаимодействия. Обычно она не превышает величины 0,01 атомных процента. При большой концентрации дефектов соответствующие им энергетические уровни могут образовать зону, лежащую в запрещенной зоне основного вещества. Роль таких дефектов в простых полупроводниках, как правило, играют чужеродные атомы примесей, а в сложных – и отклонения от стехиометрического (соответствующего химической формуле) состава. Локальные уровни, образованные примесями, называются примесными уровнями. Примеси могут быть донорного и акцепторного типа. Примесный атом или дефект кристаллической решетки, создающий в запрещенной зоне энергетический уровень, занятый в невозбужденном состоянии электроном и способный в возбужденном состоянии отдать электрон в зону проводимости, называется донором. Для кристаллов германия и кремния донорами могут быть элементы V группы таблицы Д. И. Менделеева – мышьяк, фосфор, сурьма. При внедрении в решетку кремния (германия) атомов, например, фосфора атом примеси замещает в ней атом основного элемента и образует четыре ковалентные связи с окружающими его атомами. Пятый валентный электрон атома фосфора связан с ним силами кулоновского взаимодействия. Энергия этой связи невелика и составляет величину примерно 0,05эВ. Это означает, что энергетический уровень атома фосфора, на котором располагается валентный электрон, лежит в запрещенной зоне на расстоянии Еg ~0,05эВ от дна зоны проводимости. Поэтому уже при комнатной температуре T=300 К будет происходить ионизация примесных атомов за счет отрыва пятого валентного электрона.
Минимальная энергия, необходимая для переброса электрона примеси в зону проводимости с донорного уровня, называется энергией активизации донора.
Таким образом, полупроводник с донорной примесью имеет концентрацию электронов в зоне проводимости во много раз большую, чем концентрация
22
дырок в валентной зоне. Такой полупроводник называют электронным полупроводником или полупроводником n-типа.
Примесный атом или дефект кристаллической решетки, создающий в запрещенной зоне энергетический уровень, свободный от электрона в невозбужденном состоянии и способный захватить электрон из валентной зоны в возбужденном состоянии, называется акцептором.
Для кристаллов германия и кремния акцепторами могут быть элементы III группы таблицы Д. И. Менделеева – атомы бора, алюминия, индия. Энергия их активизации EA составляет 0,01–0,7 эВ. Энергетические уровни акцепторных примесей располагаются вблизи от потолка валентной зоны. Если на место одного из атомов полупроводника в какой-либо узел решетки попадает трехвалентный атом примеси, то для образования ковалентной связи между атомами примеси и атомами основного вещества не хватает одного электрона. Незавершенная связь в результате тепловых колебаний решетки может быть заполнена электроном, участвующим в образовании соседней связи, которая, в свою очередь, оказалась незавершенной. Таким образом, в качестве активного переносчика заряда в этом случае служит вакансия электрона–дырка. Полупроводники с акцепторной примесью имеют концентрацию дырок в валентной зоне во много раз большую, чем концентрация электронов в зоне проводимости. Такой полупроводник называют дырочным или полупроводником р-типа.
Электроны в электронных, а дырки в дырочных полупроводниках называются основными носителями заряда, а носители заряда – противоположного знака – неосновными носителями. Полупроводниковые материалы, электрические характеристики которых определяются донорными или акцепторными примесями, называют примесными полупроводниками. Полупроводники, у которых концентрация доноров равна концентрации акцепторов, называют скомпенсированными.
2.2.2. Одноатомные полупроводники Кремний состоит из трех стабильных изотопов:
2814Si (92,27%), 2914Si (4,68%) и 3014Si (3,05%).
Кремний после кислорода – самый распространенный элемент в земной коре. В свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот – силикаты.
Вот состав некоторых природных силикатов:
полевой шпат К2О× Аl2O3× 6SiO2,
асбест 3MgО× 2SiO2× 2H2O, cлюда К2О× 3Аl2O3× 6SiO2× 2H2O, каолинит 3Аl2O3× 2SiO2× 2H2O.
23
Получение. В промышленности кремний получают восстановлением SiO2 коксом в электрических печах. В лаборатории в качестве восстановителей используют магний или алюминий. Наиболее чистый кремний получают восстановлением тетрахлорида кремния парами цинка.
Для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В соединениях обычно проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения, например, SiO.
При нормальных условиях активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры свыше 400–500 °C кремний реагирует с
кислородом с образованием SiO2, с хлором, бромом и иодом – с
образованием соответствующих легко летучих тетрагалогенидов и, возможно, галогенидов более сложного состава.
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором – термически и химически стойкие бориды SiB3, SiB6 и SiB12.
При температурах свыше 1000 °C можно получить соединение кремния и углерода – карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью. При этом, расплав кремния (1415 °C) может длительное время контактировать с углеродом в виде крупных кусков плотноспечённого мелкозернистого графита изостатического прессования, практически не растворяя и никак не взаимодействуя с последним.
Кислоты (кроме смеси плавиковой HF и азотной HNO3) на кремний не действуют. Однако он растворяется в гидроксидах щелочных металлов, образуя силикат и водород.
В реакциях с активными металлами, протекающих с образованием силицидов, кремний выступает в роли окислителя. При высоких температурах кремний восстанавливает многие металлы из их оксидов. С
водородом кремний непосредственно не реагирует, соединения кремния с водородом – силаны получают косвенным путем. Моносилан SiH4, ядовитый газ с неприятным запахом, самовоспламеняется на воздухе, выделяется при взаимодействии силицидов металлов с растворами кислот. Образующийся SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (–Si–Si–Si–).
Оксид кремния (IV) SiO2 относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты. SiO2 является ангидридом ряда кремниевых кислот:
SiO2 × H2O, т. е. H2SiO3 – метакремниевая кислота; SiO2 × 2H2O, т. е. H4SiO4 – ортокремниевая кислота;
