
u_lectures
.pdf111
Энтропия любого тела, достигшего равновесного состояния, при температуре абсолютного нуля обращается в нуль.
Второе начало термодинамики допускает некоторое отклонение (флуктуации) от него. Примерами таких флуктуаций могут быть: броуновское движение частиц; равновесное тепловое излучение нагретых тел (и радиошумы), появление зародышей новой фазы при фазовых превращениях, а также самопроизвольные флуктуации температуры и давления в равновесных системах.
Появившиеся в прошлом веке выводы о “тепловой смерти” Вселенной оказались несостоятельными, т.к. в Метагалактике существенную роль играет тяготение, которое никак не учитывалось при изучении термодинамических процессов. Например, в начальной стадии эволюции Вселенной тяготение способствовало зарождению протогалактик, протозвезд. В результате этого мы наблюдаем современное состояние Вселенной. Кроме того, тяготение способствует существованию устойчивой стадии излучения звезд (десятки миллиардов лет), когда они находятся на главной последовательности (наше Солнце существует около пяти миллиардов лет). Тяготение не покидает звезды и на последних стадиях их существования (взрывы сверхновых, с образованием нейтронных звезд или превращением массивных звезд в черные дыры).
При взрывах сверхновых звезд высвобождается гравитационная энергия, значительная часть которой переходит в другие виды энергии: ядерную (синтез тяжелых элементов тяжелее железа), во вращательную, тепловую энергии и т.д.).
Лекция №17 (Тема 17)
4.17. 1. Уравнение Ван-дер-Ваальса
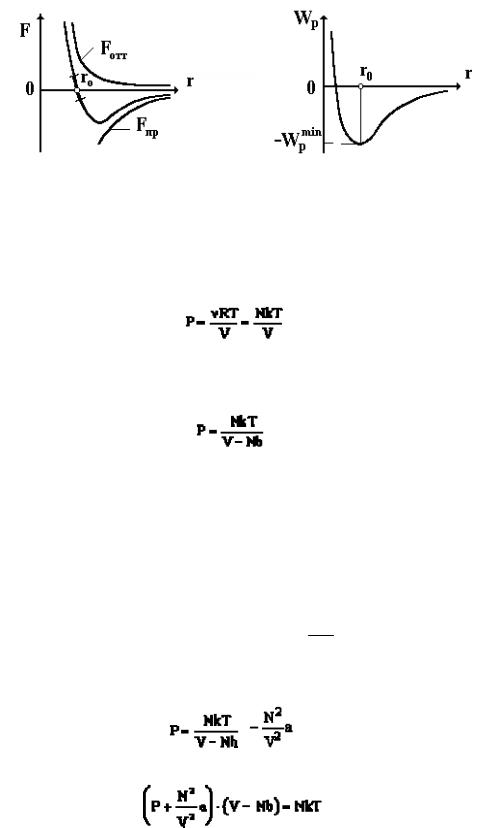
Экспериментальные исследования вязкости, удельной теплоемкости и других физических свойств показали, что реальные газы по своим свойствам значительно отличаются от идеальных газов и связаны с молекулярным взаимодействием между молекулами реального газа. Между ними существуют силы притяжения и отталкивания. Зависимость силы взаимодействия молекул от расстояния между ними приведена на рис. 17.1, а.
При r = r0 силы притяжения и отталкивания равны по абсолютной величине. Если r > r0, то преобладают силы притяжения, особенно на больших расстояниях, что и приводит к конденсации газа в жидкость. При r<ro преобладают силы отталкивания, что свидетельствует о наличии собственных размеров молекул. При взаимодействии молекулы обладают потенциальной энергией. График зависимости Wp = Wp(r) приведен на рис. 17.1, б.
112
С учетом рассмотренного выше, Ван-дер-Ваальс предложил модель реального газа и получил уравнение, описывающее его состояние.
а |
б |
Рис. 17.1
Для этого были введены поправки в уравнение состояния идеального газа, учитывающие собственный объем молекул и их взаимодействие. Первая поправка связана с существованием ограниченной сжимаемости реального газа. Следовательно, в уравнении
(17.1)
нужно заменить V на V-Nb, где b=16pR3/3 - поправка на собственный объем молекул, учитывающая действие сил притяжения между молекулами; N - число молекул, R - радиус молекулы. Тогда формула (17.1) принимает вид
. |
(17.2) |
|
Вторая поправка связана с существованием притяжения между молекулами, которое приводит к уменьшению давления реального газа на стенки сосуда, так как на любую молекулу, вблизи стенок сосуда, действует со стороны остальных молекул результирующая сила, направленная внутрь сосуда и пропорциональная концентрации молекул: n0 =N/V. Кроме того, давление также прямо пропорционально концентрации молекул (Р=n0kT). Следовательно, полное давление уменьшится на величину, прямо пропорциональную
N2
квадрату концентрации газа, т.е. на величину V2 a , где а - постоянная, учи-
тывающая особенность сил притяжения данного сорта молекул. Поэтому формула запишется в виде
(17.2)
.
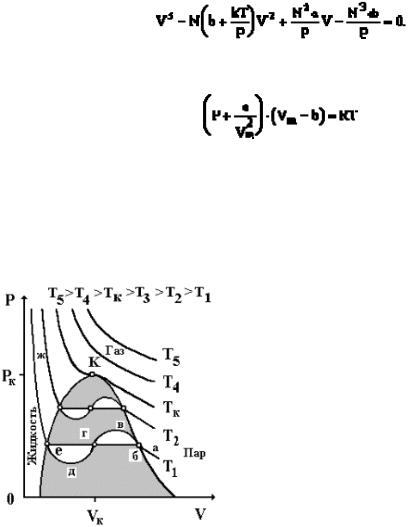
Таким образом, уравнение состояния реального газа запишем в виде:
(17.3)
113
или
(17.4)
Это и есть уравнение Ван-дер-Ваальса. Для одного моля реального газа это уравнение примет вид:
(17.5)
.
Исследуем теоретические изотермы реального газа, приведенные на диаграмме Р-V при различных значениях температуры (рис. 17.2).
Уравнение Ван-дер-Ваальса имеет три корня, из которых вещественными могут быть все три или один. Физический смысл имеют только положительные корни. На кривой (изотерма Т1) им соответствуют точки б, г, е,
рис. 17.2.
Для выяснения физического смысла различных участков теоретических изотерм реального газа рассмотрим одну из
них, например, изотерму Т1 (а-б-в-г-д-е- ж). На участках (а-б-в) и (д-е-ж) зависи-
мость давления от объема имеет нормальный вид. Участок изотермы (в-г-д) не может быть осуществлен, т.к. нет в природе таких состояний, когда при сжатии вещества его давление уменьшается.
Рис. 17.2
Наличие этого участка изотермы показывает, что при постепенном изменении объема вещество не может быть в виде однородной массы, так как при определенном давлении и температуре наступает распад вещества на две фазы. Действительно, эксперименты показали, что изотермы реальных газов (изотермы Эндрюса), в отличие от теоретических, имеют вид кривой (а-б-г-е- ж, рис. 17.2), где прямолинейный участок (б-г-е) соответствует двухфазному состоянию.
При повышении температуры прямолинейные участки изотерм сокращаются, и при некоторой температуре стягиваются в точку К, называемую критической (рис. 17.2). Существование критической точки было предсказано Д.И. Менделеевым.
В данной модели на примере паров воды рассмотрены изотермы реальных газов. Температуру, при которой происходит процесс, можно выбирать. Приведен график зависимости p(V), на котором имеется горизонтальный
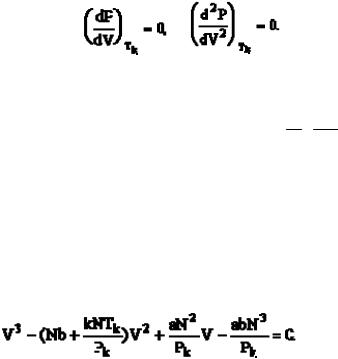
114
участок, соответствующий двухфазной системе. Выводится энергетическая диаграмма, на которой указываются подводимое количество теплоты Q, совершаемая работа A и изменение U внутренней энергии в процессе изотермического расширения (сжатия) паров воды.
Обратите внимание на существование критической температуры. При температуре выше критической исчезает физическое различие между жидкостью и ее паром, и система может находиться только в однофазном состоянии. Если соединить между собой последовательно правые и левые концы прямолинейных участков на семействе изотерм, то получим кривую фазового равновесия жидкости и газа (пара) на диаграмме Р-V. Максимум этой кривой и есть критическая точка К. В т. К изотермы Ван-дер-Ваальса имеют как максимум, так и точку перегиба, т.е.
Величина, обратная первой производной, характеризует сжимаемость вещества и в критической точке обращается в бесконечность.
1 dV
Действительно, коэффициент сжимаемости æ = . Таким обра- V dP T
зом, уравнение Ван-дер-Ваальса для реального газа не описывает существование двухфазных систем, но предсказывает существование критической точки.
Уравнение Ван-дер-Ваальса выполняется только в некотором диапазоне давлений и температур, а уравнения состояния реального газа нет до сих пор. В критической точке К все три корня уравнения равны Vk. Тогда формула принимает вид
|
(17.6) |
Это уравнение эквивалентно тождественному уравнению |
|
(V - Vk)3=V3 - 3V2Vk + 3VVk2 - Vk3=0. |
(17.7) |
Из сравнения коэффициентов при одинаковых степенях объема V в уравнениях (17.6) и (17.7) получим
abN3/Pk=Vk3; 3Vk2=aN2/Pk; bN+kNTk/Pk=3Vk. |
(17.8) |
Выразим и з последних равенств (5.12) Vk, Tk, Pk через постоянные a, b, k и N, т.е. Vk=3bN; Pk=a/(27b2); Tk=8a/(27kb).
Уравнение Ван-дер-Ваальса приводит к закону соответственных состояний: вид уравнения состояния, записанного в приведенных величинах, одинаков для всех веществ. Приведенными называют отношения типа:
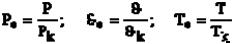 .
.
115
С учетом этого, введя удельный объем, уравнение (5.8) преобразуем к
виду:
или
(17.9)
.
В это уравнение уже не входят постоянные а и b, характеризующие свойства реальных газов.
Следовательно, уравнение (17.9) справедливо для всех газов, в том числе и для ядерного вещества, уравнение состояния которого записывают в виде
(17.10)
.
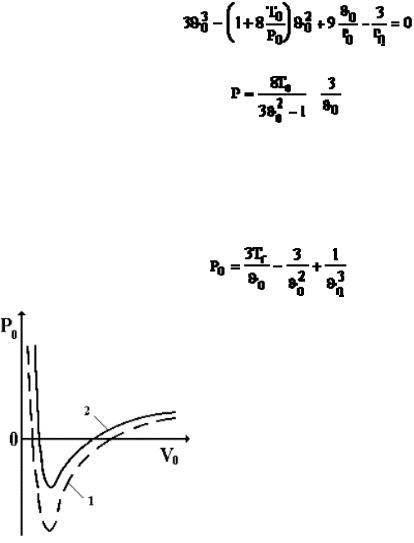
В определенной области давлений и температур ядерное вещество ведет себя подобно молекулам реального газа под действием ядерных сил. На рис. 17.3 приведены изотермы, описывающие уравнение Ван-дер-Ваальса (кривая 1, рис. 17.3) и уравнение состояния ядерного вещества (кривая 2, рис. 17.3), при Т0=0,5.
Несмотря на различную природу, силы взаимодействия между частицами обычного и ядерного вещества, в чем-то сходны. Это коротко действующие силы. Полученные результаты позволяют понять поведение ядерной материи в
Рис. 17.3 микро- и макрообъектах: при взрывах сверхновых звезд, в нейтронных и кварковых звездах, черных дырах и т.д.
4.17.2.Внутренняя энергия реального газа
Вотличие от идеального газа для нахождения внутренней энергии ре-
ального газа необходимо учитывать не только кинетическую энергию Wk всех молекул, но и потенциальную энергию Wр, вызванную силами межмолекулярного взаимодействия.
Согласно молекулярно-кинетической теории, учет сил отталкивания (с помощью поправки b в уравнении Ван-дер-Ваальса) соответствует модели
116
молекул газа в виде твердых шариков, имеющих собственный размер и занимающих часть объема сосуда.
Поэтому силам отталкивания, возникающим при столкновении молекул, не может соответствовать какая-либо потенциальная энергия.
Наличие сил притяжения между молекулами учитывается дополни-
тельным давлением P = Va2 , где а - постоянная, зависящая от свойств реаль-
ного газа.
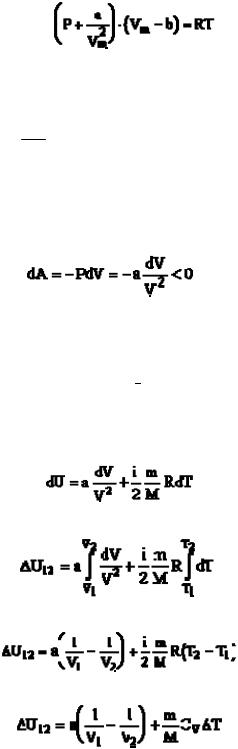
Из механики известно, что изменение потенциальной энергии молекул равно работе сил притяжения со знаком “-“.
При расширении газа работа сил притяжения между молекулами
(17.11)
(при dV>0, т.е. при расширении, работа сил притяжения отрицательна). Изменение же кинетической энергии всех молекул
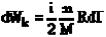 . (17.12)
. (17.12)
Следовательно, изменение внутренней энергии реального газа
dU = dWk + dWp
или
(17.13)
.
При переходе газа из состояния 1 в 2 изменение внутренней энергии
(17.14)
.
После интегрирования
(17.15)
или
(17.16)
.
Для одного моля реального газа формула внутренней энергии запишется в виде:
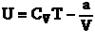 . (17.17)
. (17.17)
117
Формула (17.17) справедлива только для однофазного состояния веще-
ства.
4.17.3. Метастабильные состояния
Существование участков б-в и д-е (рис. 17.2) имеет физический смысл, так как они описывают метастабильные состояния.
Равновесное состояние вещества с ограниченной устойчивостью, называют метастабильным.
При незначительных отклонениях от этого состояния вещество переходит в другое устойчивое состояние и самопроизвольно не возвращается обратно. Следовательно, метастабильное состояние существует ограниченное время.
Переохлажденный (пересыщенный) пар (участок б-в, рис. 17.2). После достижение состояния (т. б, рис. 17.2) должна начаться конден-
сация пара в жидкость. Однако это может случиться только при наличии в паре инородных смачиваемых включений, на которых начинают конденсироваться частицы пара, т.е. возникают центры конденсации. Каждая частица включения провоцирует процесс бурного присоединения к себе частиц пара. В макроскопическом масштабе это вызывает скачкообразное превращение пара в жидкость. В абсолютно чистых газах это невозможно, так как в них конденсация не начинается и при более высоких давлениях (точки линии б- в), когда реальный газ вступает в область жидкой фазы. Такой газ называют переохлажденным. Но такое состояние газа является крайне неустойчивым. Появление в нем посторонних примесей сразу же вызывает его бурную конденсацию.
Перегретая жидкость (линия д-е, рис. 17.2). Механизм возникновения состояния перегретой жидкости наблюдается в абсолютно чистой жидкости, в которой нет зародышей газовой фазы. Однако зародыши всегда присутствуют в виде мельчайших пузырьков газа на стенках сосуда с жидкостью или на взвешенных в ней пылинках. Хотя метастабильные состояния короткоживущие, тем не менее они находят широкое применение. Например, переохлажденный газ (пар) используют в экспериментах по обнаружению следов (треков) элементарных частиц, возникающих в результате ядерных реакций (камера Вильсона, в которой используется гелий, аргон и другие газы, с добавлением воды в смеси со спиртом).
Для этих же целей используют свойства перегретой жидкости (пузырьковая камера, где в качестве рабочего вещества применяют жидкий водород, пропан и другие вещества).
118
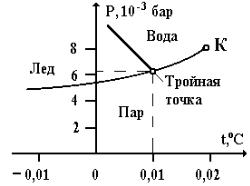
4.17.4.Тройные точки
Воднокомпонентном веществе кривая испарение-конденсация имеет конец в виде критической точки. Кривая "плавление-кристаллизация", а также кривые перехода между кристаллическими состояниями, различной структуры, могут либо уходить в бесконечность, либо заканчиваться тройной точкой.
Тройной, на диаграмме Р-Т, называют точку, в которой возможно равновесие трех фаз однокомпонентного вещества.
Из правила фаз Гиббса следует, что однокомпонентное вещество в равновесии не может иметь более трех фаз.
Правило фаз Гиббса: в веществе, состоящем из k компонентов, одновременно могут существовать не более k+2 равновесных фаз j, т.е. j=k+2.
Например, пар, вода и лед могут находиться в равновесии при давлении 6,09×10-3 бар при температуре t=+0,010 С (рис. 17.4).
Тройная точка равновесия трех фаз: газ, жидкость, твердое тело существует у всех веществ, за исключением гелия из-за особых квантовых свойств. Так как тройным точкам соответствует вполне определенная температура, то их используют в качестве стандартных (реперных) точек температурной шкалы.
Рис. 17.4
Из фазовой Р-Т диаграммы (рис. 17.4) видно, что вещество при нагревании не обязательно должно проходить стадию жидкого состояния для того, чтобы превратиться в газ. Нагреванием, при давлении ниже тройной точки, твердое тело непосредственно переходит в газ (сублимация, или возгонка). Кривая равновесия фаз "жидкость-газ" заканчивается критической точкой К. Для переходов между жидкими и твердыми фазами существование критической точки невозможно из-за анизотропии кристаллической структуры. Поэтому кривая плавления продолжается неограниченно. Кривые равновесия "твердое тело-газ" уходят в начало координат (0 К), т.е. при абсолютном нуле температуры вещество при любом давлении находится в твердой фазе (исключение составляет гелий, который переходит в твердое состояние при давлении 25 атм и Т= 0 К).
Фазовые диаграммы могут иметь несколько тройных точек, что связано с наличием нескольких модификаций вещества в твердом состоянии (полиморфизм).

119
На рис. 17.5. приведена фазовая диаграмма воды в координатах Р-Т. Буквами а, б, в, г, д обозначены различные модификации льда, а цифрами 1, 2, 3, 4, 5 - тройные точки. Область (а) соответствует обычному льду. Область пара не указана из-за малого масштаба рисунка.
Переходы между различными кристаллическими модификациями сопровождаются образованием метастабильных состояний. Но в отличие от газовых и жидких состояний, которые возникают в достаточно чистых системах, метастабильные кристаллические состояния часто встречаются и оказываются практически устойчивыми. Это объясняется особенностями кристаллических структур из-за малой подвижности частиц в кристаллах.
Рис. 17.5
4.17.5. Эффект Джоуля-Томсона
Рассмотрим процесс, при котором газ или жидкость медленно перетекает под действием постоянного перепада давления сквозь пористую перегородку при теплоизоляции с окружающей средой (адиабатическое дросселирование).
Вопытах Джоуля и Томсона измерялась температура в двух сечениях непрерывного и стационарного потока газа ( до и после пористой перегородки).
Врезультате трения газа при прохождении перегородки скорость газового потока была малой и кинетическая энергия практически не изменялась.
|
Газ, первоначально занимавший |
|
объем V1 при давлении Р1, перетекает |
|
сквозь перегородку, занимая объем V2 |
|
при давлении Р2 (рис. 17.6). |
|
Целью опытов Джоуля и Томсона |
Рис. 17.6 |
было обнаружение сил межмолекулярно- |
го взаимодействия газа. |
120
При прохождении газом перегородки происходит замедление теплового движения его молекул и температура понижается. Расширение газа в условиях адиабатического дросселирования не меняет его внутренней энергии, но вызывает увеличение потенциальной энергии взаимодействия молекул (расстояние между молекулами увеличивается) за счет кинетической энергии.
При этом над системой совершается работа
А = Р1V1 - P2V2. |
(17.18) |
В адиабатическом процессе эта работа идет на изменение его внутренней энергии (первое начало термодинамики, DQ=0), т.е.
U2 - U1 = Р1V1 - P2V2. |
(17.18) |
Следовательно, |
|
U1+Р1V1=U2+Р2V2=Н=сonst, |
(17.19) |
где Н - энтальпия.
Поэтому, зная уравнение состояния газа и выражение для энтальпии Н, можно найти DТ. Для идеального газа внутренняя энергия и энтальпия зависят только от температуры. Из формулы (17.19) следует равенство температур, т.е. для идеального газа DТ=0. Эффект Джоуля-Томсона считают положительным, если газ в процессе дросселирования охлаждается (DТ<0), и отрицательным, если газ нагревается (DТ>0). Например, при перепаде давления на дросселе, равном атмосферному, измеренная разность температур для воздуха DТ= - 0,250 С (опыт проводился при комнатной температуре).
Для водорода и углекислого газа в тех же условиях, разность температур составила, соответственно: TH2 = +0,02 °С; TCO2 = -1,25°С.
В зависимости от условий протекания сквозь перегородку один и тот же газ может как нагреваться, так и охлаждаться.
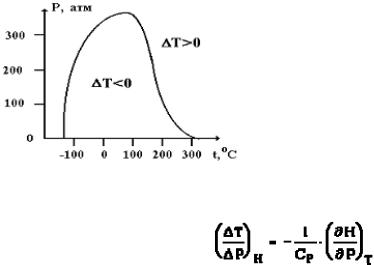
Температура Тi, при которой разность DТ, переходя через нулевое значение, меняет знак, называется температурой инверсии эффекта ДжоуляТомсона.
Совокупность точек температуры инверсии на диаграмме Р-Т называют кривой инверсии. Для точек на самой кривой эффект равен нулю. На рис. 17.7 приведена кривая инверсии азота.
Из условия постоянства энтальпии следует, что эффект Джоуля-Томсона характеризуется небольшими изменениями темпе-
Рис. 17.7 ратуры при малых перепадах давления. Поэтому дифференциальный эффект можно описать формулой
(17.20)
,
