
- •Основные понятия и постулаты сто
- •Основные понятия
- •Синхронизация времени
- •Линейность преобразований
- •[Править] Согласование единиц измерения
- •Изотропность пространства
- •Принцип относительности
- •Постулат постоянства скорости света
- •Непротиворечивость теории относительности
- •Геометрический подход
- •Различная запись преобразования Лоренца
- •Следствия преобразований Лоренца Сложение скоростей
- •Замедление времени
- •Относительность одновременности
- •Относительность одновременности
- •Изменение длины
- •Закон взаимосвязи массы и энергии
- •Средняя скорость
- •Среднеквадратичная скорость
Закон взаимосвязи массы и энергии
Полную энергию свободного тела можно определить как произведение его релятивистской массы на квадрат скорости света в вакууме:
![]()
Билет№20
четвертым постулатом явл-ся принцип постоянства скорости света и независимости скорости света от скорости движения источника. И, наконец, пятым постулатом явл-ся инвариантность интервала, состоящего из четырех составляющих - трех пространственных координат и времени, умноженного на все ту же скорость света: ds2 = dx2+dy2+dz2-c2dt2 = const.
Так же как
и в специальной теории относительности,
основным исходным понятием в ОТО —
общей теории относительности является
понятие четырехмерного интервала,
принятого за неизменную величину —
инвариант: ds2 =
dx2 +
dy2 +
dz1 -
c2dt2 ==
const

Билет№21
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этимтермодинамический метод отличается от статистического
(термодинамические параметры), физ. величины, характеризующие состояние термодинамич. системы: темп-pa, давление, уд. объём, намагниченность, электрич. поляризация и др. Различают э к с т е н с и в н ы е П. с., пропорц. массе системы, и и н т е н с и в н ы е П. с., не зависящие от массы системы.
РАВНОВЕСНОЕ СОСТОЯНИЕ- состояние, в к-рое приходит термодинамич. система при постоянных внеш. условиях. Р. с. характеризуется постоянством во времени термодинамич. параметров и отсутствием в системе потоков вещества и энергии
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнениеКлапейрона — Менделеева) — формула, устанавливающая зависимость между давлением,молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
Билет№22
Идеальный газ. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В модели идеального газа предполагается следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
Давление идеального газа. Качественное объяснение давления газа заключается в том, что молекулы идеального газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
Обозначив
среднее значение кинетической энергии
поступательного движения молекул
идеального газа ![]() :
:
![]() ,
,
получим
![]() .
(24.2)
.
(24.2)
Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
![]()
Из (8) вытекают три следствия:
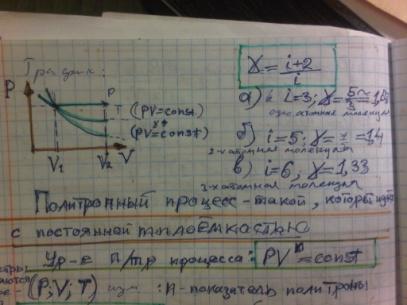
если Т = const (изотермический процесс), то pV = const. Это равенство выражает закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная;
если p = const (изобарный процесс), то V/T = const (закон Гей-Люссака);
если V = const (изохорный процесс), то p/T = const (закон Шарля).
Билет№23
Число степеней свободы = числу параметров, которые необходимо задать, чтобы полностью определить положение системы в пространстве. Для точки (одноатомный газ) 3. Для двухатомного газа 5. При этом предполагается, что две точки (атомы) соединены жестким стерженьком. Число степеней свободы 2х3-1 (из-за фиксированного расстояния). Для трех- и более атомных газов 6. Опять предполагается, что все точки (атомы) соединены жесткими стерженьками.


Билет№24
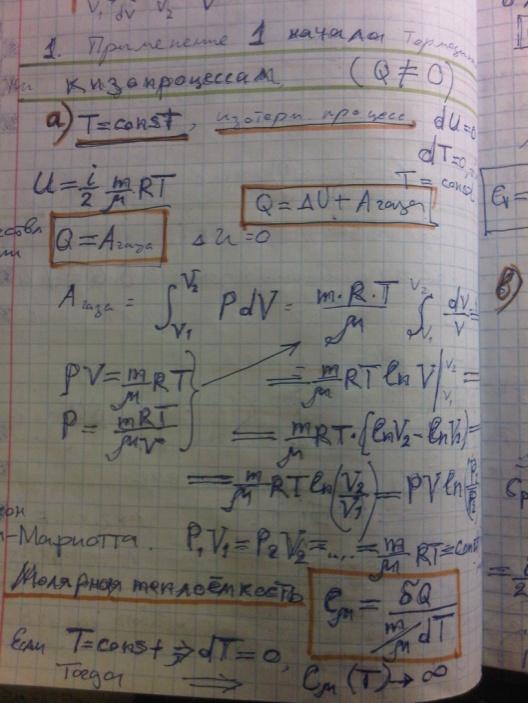
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход.
![]()
|
|
|

Билет№25


Билет №27
Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Круговой процесс (цикл) в термодинамике, процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние. Термодинамические параметры и характеристические функции состояния системы (температура Т, давление р, объём V, внутренняя энергия U, энтропия S и др.) в конце Круговой процесс вновь принимают первоначальное значение и, следовательно, их изменения при Круговой процесс равны нулю (DU = 0 и т. д.)
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной машины описывается циклом Карно.


Билет№28
Термодинамическая вероятность — число способов, которыми может быть реализовано состояние физической системы. Втермодинамике состояние физической системы характеризуется определёнными значениями плотности, давления, температуры и др. измеримых величин.
Вероятность термодинамическая (обозначается W) равна числу микросостояний, реализующих данное макросостояние, из чего следует, что W3 = 1 . Вероятность термодинамическая связана с одной из основных макроскопических характеристик системы энтропией S соотношением Больцмана:S = k * ln(W), где k — Больцмана постоянная.
энтропия S, является функцией состояния термодинамической системы.
![]() .
.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Статистическое толкование второго начала термодинамики придает энтропии конкретный физический смысл меры термодинамической вероятности состояния системы.
Билет№29
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dvи имеет смысл плотности вероятности.
Графическое
изображение функции показано на рисунке
2.2. Видно, что доля молекул со скоростью ![]() не
равна нулю. При
не
равна нулю. При![]() ,
,![]() (в
этом физический смысл постоянной А1).
(в
этом физический смысл постоянной А1).
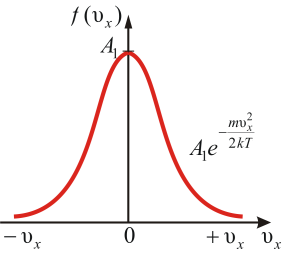 Рис.
2.2
Рис.
2.2
Влияние температуры и массы молекулы на вид функции распределения показано на рис. 6.

наиболее
вероятная скорость, ![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению ![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить ![]() ,
приравнять её нулю и решить относительно
,
приравнять её нулю и решить относительно ![]() :
:
![]()
![]()
