
- •Радиоматериалы и радиокомпоненты
- •Радиоматериалы и радиокомпоненты
- •Содержание
- •Введение
- •1. Свойства материалов
- •1. 1. Классификация материалов
- •1. 2. Виды химической связи в материалах
- •1. 3. Структура твердых тел. Дефекты структуры
- •1. 4. Элементы зонной теории твердого тела
- •2. Проводниковые материалы
- •2. 1. Электропроводность проводниковых материалов
- •2. 2 Сверхпроводимость проводниковых материалов
- •2. 3. Контактная разность потенциалов. Термоэлектродвижущая сила
- •2. 4 Контакты
- •2. 5. Классификация проводниковых материалов
- •3. Полупроводниковые материалы
- •3. 1. Особенности полупроводников
- •3. 2. Электропроводность полупроводников
- •3.2.1. Собственная проводимость (γi)
- •3.2.2. Примесная проводимость n - типа (γn)
- •3.2.3. Примесная проводимость р – типа (γр)
- •Донор – дающий, акцептор – принимающий
- •3.2.4. Воздействие теплового поля на электропроводность
- •3. 3. Термоэлектрические свойства
- •3.3.1. Терморезисторы
- •3.3.2. Термоэлементы
- •3. 4. Электронно-дырочный (или p-n) переход
- •3. 5. Фотоэлектрические свойства полупроводников
- •3.5.1. Фоторезистивный эффект
- •3.5.2. Фотоэлектрический эффект
- •3.6. Классификация полупроводниковых материалов
- •Полупроводниковые материалы
- •4. Магнитные материалы
- •4. 1. Природа ферромагнетизма
- •4. 2. Основные характеристики ферромагнетиков
- •4. 3. Потери в ферромагнитных материалах
- •4. 4. Энергия в зазоре ферромагнетика
- •4. 5. Классификация магнитных материалов
- •5. Диэлектрические материалы
- •5. 1. Поляризация диэлектриков
- •5. 1. 1. Виды поляризации
- •5. 1. 2. Влияние различных факторов на поляризуемость диэлектрика
- •5. 1. 3. Электретный эффект
- •5. 2. Электропроводность диэлектриков
- •3. Диэлектрические потери
- •5. 3. 1. Виды диэлектрических потерь
- •5. 3. 2. Схемы замещения диэлектриков и векторные диаграммы к ним
- •5. 3. 3. Зависимость tgδ и Ра от внешних факторов
- •5. 4. Пробой диэлектриков
- •5. 4. 3. Виды пробоя
- •5. 4. 2. Ионизационный пробой
- •5. 4. 3. Электрический пробой (электронный)
- •5. 4. 4. Электрохимический пробой
- •5. 4. 5. Электротепловой пробой твердых диэлектриков (тепловой пробой)
- •5. 5 Классификация диэлектрических материалов
- •Электроизоляционные материалы
- •Библиографический список
1. 2. Виды химической связи в материалах
При сближении атомов до расстояния нескольких долей нанометра (1нм = 10-9 м), между ними появляются силы взаимодействия. Если эти силы являются силами притяжения, то атомы могут соединяться с выделением энергии, образуя химические соединения. При этом электроны внутренних и внешних оболочек атомов ведут себя по-разному. Электроны внутренних, полностью заполненных оболочек прочно связаны с ядром и не участвуют в образовании химических связей. Строение внешней, не полностью заполненной электронами оболочки определяет химические свойства атомов в образовавшемся соединении.
Электроны, находящиеся на внешних оболочках, являются валентными. Валентность атома определяется числом этих электронов. Все многообразие существующих в природе материалов характеризуется несколькими видами химической связи.
Ковалентная (гомеополярная) связь. При наличии такой связи объединение атомов в молекулу достигается за счет электронов, которые становятся общими для пар атомов (рис. 1.1). Плотность отрицательно заряженного электронного облака между положительно заряженными ионами получается наибольшей. Появление состояния с повышенной плотностью электронного заряда в межионном пространстве приводит к возникновению сил притяжения между атомами.

Рис. 1. 1. Условное изображение ковалентной связи
Ковалентная связь характерна как для органических, так и для неорганических соединений. К неорганическим веществам с ковалентной связью относятся алмаз, кремний, германий, арсенид галлия (GaAs), карбид кремния (SiС) и другие, являющиеся полупроводниками. Многие полупроводники кристаллизируются в структуре алмаза, в которой каждый атом образует четыре связи со своими ближайшими соседями. Ковалентная связь в неорганических материалах характеризуется высокой прочностью. Подтверждением этому является высокая твердость и температура плавления алмаза, кремния и др.
Ионная (гетерополярная) связь. Наблюдается в химических соединениях атомов металла с металлоидными атомами (типа NaCl). Ионная связь возникает вследствие перехода валентных электронов от металлоидного атома к металлоидному и возникновения электростатического притяжения разноименно заряженных атомов друг другу. На рис. 1.2 схематически представлена трехмерная решетка гипотетического ионного кристалла, где атомы металла изображены в виде точек (положительно заряженные ионы - катионы), а атомы металлоида – в виде кружочков (отрицательные ионы – анионы). В решетке ионнго кристалла чередуются ионы различного сорта. Способность атома захватывать электрон при образовании ионной химической связи называется электроотрицательностью. Чем больше разность электроотрицательностей атомов, участвующих в образовании химической связи, тем больше степень ионности соединения.
Металлическая связь. Существует в системах, построенных из положительных атомных островов, находящихся в среде свободных коллективизированных электронов (на рис. 1.3). Притяжение между положительными ионами и электронми обуславливает существование металлов как химичсеких соединений. Металлическую связь можно рассматривать до некоторой степени как ковалентную связь, поскольку в ее основе лежит обобществление внешних валентных электронов. Специфика металлической связи состоит в том, что обобществленные электроны свободно перемещаются внутри всей решетки, образуя «электронный газ». Поэтому металлическим материалам свойственны пластичность, высокая электро- и теплопроводность.
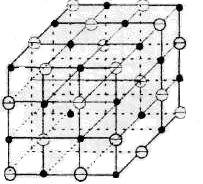

Рис. 1. 2. Расположение ионов Рис. 1. 3. Схематическое
в кристаллической решетке изображение возникновения
при наличиии ионной связи металлической связи
Молекулярная связь (связь Ван-дер-Ваальса). Этот вид химичечкой связи наблюдается у ряда веществ (парафин, жидкие кристаллы) между молекулами с ковалентным характером внутримолекулярного взаимодействия. Вещества с молекулярной связью характеризуются сравнительно низкой температурой плавления и невысокой мехиничской прочностью.
