
Лекция №2
Протеины – в переводе с греческого важнейший, первейший. Слово белки произошло от того, что эти соединения обладают такими же свойствами как яичный белок. Белки – азотсодержащие ВМС, которые находятся в клетках в коллоидном состоянии. Это состояние крайне неустойчиво.
Энгельс: белок – самое неустойчивое из известных нам соединений углерода, он распадается как только теряет способность выполнять свои функции. В его природе эта неспособность выполнять функции рано или поздно наступает
Процентный состав белков:
50,5 -54,5% углерод,
21,5 – 23,5% кислород,
6,5% - 7,3% водорода,
15-17,5% азота,
0,3 – 2,5% сера.
Белки имеют молекулы с большой молекулярной массой, причём длина цепи у белковой молекулы различна. Например, цитохром Ц имеет длину 104 звена, а химотрепсин быка 245 звена. В полипептидных белках может содержаться от 100 до 1800 звена. Определённый белок имеет одно и то же количество аминокислот. Можно сказать, что белки – это биополимеры, но они моно-дисперсные, в отличие от синтетических полимеров, которые поли-дисперсные (полимолекулярные). Это задано условиями биосинтеза, т.к. информация о каждом белке (какие, сколько, в какой последовательности) заложена в генах, в молекуле ДНК.
Молекулярная масса белков будет зависеть от того, сколько полипептидных цепей он содержит. Если несколько полипептидных цепей – олигомерные белки (гемоглобин). Белок глобин состоит из 4-х субъединиц, которые имеют свою собственную структурную организацию. Молекулярная масса разных белков (олигомерных) может варьировать от 12000 до 1000000. Молекулярные массы больших молекул измеряются в дальтонах (Да) или кДа.
Дальтон – это единица массы практически равная массе атома водорода, т.е. 1 по шкале атомных масс. Термином Да или кДа пользуются вместо термина молекулярная масса, это взаимозаменяемые понятия.
Методы выделения и очистки белков
Методы выделения и очистки касаются не только белков, но это ещё и универсальные методы, которые используются в биохимии. Клетки содержат большое количество разных белков. Прежде, чем исследовать индивидуальный белок, необходимо получить (вытащить) его из общей массы.
Методы:
Необходимо измельчить биоматериал.
Из этой гомогенной массы извлечь все белки.
Затем разделить эти белки на определённые фракции или отдельные белки.
Обычные методы органической химии не подойдут. Используя обычные методы можно прийти к тому, что белок теряет природные (нативыные свойства).
Методы гомогенезации: используют различные гомогенезеторы(ножевые, пестиковые, шаровые мельницы). Успешно используют метод попеременного замораживания и размораживания тканей, при этом происходит разрыв оболочек кристалликами льда. Иногда используют метод замораживания с применением пресса. Для извлечения белков из микробной ткани используют метод азотной бомбы, т.е. микробные клетки насыщают азотом под давлением, затем резко сбрасывают давление и выделившийся газ взрывает клетки.
После гомогенизации начинают экстракцию белков.
Проводят диализ – отделение ВМС от НМС. Проводят в мешочках из полупроницаемой плёнки (с микропорами), через которую могут проходить НМС. Помещают гомогенезированный материал в диализный мешок и помещают в дестиилированную воду. Это до тех пор, пока качественная реакция не будет давать продукты.
После гомогенизации начинают экстракцию белков от других больших молекул. Для этого надо перевести белки в растворенное состояние, экстрагировать белки разными растворами (водные растворы, солевые растворы, растворы глюкозы). Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг каждой молекулы белка водных гидратных оболочек. По своим физическим и химическим свойствам вода гидратных оболочек отличается от воды-растворителя.
Нитевидные белки – плохо растворимы в воде, глобулярные – растворяются в воде.
Если в такой коллоидный раствор прилить водоотнимающее средство, то разрушается гидратная оболочка, белки начинают слипаться, происходит осаждение белков в осадок. Этот метод используется для выделения того или иного белка, называется высаливание, для него используют любые водоотнимающие средства (спирт, соли щелочных металлов). После удаления высаливающего раствора белок может перейти в растворимое состояние, не теряя своих нативных свойств. Этот метод используется в медицине – метод Кона: при перегонке крови, при низких температурах –3 -5 градусов белки плазмы кровы разделяют по фракциям, применяя различные концентрации этанола.
Самый распространенный и универсальный метод разделения – метод хроматографии, принцип разработан русским химиком Цветом.
Существует 4 основных типа:
адсобрбционная;
распределительная;
ионообменная;
хроматография по сродству (аффинная хроматография).
При адсорбционной хроматографии разделение компонентов смеси основано на их различной полярности, в качестве адсорбента используют активированный уголь, Al2O3, Si2O3. Адсорбент в виде суспензии помещают в колонку. Образец в небольшом количестве растворителя тоже помещается в колонку. Белки адсорбируются в определенном слое адсорбента. Для разделения белков производят элюирование, элюент – полярный растворитель, буферные растворы, которые будут по-разному действовать на разные белки.
Ч астным
случаем такой адсорбционной хроматографии
является тонкослойная хроматография.
астным
случаем такой адсорбционной хроматографии
является тонкослойная хроматография.
Распределительная хроматография наиболее часто используется в биохимии. Твердая фаза адсорбент служит только основой для стационарной жидкой фазы (крахмал – твердая фаза, вода – жидкая). Образец растворяют в органическом растворителе и пропускают через колонку. Различные белки, имея различное сродство к воде и органическим растворителям, растворяются в колонке и передвигаются ко дну колонки с разной скоростью.
Ионообменная хроматография.
Здесь используют
ионообменные смолы – катиониты (катионный
обмен) и аниониты (анионный обмен).
Полистиролсульфокислоты или их соли.

Белки, которые имеют положительный заряд, они будут способны к катионному обмену, а другие белки, которые не имеют заряда, они будут свободно проходить через эту колонку. Анионный обмен – наоборот. Солевыми насыщенными растворами проводят снятие белков с адсорбента.
Аффинная хроматография основана на принципе избирательного взаимодействия белка со специфическими веществами, называемыми лигандами, которые закреплены на носителе. Например, смесь белков содержит амиллазу, при прохождении через крахмальную прослойку, амилаза будет адсорбироваться на крахмале, а другие белки будут проходить мимо.
В последнее время широкое применение получила гель-фильтрация или метод молекулярных сит. С помощью этого метода можно рассортировать белки по их размерам, по величине. Для этого смесь белков пропускают через колонку, заполненную очень мелкими пористыми гранулами высокогидратированного полимера (дексатраны – полисахариды бактерии, состоят из молекул глюкозы, полимерная цепочка которых имеет очень разветвлённое строение). (связи 1-4, 1-6). Маленькие молекулы будут проходить через поры, а большие нет, т.о. происходит разделение белков по молекулярной массе. Этот метод в настоящее время очень широко используется в фармакологии, биохимических производствах.
Электрофорез.
О пределяющую
роль в этом методе играют знак и величина
электрического заряда на данной белковой
молекуле.
пределяющую
роль в этом методе играют знак и величина
электрического заряда на данной белковой
молекуле.
Б


 еретсяU-образная
трубка и электроды. В трубку помещается
раствор компонентов белков. В зависимости
от величины заряда разные белки с разной
скоростью будут подходить к электродам.
С помощью особого оптического устройства
результаты электрофореза могут быть
записаны графически – электрофореграмма
(1 пик – 1 белок, 2 пика – 2 белка).
еретсяU-образная
трубка и электроды. В трубку помещается
раствор компонентов белков. В зависимости
от величины заряда разные белки с разной
скоростью будут подходить к электродам.
С помощью особого оптического устройства
результаты электрофореза могут быть
записаны графически – электрофореграмма
(1 пик – 1 белок, 2 пика – 2 белка).
Для того, чтобы разделить белки на отдельные компоненты используют зональный электрофорез, который производится не в растворе, а в удлиненной колонке или кювете, заполненные гелем, пропитанным исследуемым раствором. Проводят разделение белков в зависимости от их заряда. С помощью элюирующего раствора их вымывают в коллектор отбора фракции.
Очень часто для того, чтобы определить какую-то аномалию белка используют метод отпечатков пальцев (филгерприн).
Н а
хроматографической бумаге проводят по
вертикали хроматографию и разделяют,
а горизонтально проводят электрофорез.
После проведения электрофореза каждое
пятно будет на своём месте.
а
хроматографической бумаге проводят по
вертикали хроматографию и разделяют,
а горизонтально проводят электрофорез.
После проведения электрофореза каждое
пятно будет на своём месте.
Чтобы узнать, какие аминокислоты содержаться в белке, надо провести гидролиз (щелочной, кислотный, ферментативный). Далее анализируют: какие и сколько.
Аминокислоты, которые входят в состав белка
Основных аминокислот всего 20. Их названия связаны со случайными моментами. Все аминокислоты, которые входят в состав природных белков – это α -аминокислоты. Это значит, что амино- и карбоксильная группа находятся у одного углеродного атома.
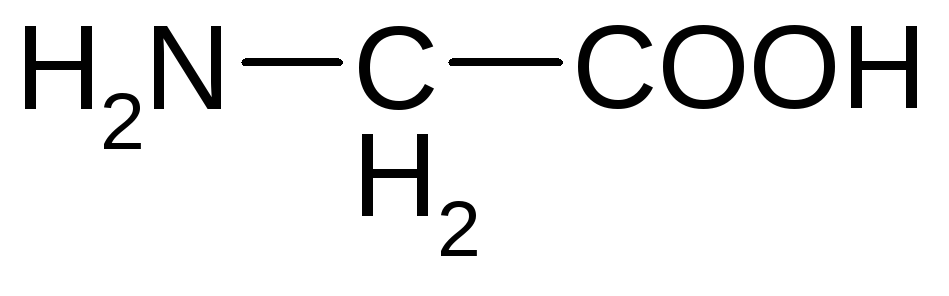 аминоуксусная
кислота (глицин);
аминоуксусная
кислота (глицин);
 α-аминопропанова
кислота (аланин);
α-аминопропанова
кислота (аланин);
 α-
аминопентановая кислота (валин);
α-
аминопентановая кислота (валин);
 α-аминоизокапроновая
кислота (лейцин);
α-аминоизокапроновая
кислота (лейцин);
 α-амино-β-метилвалериановая
кислота (изолейцин);
α-амино-β-метилвалериановая
кислота (изолейцин);
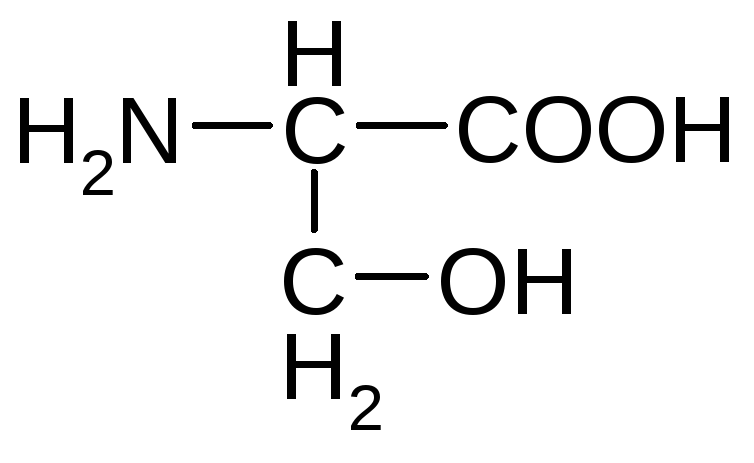 α-амино-β-гидроксипропановая
кислота (серин);
α-амино-β-гидроксипропановая
кислота (серин);
 α-амино-β-гидроксимасляная
кислота (треонин);
α-амино-β-гидроксимасляная
кислота (треонин);
Сера-содержащие:
 α-амино-β-меркаптопропановая
кислота (цистеин);
α-амино-β-меркаптопропановая
кислота (цистеин); α-амино-γ-метилтиомасляная
кислота (метионин);
α-амино-γ-метилтиомасляная
кислота (метионин);
 α-аминоянтарная
кислота (аспарагиновая кислота);
α-аминоянтарная
кислота (аспарагиновая кислота);
 амид
аспарагиновой кислоты (аспарагин);
амид
аспарагиновой кислоты (аспарагин);
 α-аминоглутаровая
кислота (глутаминовая кислота);
α-аминоглутаровая
кислота (глутаминовая кислота);
 амид
α-аминоглутаровой кислоты (гутамин);
амид
α-аминоглутаровой кислоты (гутамин);
 α,
ε-диаминокапроновая кислота (лейзин);
α,
ε-диаминокапроновая кислота (лейзин);
 α-амино-δ-гуанидиловалериановая
кислота
α-амино-δ-гуанидиловалериановая
кислота
(аргинин);
Циклические:
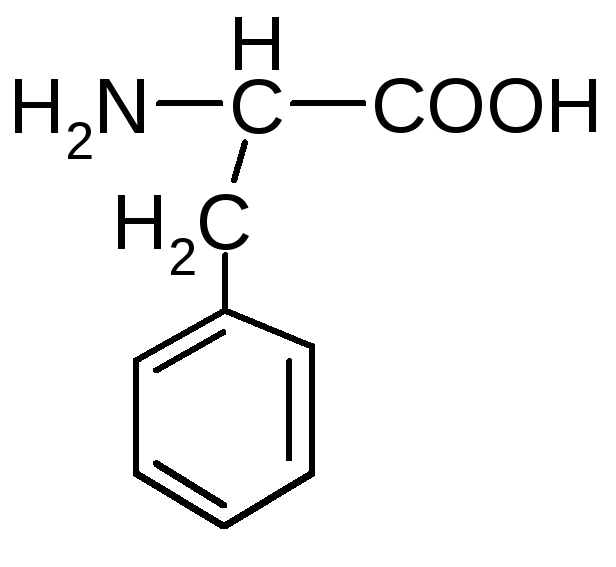 α-амино-β-фенилпропановая
кислота (фенилаланин);
α-амино-β-фенилпропановая
кислота (фенилаланин);
 α-амино-β-пара-гидроксифенилпроавновая
кислота (тирозин);
α-амино-β-пара-гидроксифенилпроавновая
кислота (тирозин);
 α-амино-β-имидозолилпропановая
ксилота (гистедин);
α-амино-β-имидозолилпропановая
ксилота (гистедин);
 α-амино-β-индолилпропановая
ксилота (триптофан);
α-амино-β-индолилпропановая
ксилота (триптофан);  α-тетрагидропироллкарбоновая
кислота (пролин).
α-тетрагидропироллкарбоновая
кислота (пролин).
Все природные аминокислоты относятся к L-стереохимическому ряду, D-рядя только как исключение у бактерий, в составе капсул, чтобы защитить бактерии от действия ферментов.

Лекция 3.
Для каждой аминокислоты характерны свои единственные физико-химические свойства – изоэлектрическая точка, т.е. та pH среды, при которой раствор этой аминокислоты электронейтрален. (q = 0).
Е сли
же рассматривать такую кислоту в водной
среде, то диссоциация происходит и по
кислотному и по основному типу –
биполярный ион.
сли
же рассматривать такую кислоту в водной
среде, то диссоциация происходит и по
кислотному и по основному типу –
биполярный ион.

В организме млекопитающих в печени имеется фермент оксидаза-D-аминокислот, который избирательно разрушает D-аминокислоты, которые попадают с продуктами питания. D-аминокислоты обнаружены в составе некоторых пептидов микроорганизмов. Кроме того, D-аминокислоты входят в состав большого числа антибиотиков. Например, D-валин, D-лейцин входят в состав антибиотика границидина, D-фенилаланин входит в состав границидина-С, пенициллин содержит необычный фрагмент D-диметилцистеин.
Процесс рацимизиации (переход D в L) происходит не ферментативно, поэтому очень медленно. На этом основано определение возраста млекопитающих.
 Все
аминокислоты имеют в своем составе
амино- и карбоксильную группу обладают
свойствами аминов и карбоновых кислот.
Кроме того, для α-аминокислот характернанингидриновая
реакция
(общая с белками). Со спиртовым раствором
нингидрина очень быстро появляется
сине-фиолетовая окраска, с пропином
желтая.
Все
аминокислоты имеют в своем составе
амино- и карбоксильную группу обладают
свойствами аминов и карбоновых кислот.
Кроме того, для α-аминокислот характернанингидриновая
реакция
(общая с белками). Со спиртовым раствором
нингидрина очень быстро появляется
сине-фиолетовая окраска, с пропином
желтая.

В конце XIX века была полемика, каким образом аминокислоты образуют связь если взять две аминокислоты, слить их вместе, то не получится никогда линейной структуры (в силу термодинамики, происходит циклизация). Получить полипептид в XIX веке никак не получалось.

Линейные молекулы никак не получатся. С т.з.термодинамики более выгодно отщепить 2Н2О, чем образовать линейную молекулу.
 В
1888 году химик Данилевский предположил,
что белки – это полипептиды, линейные
молекулы, которые образуются в результате
действия карбоксильной группы одной
аминокислоты с карбоксильной группой
другой аминокислоты с отщеплением воды
и образуется дипептид:
В
1888 году химик Данилевский предположил,
что белки – это полипептиды, линейные
молекулы, которые образуются в результате
действия карбоксильной группы одной
аминокислоты с карбоксильной группой
другой аминокислоты с отщеплением воды
и образуется дипептид:
О бразуется
амидная связь (для белков пептидная),
эти пептидные связи разделены только
одним углеродным атомом. На основаниибиуретовой
реакции
Данилевский сделал такой вывод. Это
реакция раствора белка с сульфатом меди
в щелочной среде, образуется сине-фиолетовое
окрашивание, образуется хилатный
комплекс с ионами меди, в результате
того, что пептидная связь в белковых
молекулах имеет специфическое строение.
Вследствие кето-енольной таутомерии
она на половину двойная, на половину
одинарная. Характерная реакция с Cu(OH)2:
бразуется
амидная связь (для белков пептидная),
эти пептидные связи разделены только
одним углеродным атомом. На основаниибиуретовой
реакции
Данилевский сделал такой вывод. Это
реакция раствора белка с сульфатом меди
в щелочной среде, образуется сине-фиолетовое
окрашивание, образуется хилатный
комплекс с ионами меди, в результате
того, что пептидная связь в белковых
молекулах имеет специфическое строение.
Вследствие кето-енольной таутомерии
она на половину двойная, на половину
одинарная. Характерная реакция с Cu(OH)2:
Б![]()
![]() иуретовая
реакция характерна для биурета (рис.1),
для малонамида (рис.2) , белков.
иуретовая
реакция характерна для биурета (рис.1),
для малонамида (рис.2) , белков.
Для того, чтобы окончательно доказать, что бели – это полипептиды в 1901 году Фишер синтезировал полипептид, независимо от него Гофман тоже синтезировал полипептид:
Синтез полипептида по Фишеру:

Продукт давал биуретовую реакцию, плохо растворялся, не обладал биологической активностью, расщеплялся протолитическими ферментами, а ферменты – это специфические биокатализаторы, которые расщеплют природные белки, значит у этого продукта такая же структура, как у природных белков.
В настоящее время синтезировано более 2 тысяч разных белков. Главное в синтезе белка – это защита аминогруппы и активация карбоксильной группы для того, чтобы синтез был направленным. Защита аминогрупп осуществляется ацилированием, для этого обрабатывают ангидридами трихлоруксусной кислоты и вводят трифторацильную группы, либо обрабатывают по Зенерсу (бензиловым эфиром хлоругольной кислоты).
Для синтеза каждого конкретного полипептида, для сшивания конкретного участка могут быть проведены свои собственные методы.
Защита по Зервесу, активация по Курциусу, снятие защиты по Бекману:


Твердофазный синтез полипептидов и белков, специфической особенностью полипептидного синтеза является огромное число однотипных операций. Был разработан метод Робертом Мерифилодм. Мономеры – это аминокислоты, которые используются для синтеза, содержащие защищенную аминогруппу и активированные карбоксильные группы – синтоны. Мерифилд предложил: первый мономер закрепить на полимерной смоле (нерастворимый носитель) и все последующие операции проводятся с полипептидом, растущем на полимерной основе, к смоле добавляют попеременно очередной синтон и реагент для удаления концевой защитной группы. Химические стадии перемежаются соответствующими промывками. В течение всего процесса полипептид остается связанным со смолой. Этот процесс легко можно автоматизировать, запрограммировав смену потоков через колонку. В настоящее время разработаны приборы синтезаторы. На завершающей стадии синтеза полипептид ковалентной связан со смолой, снимается с этой смолы и защитная группа удаляется. Одной из самых главных проблем в твердофазном синтезе является рацимизация аминокислот во время синтеза. Это особенно опасно в этом синтезе, т.к. промежуточных стадии выделения рациматов не существует. Способов отделения в данный момент не существует, но есть условия, чтобы как можно меньше была рацимизация. Сам Мерифилд получил этим методом сразу несколько полипептидов, был получен брадикидин – гормон с сосудорасширяющим действием, ангиотензин – гормон, повышающий кровяное давление, фермент рибонуклеаза, которая катализирует гидролиз РНК.
Выход продуктов этим методом значительно не сравним с методами, которые применялись до этого. С помощью автоматизации можно использовать этот метод в промышленных масштабах.
У каждого полипептида имеется N-конец, а другой С-конец. Аминокислота, которая принимает участие изменяет окончание на ил

Глицил-валил-тирозил-гистедин-аспарагил-пролин. Для определения аминокислот в полипептиде, необходимо провести гидролиз, его проводят при 100 С в течение 24 часов 6Н соляной кислотой. Далее продукты гидролиза анализируют – разделяют методом ионообменной хроматографии на колонке сульфалированным полистиролом. Потом вымывают цитратным буфером из колонки. По количеству элюента судят о том, какие кислоты, т.е. в начале будут вымываться кислые кислоты, а самыми последними – основные. Таким образом можно определять в какой момент, какая аминокислота прошла, а количество определяется фотометрически с помощью нингдрина, этим методом можно определить 1 мкг. Если необходимо оперделить 1 нг, применяют флуоросканин, он реагирует с α-аминокислотами, образуя сильно флуоросцилирующее соединение. Определяют какие и сколько аминокислот находятся, а последовательность аминокислот определить не удается.
Флюоросланин:

