
- •3. Равномерное и равнопеременное движения. Координатное и графическое представления.
- •4. Криволинейное движение. Нормальное и тангенциальное ускорение.
- •5. Движение точки по окружности. Угловые перемещение, скорость, ускорение. Связь между линейными и угловыми характеристиками.
- •6. Динамика материальной точки. Сила и движение. Инерциальные системы отсчета и первый закон Ньютона.
- •7. Фундаментальные взаимодействия. Силы различной природы (упругие, гравитационные, трения), второй закон Ньютона. Третий закон Ньютона.
- •8. Закон всемирного тяготения. Сила тяжести и вес тела.
- •9. Силы сухого и вязкого трения. Движение по наклонной плоскости.
- •11. Импульс системы материальных точек. Уравнение движения центра масс. Импульс и его связь с силой. Столкновения и импульс силы. Закон сохранения импульса.
- •14. Потенциальные и непотенциальные поля. Консервативные и диссипативные силы. Потенциальная энергия.
- •15. Закон всемирного тяготения. Поле тяготения, его напряженность и потенциальная энергия гравитационного взаимодействия.
- •16. Работа по перемещению тела в поле тяготения.
- •17. Механическая энергия и её сохранение.
- •18. Соударение тел. Абсолютно упругий и неупругий удары.
- •19. Динамика вращательного движения. Момент силы и момент инерции. Основной закон механики вращательного движения абсолютно твердого тела.
- •20. Вычисление момента инерции. Примеры. Теорема Штейнера.
- •21. Момент импульса и его сохранение. Гироскопические явления.
- •22. Кинетическая энергия вращающегося твердого тела.
- •24. Математический маятник.
- •26. Энергия колебательного движения.
- •27. Векторная диаграмма. Сложение параллельных колебаний одинаковой частоты.
- •28. Биения
- •29. Сложение взаимно перпендикулярных колебаний. Фигуры Лиссажу.
- •30. Статистическая физика (мкт) и термодинамика. Состояние термодинамической системы. Равновесное, неравновесное состояния. Термодинамические параметры. Процесс. Основные положения мкт.
- •31. Температура в термодинамике. Термометры. Температурные шкалы. Идеальный газ. Уравнение состояния идеального газа.
- •32. Давление газа на стенку сосуда. Закон идеального газа в мкт.
- •33. Температура в мкт(31 вопрос). Средняя энергия молекул. Среднеквадратичная скорость молекул.
- •34. Число степеней свободы механической системы. Число степеней свободы молекул. Закон равнораспределения энергии по степеням свободы молекулы.
- •35. Работа, совершаемая газом при изменениях его объема. Графическое представление работы. Работа в изотермическом процессе.
- •37.Первое начало тд. Применение первого начала к различным изопроцессам.
- •38. Теплоемкость идеального газа. Уравнение Майера.
- •39. Уравнение адиабаты идеального газа.
- •40. Политропические процессы.
- •41. Второе начало тд. Тепловые двигатели и холодильники. Формулировка Клаузиуса.
- •42. Двигатель Карно. Кпд двигателя Карно. Теорема Карно.
- •43. Энтропия.
- •44. Энтропия и второе начало тд.
- •46. Распределение молекул газа по скоростям. Распределение Максвелла.
- •48. Свободные затухающие колебания. Характеристики затухания: коэффициент затухания, время, релаксация, декремент затухания, добротность колебательной системы.
- •49. Электрический заряд. Закон Кулона. Электростатическое поле (эсп). Напряженность эсп. Принцип суперпозиции. Силовые линии эсп.
- •50.Работа по перемещению заряда в эсп. Потенциальная энергия и заряд эсп. Принцип суперпозиции. Теорема о циркуляции для эсп.
- •51. Поток вектора напряженности эсп. Теорема Гаусса. Применение теоремы Гаусса к расчету эсп. Бесконечной равномерно заряженной плоскости.
46. Распределение молекул газа по скоростям. Распределение Максвелла.
Скорости молекул
газа имеют различные значения и
направления, причем из-за огромного
числа соударений, которые ежесекундно
испытывает молекула, скорость ее
постоянно изменяеться. Поэтому нельзя
определить число молекул, которые
обладают точно заданной скоростью v в
данный момент времени, но можно подсчитать
число молекул, скорости которых имеют
значение, лежащие между некоторыми
скоростями v1
и v2
. На основании теории вероятности
Максвелл установил закономерность, по
которой можно определить число молекул
газа, скорости которых при данной
температуре заключены в некотором
интервале скоростей. Согласно распределению
Максвелла, вероятное число молекул в
единице объема; компоненты скоростей
которых лежат в интервале от
![]() до
до![]() ,
от
,
от![]() до
до![]() и
от
и
от![]() до
до![]() ,
определяются функцией распределения
Максвелла
,
определяются функцией распределения
Максвелла
![]()
где m - масса молекулы,
n - число молекул в единице объема. Отсюда
следует, чтсг число молекул, абсолютные
значения скоростей которых лежат в
интервале от v до v + dv, имеет вид![]()

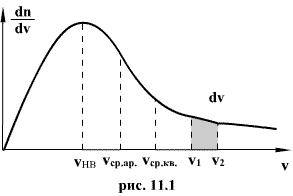 Распределение
Максвелла достигает максимума при
скорости
Распределение
Максвелла достигает максимума при
скорости
![]()
 ,
т.е. такой скорсти, к которой близки
скорости большинства молекул. Площадь
заштрихованной полоски с основанием
dV покажет, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения Максвелла зависит от
рода газа (массы молекулы) и температуры.
Давление и объем газа на распределение
молекул по скоростям не влияет.
,
т.е. такой скорсти, к которой близки
скорости большинства молекул. Площадь
заштрихованной полоски с основанием
dV покажет, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения Максвелла зависит от
рода газа (массы молекулы) и температуры.
Давление и объем газа на распределение
молекул по скоростям не влияет.
Кривая распределения Максвелла позволит найти среднюю арифметическую скорость
 .
.![]() Таким
образом,
Таким
образом,
|
|
С Повышением температуры наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей, а его абсолютная величина уменьшается. Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями уменьшается, а доля молекул с большими скоростями увеличивается.
47. Барометрическая формула. Распределение Больцмана.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуруT и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного паденияg одинаково), барометрическая формула имеет следующий вид:

![]()
где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная массагаза,R — газовая постоянная,T — абсолютная температура. Из барометрической формулы следует, что концентрация молекулn (или плотность газа) убывает с высотой по тому же закону:
![]()

где m — масса молекулы газа, k — постоянная Больцмана.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с закономраспределения Больцмана:
n = n0exp( -mgh / kT )
где n - концентрация молекул на высоте h, n0 - концентрация молекул на начальном уровне h = 0, m - масса частиц, g - ускорение свободного падения, k - постоянная Больцмана, T - температура.
Мы можем видеть, что концентрация молекул у дна сосуда оказывается выше, чем концентрация в верхней части сосуда. Под действием теплового движения молекулы подбрасываются вверх, а затем падают вниз за счет действия сил тяжести.
Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно пренебречь. С другой стороны, в атмосфере концентрация молекул быстро уменьшается с увеличением высоты и, поэтому, величина атмосферного давления также уменьшается. Принимая во внимание, что P = nkT, мы можем записать так называемую барометрическую формулу, описывающую изменение атмосферного давления в зависимости от высоты:
P = P0exp( -mgh / kT )
Измеряя давление за бортом самолёта, мы можем вычислить при помощи барометрической формулы приблизительную высоту полёта.

