
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
Скорость отдельной стадии процесса(реакция, массоперенос)определяется его параметром(константой скорости, коэффициентом массообмена) и движущей силой( концентрацией – для реакции, разностью концентраций -для массопереноса.)
Параметр процесса является характеристикой интенсивности его стадий.
Если
k<<β
– реакция малоинтенсивна и в уравнении
(6) Cn=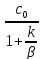 получаем
cn≈c0
, - то есть реакция будет протекать при
максимально возможной в этих условиях
концентрации ( у реакции максимально
движущая сила).
получаем
cn≈c0
, - то есть реакция будет протекать при
максимально возможной в этих условиях
концентрации ( у реакции максимально
движущая сила).
Из
уравнений (8) КH=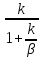 и (9)WH=
- KH
C0
получим,
что наблюдаемая скорость превращения
равна скорости реакции WH=
- k
c0
и не зависит от параметра массопереноса
β.
и (9)WH=
- KH
C0
получим,
что наблюдаемая скорость превращения
равна скорости реакции WH=
- k
c0
и не зависит от параметра массопереноса
β.
Таким образом, данный процесс протекает в кинетическом режиме, а реакция является лимитирующей стадией.
В
случае когда k>>β
– интенсивность массообмена мала, из
уравнения (6) Cn=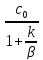 получим
cn<<c0
, а из выражений (8) КH=
получим
cn<<c0
, а из выражений (8) КH=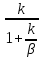 и
(9) WH=
- KH
C0
=>
WH=
- β c0.
и
(9) WH=
- KH
C0
=>
WH=
- β c0.
Массоперенос осуществляется при максимальной движущейся силе
(c0-cn)=c0, а скорость превращения не зависит от параметра реакции (константы скорости k).
Это диффузионный режим, а массоперенос -лимитирующая стадия.
Режим и лимитирующая стадия – понятия и характеристики, присущие многостадийному процессу.
Лимитирующая стадия - этап многостадийного процесса, который происходит при максимальной движущей силе или минимальной интенсивности.
Лимитирующая стадия определяет режим или область протекания процесса .т.е это не скорость самой медленной стадии т.к. в стационарном режиме скорости всех стадий равны.
46. Гетерогенный химический процесс:Система"газ-жидкость"
Взаимодействие «газ-жидкость» представлено в промышленности несколькими разновидностями по способу контакта фаз:
барботаж (диспергированный газ в виде пузырей поднимается в слое жидкости);
орошение (диспергированная в виде капель жидкость перемещается через газ);
пленчатое течение (жидкость пленкой стекает по поверхности, поток газа проходит вдоль нее);
контакт в насадочной колоне (близок к пленочному течению: жидкость стекает по насадке в виде нерегулярной , возмущенной пленки, газ проходит в свободном пространстве);
газожидкостый поток (потоки газа и жидкости перемещаются в одном направлении)
Схема процесса взаимодействия газа с жидкостью, обобщающая все рассмотренные способы контакта , представлена на рисунке 2.
Рисунок
2 Схема гетерогенного процесса
«газ-жидкость».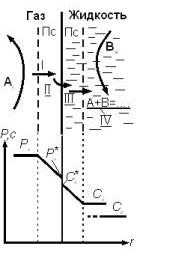
Компоненты из газообразного и жидкого потока переносятся через поверхность раздела фаз и реакция протекает в одной фазе или в обеих. В пределах выделенного элемента , в качестве которого можно выделить газовый пузырь с некоторым объемом жидкости, или элементарный участок пленчатого газожидкостного потока, концентрация компонентов по участку каждой фазы распределяется равномерно. Рассмотри один из вариантов процесса:
Исходные компоненты А и В содержатся в газе и жидкости соответственно.
Их содержание определенно условиями процесса: парциального давление А в газе РА и концентрации В в жидкости СВ. Реакция протекает в жидкой фазе и продукты остаются в жидкости или могут перейти в газ.
Запишем уравнение следующим образом:
Ar+Bж=Rж + (Sr) (18)
Скорость реакции(18) описывается кинетическим уравнением: r = k cAcB (19)
где СA- концентрация А в жидкой фазе.
Структура процесса.
Одно из отличий данной системы от предыдущей заключается в существовании в обеих фазах пограничных слоев, что обусловлено их текучестью.
Выделим основные этапы(стадии) процесса (см. рис.2).
Перенос компонента А из объема через пограничный слой к поверхности раздела фаз (этап I). 2) Перенос А через поверхность раздела из газа в жидкость (этап II). 3)Перенос А от поверхности раздела через пограничный слой жидкости в ее объем (этап III). 4)Реакция между А и В в жидкости (этап IV).
Возможное распределение концентраций А представлено в нижней части на рис.2.
Математическая модель указанной последовательности этапов основано на равенстве потоков WI:WII и WIII на стадиях переноса и WIV превращения компонента А: WI=WII=WIII=WIV (20)
Поток компонента А через газовый пограничный слой : WI=βr S (
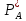 -
-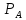 )
(21)
)
(21)
где
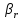 -
коэффициент масообмена между объемом
газа и поверхностью раздела фаз;
-
коэффициент масообмена между объемом
газа и поверхностью раздела фаз;
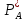 -
парциальное давление А у поверхности
раздела фаз
-
парциальное давление А у поверхности
раздела фаз
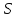 -площадь
поверхности раздела фаз
-площадь
поверхности раздела фаз
При
переносе через поверхность раздела фаз
можно полагать, что при поверхностные
парциальное давление в газе
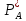 и концентрации
и концентрации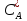 в жидкости находятся в равновесии:
в жидкости находятся в равновесии: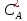 =Ka
=Ka
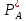 (22) гдеKa
– константа абсорбции.
(22) гдеKa
– константа абсорбции.
Поток компонента через жидкостной пограничный слой:
WIII=
- βж
S(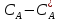 )
(23) гдеβж-
коэффициент массообмена между поверхностью
раздела и объемом жидкости.
)
(23) гдеβж-
коэффициент массообмена между поверхностью
раздела и объемом жидкости.
Реакция протекает в жидкости и скорость превращения А в ее объеме Vж:
WIV= - k CACBVж (24) Сопоставляя уравнение (20-24) получаем:
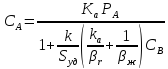 (25)
где
(25)
где
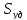 -
удельная поверхность раздела фаз
-
удельная поверхность раздела фаз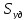 =S/Vж
,используется для характеристики
развитости площади контакта жидкости
и газа.
=S/Vж
,используется для характеристики
развитости площади контакта жидкости
и газа.
Если
перенос из одной среды в другую проходит
через несколько последовательных
этапов, его интенсивность определяет
общим
коэффициентом массопереноса
между газом и жидкостью –β: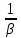 =
=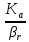 +
+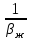 (26)
(26)
В
химической технологии удобно использовать
объемный коэффициент массопереноса
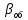 - количество вещества, переносимого
между фазами через поверхность,
находящегося в единице объема одной
или обеих фаз, в единицу времени при
единичной разности концентраций вещества
в фазах: Βоб=β
Sуд
(27)
- количество вещества, переносимого
между фазами через поверхность,
находящегося в единице объема одной
или обеих фаз, в единицу времени при
единичной разности концентраций вещества
в фазах: Βоб=β
Sуд
(27)
Преобразуем
уравнение (25) используя выражение
(26),(27): СА=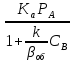 (28)
(28)
Наблюдаемую
скорость превращения WH
получим подставив (28) в кинетическое
уравнение (24): WH=WA=
- k
CACB=
-
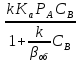 (29)
(29)
Режимы процесса.
В кинематическом режиме определяют стадией является реакция, вызванная максимальной движущей силой.
В
данном случае это произойдет если
жидкость будет насыщена компонентом А
, то есть при условии СА=KаPA
, что
исходя из (28) возможно при
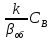 >>1 и как следует из (29):WH=
- βоб
Ka
PA
(31)
>>1 и как следует из (29):WH=
- βоб
Ka
PA
(31)
Отсюда наблюдаемая скорость превращения WH равна скорости переноса компонента А в не содержащую его жидкость, и зависит от коэффициента переноса βоб
Анализ процесса «газ-жидкость».
Обращает на себя внимание иной вид выражения (29) для WH по сравнению с кинетическим уравнением (24) согласно которому скорость реакции описывается уравнением первого порядка по компонентам А и В. Выражение же (29) имеет вид характерной для реакций с торможением их скорости одним из компонентов. В данном случае с увеличением концентрации В реакция приобретает нулевой порядок по В, то есть ее скорость не зависит от концентрации В. Причина «торможения» скорости реакции связана с нехваткой компонентов А в жидкости для протекания реакции.
Температурная зависимость скорости превращения.
При
небольших температурах константа
скорости мала:
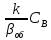 <<1 и в системе устанавливается
кинетический режим ( уравнение (30)).
Однако с возрастанием температуры на
скорости реакции начинает сказываться
константа абсорбции Ка
и реакция начинает переходить в
диффузионный режим.
<<1 и в системе устанавливается
кинетический режим ( уравнение (30)).
Однако с возрастанием температуры на
скорости реакции начинает сказываться
константа абсорбции Ка
и реакция начинает переходить в
диффузионный режим.
По
этой причине скорость превращения с
ростом температуры сначала возрастает,
а затем уменьшается. При больших
температурах наблюдается диффузионный
режим и, соответственно
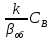 >>1. (см. (29)).
>>1. (см. (29)).
Здесь температура может даже отрицательно сказываться на скорости превращения из-за уменьшения растворимости газообразного компонента.
Коэффициент массопредачи βоб практически не зависит от температуры.
Интенсификация процесса.
Повышение температуры- наиболее эффективный способ ускорения процесса в кинетической области.( см. k=k0 exp
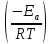 ).
В диффузионном режиме, как указывалась,
рост температуры может отрицательно
сказаться на скорости процесса.
).
В диффузионном режиме, как указывалась,
рост температуры может отрицательно
сказаться на скорости процесса.Увеличение скорости потоков и их турбулизация, от которых зависит коэффициент массопередачи βоб – основной способ интенсификации процесса в диффузионном режиме(см.(31)).
Увеличение удельной поверхности контакта влияет на интенсивность процесса , так как βоб пропорционален Sуд.(см. (27)). Βоб=β Sуд Это достигается диспергированием потоков (уменьшением размеров пузырей или капель). Но здесь есть ограничения. В барботаже движение пузырей, их всплытие в слое жидкости определяется гравитацией, явлением неуправляемым.
При подъеме мелкие пузыри сливаются, крупные- дробятся и реально можно достигнуть значения объемного коэффициента массопереноса βоб=0,2-0,3с-1.
Увеличить поверхность контакта фаз возможно путем принудительного создания развитой поверхности с помощью насадки. Но и этот прием так же ограничен.
В слое мелкой насадки с развитой поверхностью пространство для потоков газа и жидкости ограничено. Этим путем можно достигнуть значение объемного коэффициента массопередачи βоб = 0,5÷0,6 с-1.
Изменение растворимости газа в жидкости – эффективный способ управления интенсивностью газожидкостного процесса в любом режиме.
С увеличение константы абсорбции Ка вызванным, например, подбором хорошего растворителя, наблюдаемая скорость превращения будет возрастать.
