
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
38.Гомогенный химический процесс: простая необратимая реакция
Необратимая
реакция A=R
представлена химическим уравнением
 n
(1),
n
(1),
Где
n
– порядок реакции по A;
 – концентрация А;r
– скорость реакции.
Зависимость r(CA)
– концентрация А;r
– скорость реакции.
Зависимость r(CA)

Видно,
что от n
зависит темп возрастания скорости –
он выше для реакций более высокого
порядка. Если CA
выразить
через степень превращения XA
 =>
=> n
(2)
n
(2)
Зависимость r(XA)

Т.к.
 (3) то можно построить концентрационную
и конверсионную зависимостьr(CA)
и r(X)
скорости реакции при разных температурах
T1
и T2
(T2>
T1).
(3) то можно построить концентрационную
и конверсионную зависимостьr(CA)
и r(X)
скорости реакции при разных температурах
T1
и T2
(T2>
T1).


Видно, что при более высокой температуре превращение происходит быстрее. Так как из (3) следует, что увеличением температуры константа скорости реакции возрастает. Таким образом, повышение температуры обуславливает интенсификацию процесса для необратимой реакции. Ограничение температуры вызвано термостойкостью компонентов, появлением нежелательных реакций, возможностью самовоспламенения, устойчивостью материала аппаратуры и т.д.
39. Гомогенный химический процесс: простая обратимая реакция.
Обратимая
реакция представлена кинетическим уравнением
первого порядка в обоих направлениях:
представлена кинетическим уравнением
первого порядка в обоих направлениях:
 (1) Т.к. скорость реакции зависит от
концентрации двух компонентов, зависимостьr(CA)
представлена рядом кривых, полученных
при различных значениях
(1) Т.к. скорость реакции зависит от
концентрации двух компонентов, зависимостьr(CA)
представлена рядом кривых, полученных
при различных значениях
 .
Точки САР
– отвечают состоянию равновесия в
реакционной системе, при этом концентрация
компонентов равна САР
и СRP
соответственно. Если СА<
САР,
скорость реакции отрицательна (штриховая
линия). Т.е. реакция протекает в обратном
направлении.
.
Точки САР
– отвечают состоянию равновесия в
реакционной системе, при этом концентрация
компонентов равна САР
и СRP
соответственно. Если СА<
САР,
скорость реакции отрицательна (штриховая
линия). Т.е. реакция протекает в обратном
направлении.



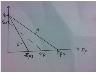
Выразим
СА
и
 через степень превращения х:
через степень превращения х:
Тогда:
 (2)
(2)
Зависимость
r(x)
имеет линейно убывающий вид (штриховая
линия – зависимость r(x)
для необратимой реакции). Из (2) следует,
что r=0
при
 ; КР
– константа равновесия; хР
– равновесная степень превращения.
; КР
– константа равновесия; хР
– равновесная степень превращения.
 увеличиваются с ростом температуры, но
увеличиваются с ростом температуры, но .
Их совместное влияние зависит от
соотношения энергий активации прямой
и обратной реакции. Последнее различно
для экзо- и эндотермических реакций.
.
Их совместное влияние зависит от
соотношения энергий активации прямой
и обратной реакции. Последнее различно
для экзо- и эндотермических реакций.
Зависимость r(x) при температуре Т1 (штриховая линия) и при Т2>Т1 (сплошные линии). Если реакцию проводить при более высокой температуре, то начальная (при х=0) скорость увеличивается.
Далее равновесие изменяется в зависимости от типа реакции: для эндотермической реакции скорость повышается во всем интервале изменения х; в экзотермической реакции скорость повышается лишь до некоторого момента.
Т.о. для экзотермической реакции существуют оптимальные температуры для каждой степени превращения, при которой скорость реакции максимальна. Следовательно, уменьшение температуры по мере протекания реакции, приводящее к максимальной интенсивности данного процесса для обратимой экзотермической реакции.
Для обратимой эндотермической реакции оптимальная температура равна максимально допустимой.
Проведение процесса при максимально допустимой температуре определяет способ интенсификации процесса для обратимой эндотермической реакции.
40. Базисная система стехиометрических уравнений: стехиометрически независимые уравнения; выбор системы стехиометрических уравнений.
Стехиометрические уравнения показывают, в каких соотношениях реагенты вступают во взаимодействие. Они имеют вид:
![]()
где: А,B – исходные вещества; R,S– продукты реакции;
![]() -
стехиометрические коэффициенты.
-
стехиометрические коэффициенты.
Химические превращения могут быть описаны одним или несколькими стехиометрическими уравнениями. В случае, когда имеет место несколько стехиометрических уравнений, стехиометрический коэффициент i-го вещества, j-го уравнения, можно обозначить, как и систему уравнений можно представить в виде:
![]()
,
где n – число реагентов, m – число
уравнений ,
![]() – для исходных реагентов,
– для исходных реагентов,![]() – для продуктов,
– для продуктов,![]() – для i-го вещества, не входящего в j-ое
уравнение.
– для i-го вещества, не входящего в j-ое
уравнение.
Совокупность стехиометрических уравнений, однозначно и полно описывающих процесс, называют базисной системой стехиометрических уравнений. Так как со стехиометрическими уравнениями можно делать линейные преобразования (складывать уравнения, переносить члены справа налево и наоборот и т.д.), то возникают трудности при определении базисной системы уравнений, например: процесс получения водорода из природного газа можно записать двумя уравнениями:
![]()
но можно эти уравнения сложить и тогда:
![]()
Для расчета данного процесса не достаточно последнего уравнения, хотя оно и является суммой предыдущих. Таким образом, базисная система линейно-независимых стехиометрических уравнений, однозначно описывающих процесс, должна включать все участвующие в химическом превращение вещества и не должна включать ни одного уравнения, которое может быть получено линейными преобразованиями других.
В большинстве случаев необходимое число стехиометрических уравнений можно определить по формуле: У=В-Э, где У - число независимых уравнений, В - число веществ (реагентов), Э- число химических элементов из которых состоят реагенты. Так для конверсии метана В=5 ; Э=2 , откуда У=2. Базисная система включает два уравнения. Для отдельных обменных процессов формула имеет вид: У=В-Э+1.
