
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
Допустим,
изотермический процесс осуществляется
при температуре адиабатического
экзотермического процесса и превышающую
ее в эндотермическом процессе.
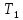 = .
= .
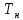 (.
(.
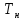 - температура на входе в реактор). В
первом случае изотермический процесс
будет менее интенсивным, чем адиабатический,
а во втором большая степень превращения
будет достигаться при меньшем времени
реакции.
- температура на входе в реактор). В
первом случае изотермический процесс
будет менее интенсивным, чем адиабатический,
а во втором большая степень превращения
будет достигаться при меньшем времени
реакции.
Если
же температура изотермического процесса
.
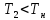 то интенсивность изотермического
процесса будет выше, чем адиабатического,
и это будет наблюдаться до тех пор, пока
возрастающая в течение реакции температура
не достигнет .
то интенсивность изотермического
процесса будет выше, чем адиабатического,
и это будет наблюдаться до тех пор, пока
возрастающая в течение реакции температура
не достигнет .
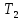 (для экзотермической реакции)
(для экзотермической реакции)
В
эндотермическом процессе при
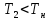 картина будет обратной. Если реакция
обратимая, то общий характер зависимости
степени превращения Х и температуры Т
от
картина будет обратной. Если реакция
обратимая, то общий характер зависимости
степени превращения Х и температуры Т
от
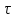 (условного времени реакции сохраняется,
с отличием лишь в том, что процесс будет
протекать только до равновесной степени
превращения
(условного времени реакции сохраняется,
с отличием лишь в том, что процесс будет
протекать только до равновесной степени
превращения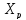 .
Тогда максимальный разогрев будет:
.
Тогда максимальный разогрев будет:
Т-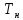 =
=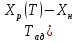 ]
(4)
]
(4)
Значения максимального разогрева определяют из графика «Т-Х»
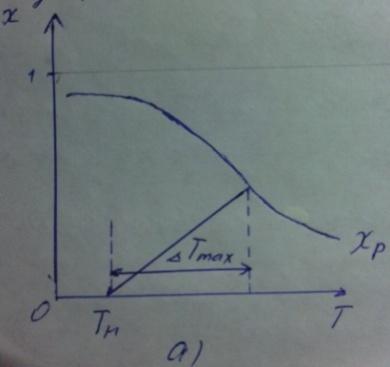
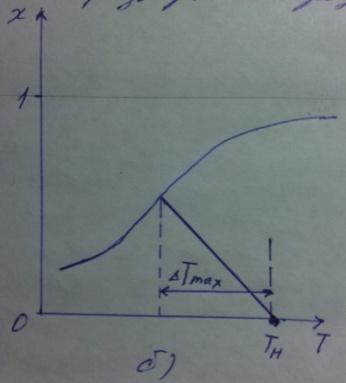
Зависимость
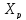 и
и
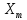 для адиабатического процесса.
для адиабатического процесса.
Определение
максимального адиабатического разогрева
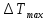 при протекании обратимых а)экзотермической
и б) эндотермической реакции
при протекании обратимых а)экзотермической
и б) эндотермической реакции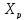 - равновесные степени превращения;
прямые – адиабаты в режиме ИВ.
- равновесные степени превращения;
прямые – адиабаты в режиме ИВ.
Пересечение
кривых зависимостей
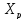 (Т)
и Х(Т) адиабатического процесса
соответствует максимальному нагреву
в слое -
(Т)
и Х(Т) адиабатического процесса
соответствует максимальному нагреву
в слое -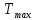 как показано на рисунке а) и б).
Интерпритация результатов исследования
модели на реальный объект.
как показано на рисунке а) и б).
Интерпритация результатов исследования
модели на реальный объект.
Исследованная модель описывает процесс в реакторах ИВ и идеального смешения периодическом ИС-п.
В
первом случае зависимости Х (
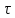 )
и Т(
)
и Т(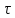 ) (степени превращения и температуры от
условного времени реакции) описывают
изменение Х и Т по длине реактора, не
меняющегося во времени протекания
реакции.
) (степени превращения и температуры от
условного времени реакции) описывают
изменение Х и Т по длине реактора, не
меняющегося во времени протекания
реакции.
Во – втором изменение во времени Х и Т распределение которых по объему реактора в каждый момент времени одинаковы.
71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
Математическая модель процесса.
Сi-Ci0/Ԏ=Wi(C,
Т) (1)
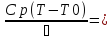 Qpr(c,Т)-Кt
Fуд(Т-Тx)
Qpr(c,Т)-Кt
Fуд(Т-Тx)
Тx – температура теплоносителя; Кt – коэффициент теплопередачи;
Fуд=
 - удельная поверхность теплообмена (FT
– площадь поверхности теплообмена; VP
– объем реактора);
- удельная поверхность теплообмена (FT
– площадь поверхности теплообмена; VP
– объем реактора);
Ԏ=
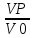 – условное время реакции (V0
– объем потока реагентов, входящих в
реактор в единицу времени); Сp
– теплоемкость;
– условное время реакции (V0
– объем потока реагентов, входящих в
реактор в единицу времени); Сp
– теплоемкость;
x=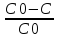 - степень превращения.
- степень превращения.
Используя
выражения для адиабатического разогрева
∆Tад=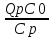 ;
;
параметра
теплоотвода B=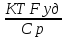 ;
и отношения скорости реакции к исходной
концентрации
;
и отношения скорости реакции к исходной
концентрации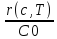 =
r(x,Т)
получим из (1):
=
r(x,Т)
получим из (1):
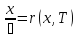 (2)
(2)
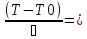 ∆Tад
r(x,Т)-B(Т-Тx)
∆Tад
r(x,Т)-B(Т-Тx)
В адиабатическом режиме (B=0) получим:
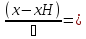 r(x,Т)
(3)
r(x,Т)
(3)
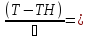 ∆Tад
r(x,Т)
∆Tад
r(x,Т)
(xH – степень превращения на входе в реактор)
С0 – начальная концентрация исходного компонента в непрореагировавшей смеси и CH – концентрация исходного компонента на входе в реактор не всегда одинаковы. Если в реактор подается частично прореагировавшая смесь xH≠0. Разделив второе уравнение на первое в (3) получим:
(T
– TH)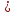 ∆Tад(x
– xH)
(4), отсюда, Температура
и степень превращения в реакторе будут
иметь ступенчатое распределение
профили
степени превращения x(Ԏ)
и температуры T(Ԏ)представлены
на рис 1а и 1б соответственно.
∆Tад(x
– xH)
(4), отсюда, Температура
и степень превращения в реакторе будут
иметь ступенчатое распределение
профили
степени превращения x(Ԏ)
и температуры T(Ԏ)представлены
на рис 1а и 1б соответственно.
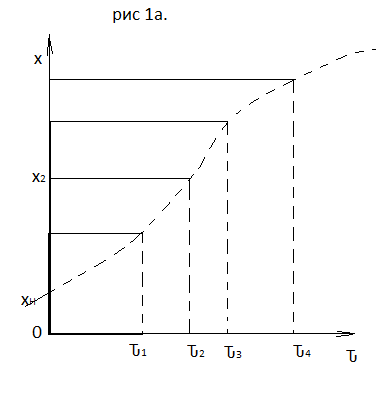
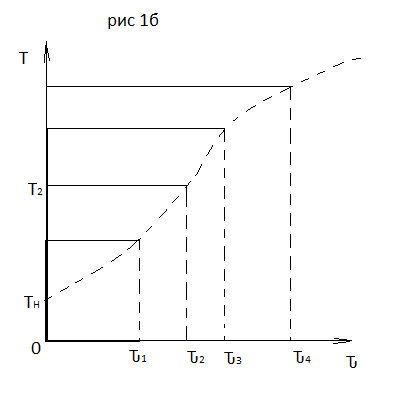
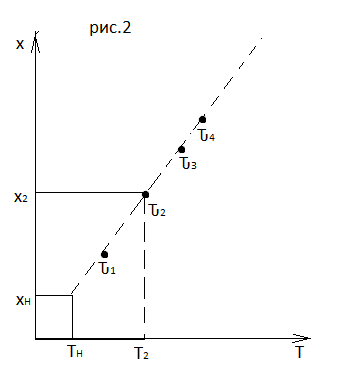
Кривые х(Ԏ) и Т(Ԏ) есть графическое отображение функции (4), и эти зависимости надо представлять, как набор значений x и Т устанавливаются в различных реакторах. В координатах «T – x» режим процесса в реакторе будет описываться линией, соединяющей две точки между исходным состоянием смеси при Ԏ, то есть последовательность точек при разных Ԏ будет лежать на прямой адиабаты T=TH+∆Tад(x – xH) (см.(4)), показанной на рис.2 штриховой линией.
График «Т – х» для проточных реакторов ИС-н с различными значениями условного времени Ԏ (реакция экзотермическая) представлен на рис.2.
