
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
59. Классификация процессов в химическом реакторе и их математических
Моделей.Следует следующая классификация химических реакторов:
Организация материальных потоков.
Поток в реакционной зоне.
Реактор идеального вытеснения.
Реактор идеального смешения.
Реактор неидеальный.
1.2.1. Проточный реактор (непрерывный).
1.2.2. Непроточный реактор (периодический).
2. Организация тепловых потоков.
2.1. Температурный режим процесса.
2.1.1. Изотермический.
2.1.2. Неизотермический.
2.2. Тепловой режим реактора.
2.2.1. Адиабатический.
2.2.2. С внешним теплообменом.
62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
Математическая модель процессов:
dc/d ῖ =W (с);с=с0 ,при ῖ =0 (1)
Где ῖ= ῖ ; t в зависимости от процесса.
Скорость реакции r(c)=k1cA-k2cB зависит от концентраций сА и сВ, следовательно для описания процесса используют два уравнения вида (1) .
Перейдем к одной переменной – степени превращения х реагента А: сА=с0(1-х) и cR=c0x ,где с0-исходная концентрация реагента А.
Модель процесс примет вид :
dx/dῖ=k1(1-x)-k2x ; х=0 ,при ῖ =0 (2)
Преобразуем (2) к виду dx/dῖ=k1 -(k1+k2)x и проинтегрируем его :
ln
k1-(k1+k2)x-ln
k1/k1+k2=ῖ
, или х =k1/k1+k2
[1-e-(k1+k2)
ῖ ]
(3)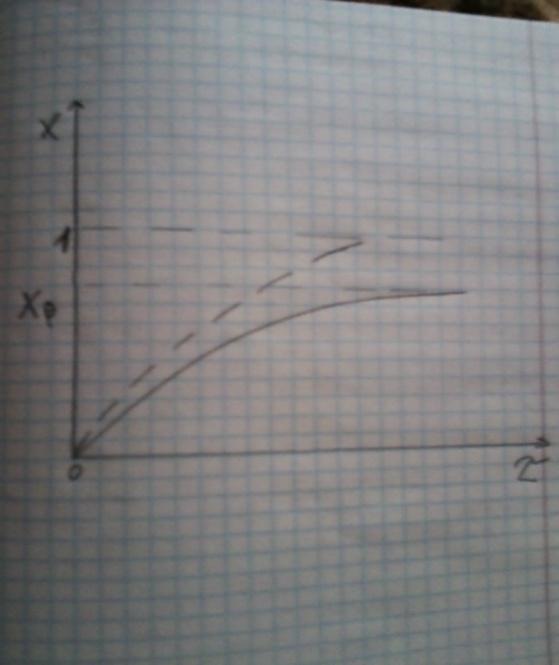
Из (3) видно ,что с увеличением ῖ х(ῖ) увеличивается вплоть до х=k1/k1+k2 при ῖ→∞.
Т.к.константа равновесия обратимой реакции Kр=k1/k2 и равновесная степень превращения xр =Kр/1+Kр, то предельное превращение достигаемое в реакторе равно :
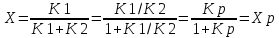 (4)
(4)
Это естественно ,т.к реакция протекает до равновесия .Зависимость х(ῖ) для простой обратимой реакции (сплошная линия ) и обратимой реакции (штриховая линия ) представлена на рисунке.
Рассматриваемая реакция имеет первый порядок в прямом и обратном направлении ,поэтому начальная концентрация с0 не влияет на степень превращения .
60. Анализ процесса в химическом реакторе.
Анализ процесса в химическом реакторе исследования влияния условий процесса и характеристик( свойств) его составляющих на показатели работы реактора, а также выявление особенностей процесса и режима.
Условия
процесса – состав исходной реакционной
смеси ( исходные концентрации реагентов
 ), объем поступающего потока ( нагрузка
на реактор
), объем поступающего потока ( нагрузка
на реактор
 ),
температуры входного потока
),
температуры входного потока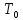 ,
хладагента
,
хладагента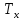 ( для процессов с теплоотводом) или в
реакторе ( для процессов с теплоотводом)
или в реакторе ( для изотермического
процесса –
( для процессов с теплоотводом) или в
реакторе ( для процессов с теплоотводом)
или в реакторе ( для изотермического
процесса –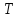 ).
).
Режимы
процесса – характеристики химического
процесса, схема превращения и тип
реакций( вид кинетических уравнений),
энергия активации, тепловой эффект; для
неизотермических процессов – параметры
теплоотвода ( коэффициенты теплопередачи
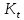 ,
величина поверхности теплообмена
,
величина поверхности теплообмена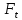 ,
теплофизические свойства потока
,
теплофизические свойства потока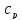 ).
).
Показатели процесса – степень превращения x, селективность – S, выход продукта E, а также профили концентраций, степени превращения и температуры в реакторе, их изменение во времени. Зная эти показатели, можно далее определять и другие: конструктивные параметры реактора, энергетические затраты, экономические показатели и др.
Особенности процесса и режима – влияние условий и свойств процесса на его показатели, управление процессом ( изменение условий и свойств для достижения желательных показателей); критические режимы ( например, их существование , неустойчивость).
Анализ процесса в химическом реакторе осуществляют с использованием методов математического моделирования.
Один из вариантов последовательности проводимого анализа рассмотрим ниже.
Обоснование и построение математической модели процесса.
Преобразование уравнений математической модели к виду, удобному для дальнейшего исследования.
Решение уравнений математической модели для получения зависимостей, подлежащих анализу.
Представление результатов решения уравнений в графическом виде, как наиболее удобном для анализа.
Интерпретация результатов решения уравнений на процесс в исследуемом реакторе, то есть перенос полученных зависимостей между переменными уравнений на состояние процесса в реакторе.
Собственно анализ модели и процесса: выявление свойств математической модели на основе поведение ( изменения) решения при изменении параметров уравнений и перенос свойств модели на процесс в реакторе.
Сопоставление процессов в реакторах различного типа.
Выявление особенностей математической модели и, следовательно, особенностей режима.
61. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ХИМИЧЕСКОМ РЕАКТОРЕ. РЕЖИМ ИДЕАЛЬНОГО СМЕШЕНИЯ И ИДЕАЛЬНОГО ВЫТЕСНЕНИЯ. ПРОСТАЯ НЕОБРАТИМАЯ РЕАКЦИЯ А=R.
Математическая модель процессов
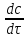 =w
(c);
c
= c0
при
=w
(c);
c
= c0
при
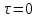 (1)
(1)
Где
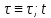 в зависимости от процесса
в зависимости от процесса
Математическая модель для реакции первого порядка: (т.к. w(c) = -RC): (2)
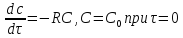 (3)
(3)
Интегрируя (3) получил:
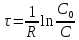 и
С
и
С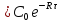 (4)
(4)
Выражая
концентрацию через степень превращения
[
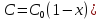 ,
получим из (3):
,
получим из (3):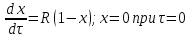 (5)
(5)
И его решением будет
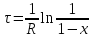 и
и
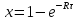 (6)
(6)
Графики
С (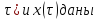 на рисунке
на рисунке
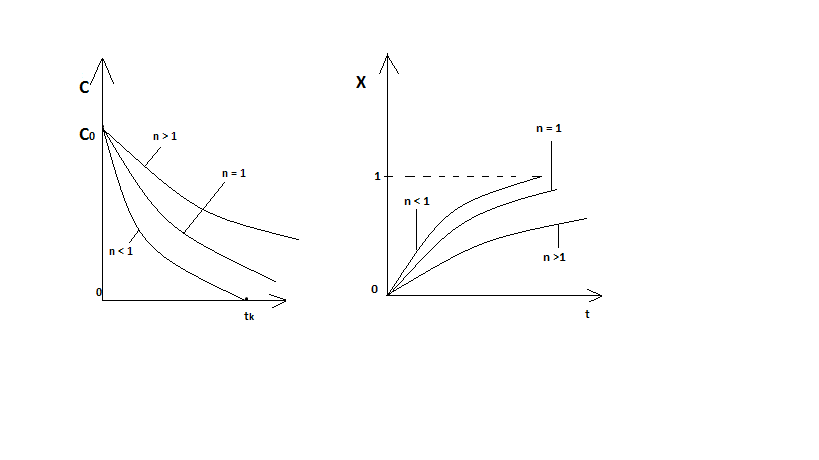
Из
графиков видно, что при
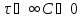 или x
или x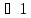 соответственно, следовательно, в
необратимой реакции исходное вещество
постепенно расходуется до его полного
превращения.
соответственно, следовательно, в
необратимой реакции исходное вещество
постепенно расходуется до его полного
превращения.
Интерпретация решения (4) уравнений математической модели (1) на процессы в режимах ИС - п и ИВ следующая.
В
режиме ИС
– п
процесс не стационарен
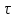 ≡ t
и со временем t
концентрация исходного вещества C
уменьшается в соответствии с (4).
≡ t
и со временем t
концентрация исходного вещества C
уменьшается в соответствии с (4).
Но в каждый момент времени – концентрация C во всех точках реактора одинакова.
В
режиме ИВ
процесс протекает стационарно.
Концентрация C
меняется по длине
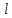 реактора
реактора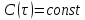 .
.
То
анализ зависимостей С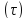 (4) или
(4) или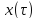 (6) показывает влияние условий процесса
на изменение концентрацииС,
или степени превращения x
во времени в режиме ИС
– п
и распределение C
и x
по длине реактора в режиме ИВ.
(6) показывает влияние условий процесса
на изменение концентрацииС,
или степени превращения x
во времени в режиме ИС
– п
и распределение C
и x
по длине реактора в режиме ИВ.
