
- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
Гистерезис стационарных режимов.
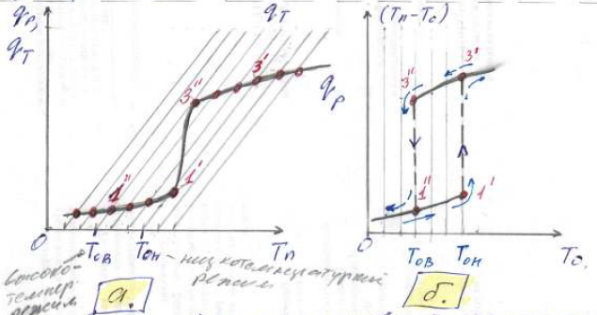
Проследим изменение разогрева поверхности (Tn – T0) при постепенном повышении температуры потока T0 и выделим ряд последовательных стационарных режимов, определенных из пересечений серии прямых qT для разных температур T0 с кривой тепловыделения qp
 (см.
рис. 2).
(см.
рис. 2).
|
|
|
Рисунок 2 : К формулировке гистерезиса стационарных режимов. |
Постепенное повышение T0 приводит к постепенному увеличению Tn .
Соответствующие этим значениям режима отмечены точками внизу на рисунке 2а и кривой «1ʺ- 1ʹ» на рисунке 2б.
По достижении температуры объема системы T0 значения Toн , низкотемпературные режимы перестают существовать (последний низкотемпературный режим обозначен на рисунках 2а и 2б точкой «1ʹ») и происходит скачок в область высокотемпературных режимов. Это «температура зажигания».
Дальнейшее повышение T0 будет мало влиять на разогрев поверхность (Tn-T0) который по величине близок к адиабатическому разогреву ∆Tад .
На рисунке 2б стрелками показано направление изменения (Tn-T0) с увеличением T0.
Теперь проследим за обратным движением по стрелкам с постепенным уменьшением T0, при котором стационарные режимы на рисунке 2а отмечены точками вверху. При достижении точки «3ʹ» повторяется состояние системы в высокотемпературном режиме. Причем дальнейшее уменьшение T0 приводит к реализации высокотемпературных режимов вплоть до T0В, после чего происходит переход скачком от состояния «3ʺ» к состоянию «1ʺ» (см. рисунок 2б).
T0В – граница существования высокотемпературных режимов и называется «температурой потухания»
При дальнейшем движении в сторону понижения T0 режимы будут совпадать с полученным при подъеме T0 .
Такой гистезис стационарных режимов был получен и эксперементально.
Зажигание и потухание – кристаллические режимы процесса.
Отметим, что при изменении условий процесса, например, температуры потока T0 , реализовались только низкотемпературный и высокотемпературный режимы, без среднетемпературного режима 2 (см. рис. 1)
Это связано с тем, что среднетемпературный режим является неустойчивым и на практике не реализуется.
54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
Осуществление условий ,вызывающих"зажигание процесса", можно с пользой использовать в произвдстве.
Высокотемпературный, интенсивный режимпроводится при температуре небольшой потока То.Чтобы выйти на него,
не разогревая,например катализатор и поток реагентов,на короткое время повышают концентрацию
реагента и после достижения необходимой температуры конценрацию возвращают к заданной.Таким же образом осуществляется пожигание топлива ( горение относится к процессу"газ-твердое" ).Но зажигание может привести к нежелательному самовозгоранию твердых горючих материалов.Особенно опасно это явление процессах с большим адиабатическим разогревом.Переход к высокотемпературному режиму приводит к резкому увеличению обьема газа, что приведет к тепловому взрыву.Использование критических режимов необходимо просчитать заранее ."Потухание"проесса также надо предвидеть.Например,окисление аммиакапротекает на платиноидном катализаторе во внешнедиффузионном режиме. Температура газа около 470К, катализатора-1170К,следовательно адиабатический разогрев-700 градусов.Если например ,уменьшить конценрацию аммиака(т.е.уменьшить...формула...,то будет реализован низкотемператуный режим и температура
резко спадет.Но возврат к прежним условиям по концентрации аммиака не востановит высокотемпературны режим.
Для этого будет необходим предварительный разогрев катализатора и др.пусковые операции процесса.Возможность
осуществления критических явлений необходимо учитывать в технологических работах.Основным результатом
исследования хим. процесса протекающего в элементрном обьеме,является скорость превращения компонентов реакционной смеси с учетом всех наблюдаемых в нем явлений.
