- •29.Химический реактор. Емкостной реактор. Емкостной реактор проточный. Колонный и насадочный реактор.
- •30.Реактор с непрерывным твердым реагентом. Вращающийся цилиндрический реактор. Реактор с просыпающимся навстречу газу твердым реагентом. Реактор с «кипящим» слоем.
- •31.Трубчатый реактор. Трубчатый реактор типа печь.
- •32.Основные структурные элементы реакторов на примере многослойного реактора, оснащенного системой теплообмена.
- •33. Процесс, происходящий в реакционной зоне (для каталитического и газожидкостного взаимодействия).
- •34.Модель и моделирование.
- •35. Физическое и математическое моделирование.
- •36.Математичекое моделирование химических процессов и реакторов.
- •38.Гомогенный химический процесс: простая необратимая реакция
- •39. Гомогенный химический процесс: простая обратимая реакция.
- •41. Гомогенный химический процесс: сложная реакция, параллельная схема превращения.
- •42. Гомогенный химический процесс: сложная реакция, последовательная схема превращения.
- •43. Общие положения.
- •44. Гетерогенный химический процесс:Система"газ(жидкость)-твердое(полностью реагирующее)"
- •45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос)
- •46. Гетерогенный химический процесс:Система"газ-жидкость"
- •47. Общие представления о катализе
- •48. Технологические характеристики твердых катализаторов.
- •50. Основные факторы, влияющие на гетерогенные и католитические процессы.
- •51. Тепловые явления в хим.Процессе: гетерогенный процесса поверхности раздела фаз.
- •52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
- •53.Критические тепловые явления в гетерогенном процессе: гистерезис стационарных режимов.
- •54. Критические тепловые явления в гетерогенном процессе, практическое приминение критических режимов.
- •55. Этапы моделирования
- •56. Математическая модель периодического процесса в емкостном реакторе.
- •57. Математическая модель процессов в реакторах типа емкостной проточный реактор, реактор колонный, реактор с «кипящим» слоем и в реакционной зоне многослойного реактора.
- •59. Классификация процессов в химическом реакторе и их математических
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •60. Анализ процесса в химическом реакторе.
- •62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция а↔ r
- •63. Изотермический процесс в химическом реакторе. Режим идеального смешения периодический и идеального вытеснения. Сложная реакция с параллельной схемой превращения.
- •64. Изотермический процесс в химическом реакторе. Режим идеального смешения, периодического и идеального вытеснения. Сложная реакция с последовательной схемой превращения.
- •67. Изотермический процесс в химическом реакторе. Режим идеального смешения в проточном реакторе. Сложные реакции.
- •66. Изотермический процесс в химическом реакторе. Режим идеального смещения в проточном реакторе. Простая обратимая реакция а↔r.
- •68. Неизотермический процесс в химическом реакторе. Организация теплообмена в реакторе и температурные режимы.
- •69. Неизотермический процесс в химическом реакторе. Режимы идеально смешивания периодического и идеального вытеснения. Анализ процесса.
- •70. Неизотермический процесс в химическом реакторе. Режимы идеального смешения периодический и идеального вытеснения с теплообменом. Сопоставление адиабатического процесса и изотермическим.
- •71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса.
- •72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов.
- •73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов.
- •74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом.
- •75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения.
- •76. Химическое производство как химико-технологическая система.
- •78.Подсистемы химико-технологической системы
- •79.Эелементы и связи химико-технологической системы
- •80. Анализ химико-технологической системы.
- •82. Сырьевая база химической промышленности.
- •83) Основные понятия и классификация сырья.
- •84.Вторичные материальные продукты.
- •85. Энергетическая база химической промышленности.
- •86.Классификация топлива- энергетических ресурсов.
- •87. Микробиологический синтез
- •89.Инженерная энзимология.
52.Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
Допустим протекает реакция первого порядка r(C,T)=k(T)C.
Используя выражение для стенки превращенияна поверхности: xn=(C0-Cn)/C0,
Связь
коэффициентов массо- и теплообмена (6)
β3
= α3
/
Ср
и
определении адиабатического разогрева
(8) ∆Tад=
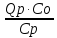 ,преобразуем
уравнение (4) и (5) к виду:
,преобразуем
уравнение (4) и (5) к виду:
xn=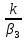 (1-xn)
(10)
(1-xn)
(10)
β3(С0-Сn)=r(Сn
, Tn)
(4) но r(Cn
, Tn)=k(T)Cn=>β3(C0
– Cn)=kCn=>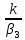 =
=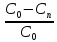 но x=
но x=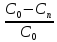 =>x=1-
=>x=1-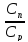 =>
=>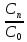 =1-x,
а
=1-x,
а
 но
и
но
и
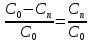 – 1 =>
– 1 =>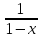 - 1 =
- 1 =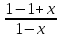 =
=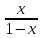 ;
т.о.
;
т.о.
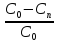 =
=
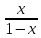 и получим:
и получим: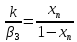 =>(10)
и,
=>(10)
и,
Tn – T0 = ∆Tад· xn (11)
α3 (Tn-T0)=Qpβ3 (C0-Cn), (5)
∆Tад
=
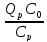 ;
x=
;
x=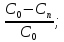 β3=
β3=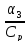 =>β3Cp(Tn-T0)
= Qpβ3C0
=>β3Cp(Tn-T0)
= Qpβ3C0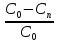 => Tp-T0=
=> Tp-T0=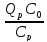 ,
xn
=> Tn
– T0=∆Tад·xn
из
(10) выразим
xn
,
xn
=> Tn
– T0=∆Tад·xn
из
(10) выразим
xn
Xn=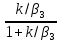 ,
(12)
,
(12)
Подставим (12) в (11) получим:
Tn
– T0
= ∆Tад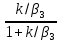 (13)
(13)
Количество отводимой от поверхности теплоты равно α3 (Tn-T0) (см. (1)), т.о. левая часть уравнения (13) представляею теплоотвод, который обозначим qp .
Экспоненциальная
зависимость k(Tn)
= k0
exp(
-
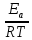 не позволяет из уравнения (13) получить
значение Tn
в
явном виде.
не позволяет из уравнения (13) получить
значение Tn
в
явном виде.
Используем графический метод решения уравнения.
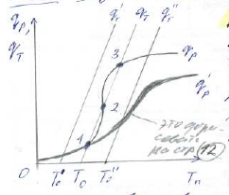
На рисунке 1 даны зависимости теплот выделения qp и qT от температуры Tn на поверхности для процесса взаимодействия газа с твердой частицей.
|
|
Рисунок 1. Зависимость теплот выделения qp и qT от температуры на поверхности Tn для процесса взаимодействия газа и твердой частицы. Точки пересечения 1,2,3 соответствуют разным стационарным режимам. |
Пересечение кривых на графике зависимостей qT(Tn) и qp(Tn) ,будет решением уравнения (13). Зависимость qp(Tn) имеет вид S – образной кривой.
При
малых значениях температур, когда
k/β3<<1,
qp(Tn)
~∆Tад
·
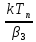 ,
-
функция принимает вид, подобный
экспоненциальной функции. При больших
значениях температур, когда k/β3
>>1,
qp
~ ∆Tад
и
зависимость – прямая линия.
,
-
функция принимает вид, подобный
экспоненциальной функции. При больших
значениях температур, когда k/β3
>>1,
qp
~ ∆Tад
и
зависимость – прямая линия.
Из рисунка 1 видно, что в зависимости от значения T0 (температуры в объеме) возможно одно или три пересечения зависимостей qT (Tn) c qp(Tn) , то есть одно или три решения уравнения (13).
Наличие трех решений указывает на то, что при одних и тех же условиях процесса возможны один или три стационарных режима, то есть существует неоднозначность стационарных режимов. Какой из них будет реализован зависит от предыстории процесса. Если в начале твердая частица имеет температуру Tон , близкую к температуре газа T0 то будет реализован низкотемпературный режим (точка 1 на рис.1). При этом температура и концентрация в потоке (T0 и C0) и на поверхности частицы (Tn и Cn) близки друг к другу – режим кинетический. Если же вначале частица была разогрета до TOB , то установится высокотемпературный режим (точка 3 на рис. 1) с разогревом поверхности, близким к адиабатическому (см. уравнение (9)), то есть Cn<<C0 и режим – внешнедиффузионный.
Таким образом, можно выделить области существования стационарных режимов в рассматриваемом процессе. Низкотемпературные режимы существуют при T0<T0Н, высокотемпературные при T0>T0B . При T0<T0B и T0>T0Н –стационарный режим единственный. Если же T0 лежит в интервале T0B< T0<T0Н , то система будет находиться в одном из трех стационарных режимов.
Необходимо отметить, что при некоторых условиях процесса уравнение (13) будет иметь один корень, то есть при всех T0 будет существовать единственный стационарный режим (см. зависимость q’p(Tn) рис. 1)
Положительная обратная связь.
Причина появления неоднозначности стационарных режимов заключается в следующем. Скорости взаимосвязанных стдий процесса (тепловыделения при химическом превращении и межфазного теплообмена зависят от температуры поверхности Tn , увеличение которой ускоряет и реакцию (k возрастает с температурой) и теплоотвод (движущая сила (Tn – T0) становится больше).
Уменьшении Tn подавляет скорости обоих стадий.
В рассматриваемом процессе есть положительная обратная связь между тепловыми стадиями процесса:
Увеличение по какой либо причине скорости тепловыделения и, следовательно, температуры поверхности Tn , приведет к увеличению теплоотвода.
Это влияние – нелинейное (S – образная зависимость тепловыделения от температуры qp(Tn) см. рис. 1)
Именно положительная обратная связь между нелинейными стадиями процесса обуславливает возможность появления неоднозначности стационарных режимов.
Проявится ли это свойство зависит, как уже указывалось, от условий процесса.
Влияние концентрации на поверхности Сn на скорости стадий различно: скорость реакции возрастает с концентрацией (r~cn) , а движущая сила (C0 – Cn) и скорость массообмена, наоборот, уменьшится.
Это – отрицательная обратная связь, не приводящая к неоднозначности стационарных режимов – в изотермическом процессе такое явление не было обнаружено.