
Vidpovidi_do_vidkritikh_pitan_z_dif
.docxВідповіді до відкритих питань з диф. заліку
1
У d-елементів заповнюються орбіталі не зовнішнього, а передзовнішнього енергетичного рівня.У атомів d-елементів на зовнішньому енергетичному рівні на ns-підрівні, як правило, знаходяться два електрони.
Fe0 1s22s22p62s23p63d64s2
Ферум(ІІІ) оксид має амфотерні властивості. Він реагує з кислотами з утворенням солей трьохвалентного Феруму:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Ферум(ІІІ) гідроксид Fe(OH)3 є нерозчинною речовиною бурого кольору. Його можна добути реакцією обміну між солями трьохвалентного Феруму і лугами у розчині: FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓.Ферум(ІІІ) гідроксид проявляє амфотерні властивості і може взаємодіяти з кислотами і лугами.
Основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Препарати Феруму: Актиферин ( лікування залізодефіцитної анемії), Гемоферон, Глобіген,Ферогематоген. В основному всі вони використовуються по нестачі заліза в організмі, при залізодефіцитних анеміях. 2KMnO4 + 10FeSO4 + 8H2SO4 (розб.) = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
2
Протонна (протолітична) теорія кислот і основ. У 1923 р. датський вчений Й. Бренстед і англійський хімік Т. Лоурі запропонували протонну (протолітичну) теорію, на основі якої кислотно-основні властивості речовин пояснюють за відношенням їх до протона.
Кислотою називають сполуку, що віддає протони, тобто є донором протонів. Основою називають сполуку, що приєднує протони, тобто акцептором протонів. Згідно з цією теорією, у результаті кислотно-основної взаємодії утворюються нова кислота й нова основа. Отже, взаємодія між кислотою й основою зводиться до переходу протона від кислоти до основи. Внаслідок цього кислота (1) перетворюється на основу (1), а основа (2) - на кислоту (2). Ці пари (кислота - основа) називають поєднаними (спряженими). Згідно з теорією Бренстеда - Лоурі, кислоти й основи називають протолітами, а реакції, що відбуваються з перенесенням протонів, - протолітичними. Речовини, що виявляють двоякі властивості - і віддають, і приєднують протони, - відносять до амфолітів. До них належить вода Н20, деякі йони (НС03-, НS-, Н2Р04-) тощо. Протолїтичні реакції відбуваються у напрямку утворення слабкіших протолітів.
3
Активна кислотність - це концентрація протонів (Н+).
Потенційна кислотність - це концентрація неднсоціпованпх молекул кислоти.
Загальна кислотність - це загальна концентрація кислоти в моль екв.
Сума активної та потенційної кислотностей дорівнює загальній кислотності. Під час титрування визначається загальна кислотність.
Активна лужність - це концентрація гідроксид - аніонів.
Потенційна лужність - це концентрація неднсоціґюваннх молекул основи. Загальна лужність - це загальна концентрація основи в моль екв.
Сума активної та потенційної лужностей дорівнює загальній лужності.
Під час титрування визначається загальна лужність.
Концентрацію протонів
в розчині кислоти обчислюють за
формулою:
[Н+]
= α[кислоти],
де α – ступінь дисоціації кислоти
Сильна
кислота: α=1, [Н+]
= [кислоти]
Слабка
кислота: [Н+]
=
Під час
дисоціації основи утворюються
гідрокснд-аніонн, концентрацію яких
обчислюють за формулою:
[ОН-]
= α[основи],
де α – ступінь дисоціації основи
Сильна
основа: α=1, [ОН-]
= [основи]
Слабка
основа: [ОН-]
=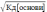
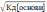
4
рН – це відємний десятковий логарифм концентрації іонів гідрогену. pH, Водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для сильний кислот: [H+] = Ск; pH = -lg [H+] = -lg Ck Для сильних основ: : [OH-] = Co; pOH = -lg[OH-] = -lgCo, рН = 14-рОН. Для слабких кислот: pH = ½ pKk - lgCk Для слабких основ: рН = 14 - 1/2(рК + lgСосн).
5
Величина рН є важливою характеристикою всіх фізіологічних рідин, від значення якої залежить функція клітин, тканин, органів і організму людини в цілому. Шлунковий сік, кров, слина, сік підшлункової залози та інші рідини характеризуються певним значенням рН, яке в нормі може змінюватися у вузькому інтервалі. Відхилення значення рН від норми призводить до виникнення патологічних станів організму, ос кільки йони Гідроксонію і гідроксид-іони визначають структуру та біологічні функції білків, нуклеїнових кислот, активність ферментів та інших клітинних компонентів організму. рН: рН крові = 7,36; рН шлункового соку = 0,9 - 1,5; рН сечі 5 – 6,5; рН жовчі = 6,2 – 8,5. Ацидо́з — підвищена кислотність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги в кислу сторону. Підвищення кислотності відбувається внаслідок збільшення концентрації іонів водню (зниження pH) і зменшення резервної лужності. Алкало́з — збільшення pH крові (та інших тканинах організму) за рахунок накопичення лужних речовин. Алкалоз — порушення кислотно-лужної рівноваги організму, що характеризується абсолютним або відносним надлишком основ. Залежність швидкості ферментативної реакції від рН середовища. Ферменти є досить чутливими до змін рН середовища, в якому вони діють. Кожний фермент виявляє свою оптимальну активність лише за певного рН середовища, наприклад, пепсин - 1,5-2,0, амілаза слини - 6,8-7,4, трипсин - 7,5-8,5, аргіназа - 9,5-10,0, тобто фермент має свій оптимум рН, за якого він є найактивнішим. Відхилення рН від оптимальних величин викликає зниження активності ферменту, тому що призводить до зміни ступеня іонізації іо-ногенних груп в активному центрі, а це впливає на спорідненість субстрату із посадочною ділянкою активного центру ферменту і на каталітичний механізм перетворення. Окрім того, зміна іонізації білка (не тільки в зоні активного центру) викликає конформаційні зміни молекули ферменту.
6
Буферними називають системи, які достатньо стійко зберігають величину рН під час додавання невеликої кількості сильної кислоти або лугу, а також під часрозведення(або концентрування).
7 Існує два типи буферних систем: а) кислотні □ складаються із слабкої кислоти та її солі, утвореної сильною основою. Наприклад, ацетатний буфер: СН3СООН + СН3COONa. б) основні □ складаються із слабкої основи та її солі, утвореної сильною кислотою. Наприклад, аміачний буфер: NH4OH + NH4Сl. 8
За рахунок часткової дисоціації кислоти та повної дисоціації солі в розчині будуть знаходитись одночасно іони СН3СОО-, Н+, Na+: CH3COONa → CH3COO- + Na+ CH3COOH →CH3COO- + H+ Якщо до нього добавити сильної кислоти, то іони Гідрогену реагуватимуть з аніонами солі, утворюючи слабку ацетатну кислоту: CH3COO- + H+ → CH3COOH (рКа = 4,75) Сильна кислота заміняється еквівалентною кількістю слабкої кислоти і рівновага зміщується вліво. При добавлянні лугу до буферного розчину гідроксид-іони взаємодіятимуть з іонами Н+ ацетатної кислоти з утворенням молекул води: CH3COOH + ОН- →CH3COO - + H2О
Нехай буферна система містить приблизно рівні концентрації слабкої кислоти (AH) та спряженої з нею основи (A-), при додаванні до неї сильної кислоти, що є донором іонів H+, останні зв'язуватимуться із основою A-: H3O+ + A- → H2O + AH.
З іншої сторони, при додаванні невеликої кількості лугу, що постачає іони OH- у розчин, з ними взаємодіятиме слабка кислота:
OH- + AH → H2O + A-.
Ці дві оборотні реакції і забезпечують буферні властивості розчину: додавання до розчину іонів H+ чи OH- має наслідком зміну співвідношення слабкої кислоти і спряженої основі, і зовсім незначний зсув pH. 9 Основні рівняння буферних систем:
Кислотний
тип: [H+]
=
Kд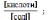
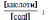 Основиний
тип: [ОH--]
= Kд
Основиний
тип: [ОH--]
= Kд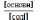
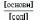
10 Рівняння Гендерсона – Гассельбаха Кислотний тип : pH = pKд – lg [кислоти]/[солі] Основний тип: pОH = pKд – lg [основи]/[солі] Як випливає з рівняння Гендерсона-Хассельбаха, рН буферного розчину залежить від співвідношення концентрацій кислоти і солі (або підстави і солі): Тому, в разі кислотно-сольової буферної системи, збільшення концентрації кислоти або зниження концентрації солі зрушує рН розчину в кислую сторону. При цьому зміна співвідношення концентрацій в 10 разів зрушує рН на одиницю.
11 Білковий буфер представляє систему з білку(протеїн - Pt) і його солі. Компоненти буфера можуть бути зображені як Pt - COOH -слабодиссоциированная білок-кислота і її сіль Pt -COONa. Pt - COOH ⇔ Pt - COO - H Pt - COONa ⇔ Pt - COO - Na При збільшенні концентрації іонів водню сіль білкувзаємодіє з ними, утворюючи слабодиссоциированную білок-кислоту і нейтральну сіль : Pt - COO - Н --> Pt - COOН З гидроксид-ионами взаємодіє білок-кислота і замістьсильної основи утворюється сіль і вода : Pt - COOН OH - ⇒ Pt - COO - H2O Проте до складу білків входять не лише вільнікарбоксильні групи, але і вільні аміногрупи. Тому зв'язування іонів може відбуватися і по аміногрупі: Pt - NH 3 OH - ⇒ Pt - NH3OH рН плазми крові, створюваного бікарбонатним буфером, можна розрахувати, знаючи кількість розчинених в плазмі крові діоксиду вуглецю ібікарбонатів по рівнянню Гендерсона- Гассельбаха. Фосфатний буфер. Цей буфер має найбільше значення в таких біологічнихрідинах, як мочивши і соки травних залоз. Для крові має невелике значення,оскільки в плазмі фосфатів мало, але нутри клітин він грає істотну роль. Фосфатний буфер cостоит з гідрофосфатних ідигидрофосфатных аніонів (HPO 2 -4 і H2PO4 ). Його буферна дія видно з прикладу: H HPO 2 --4 ⇔ H2PO4 OH - H-2 -2po4 ⇔ HPO4 H2O
Буферні системи мають найважливіше значення для життєдіяльності організмів; вони визначають постійність кислотності різних біологічних рідин (крові, лімфи, міжклітинних рідин). Основні Б. с. організму тварин і людини: бікарбонатна (вугільна кислота і її солі), фосфатна (фосфорна кислота і її солі), білки (їх буферні властивості визначаються наявністю основних і кислотних груп). Білки крові (перш за все гемоглобін, що обумовлює близько 75% буферної здатності крові) забезпечують відносну стійкість ph крові.
12
Буферна
ємкість
- це число моль еквівалентів сильної
кислоти або сильної основи, яку потрібно
додати до 1л буферної системи, щоб
змістити рН на 1.
Буферну
ємкість визначають титруванням.
Формули
обчислення буферної ємкості
За
кислотою: Bк
= 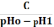
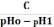 , де
=
4,4
За основою: Bл
=
, де
=
4,4
За основою: Bл
= 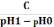
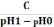 , де
=
8,2
Буферна
ємність залежить від:1)Концентрації
компонентів 2)Співвідношення компонентів.
Найбільшу буферну ємність мають
розчини з однаковою концентрацією
компонентів буферної суміші.
, де
=
8,2
Буферна
ємність залежить від:1)Концентрації
компонентів 2)Співвідношення компонентів.
Найбільшу буферну ємність мають
розчини з однаковою концентрацією
компонентів буферної суміші.
13 Сироватка крові має більшу буферну ємність по кислоті, ніж по основі,тому що вміст в ній спряженої кислоти у вигляді СО2 (близько 1,5 ммоль-екв/л) набагато нижчий ніж вміст спряженої основи у вигляді гідрокарбонат іонів . А з іонами Гідрогену реагують саме гідрокарбонат-іони.
14 Лужний резерв крові - показник функціональних можливостей буферної системи крові; являє собою кількість двоокису вуглецю (в мол), яке може бути зв`язано 100 мл плазми крові, попередньо наведеної в рівновагу з газовим середовищем, у якім парціальний тиск двоокису вуглецю становить 40 мм ртутного стовпа. Кислотно-лужна рівновага сукупність фізико-хімічних і фізіологічних процесів, що обумовлюють відносну постійність водневого показника (ph) внутрішнього середовища організму. У нормі ph крові людини підтримується в межах 7,35—7,47, не дивлячись на вступ в кров кислих і основних продуктів обміну речовин. Постійність ph внутрішнього середовища організму — необхідна умова нормального перебігу життєвих процесів (див.Гомеостаз ) . Значення ph крові, що виходять за вказані межі, свідчать про істотні порушення в організмі, а значення нижче 6,8 і вище 7,8 несумісні з життям. У регуляції постійності ph крові беруть участь буферні системи крові [складаються із слабких кислот і їх солей, утворених сильними підставами, наприклад гемоглобін.
15 Ниркам належить провідна роль у виведенні іонів Н+ з організму. Точна регулювання змісту іонів Н + в позаклітинній рідині полягає не тільки у виділенні їх нирками. Крім цього, в організмі існує ряд численних буферних механізмів, завдяки яким концентрація іонів Н + в рідких середовищах підтримується на нормальному рівні; в них залучені системи крові, органів дихання та процеси, що відбуваються на рівні клітини. Респіраторна регуляція кислотно-основного балансу рідин тіла тісно пов'язана із бікарбонатною буферною системою. Функцією дихальної системи є постачання організму киснем і виведення з нього вуглекислого газу, що утворюється у процесі катаболізму органічних речовин. Вуглекислий газ із тканин потрапляє в еритроцити крові, де фермент карбоангідраза каталізує його реакцію з водою, продуктом якої є карбонатна кислота. Більшість цієї сполуки дисоціює до бікарбонату. Під час виділення вуглекислого газу в легенях рівновага обидвох реакцій зсувається вліво й іони H+ знову включаються у воду.
Завдяки функціонуванню білкової буферної системи, в основному гемоглобінової, транспорт вуглекислого газу майже не призводить до зміни pH крові.
16 Колігативними називають властивості розчинів, що обумовлені тепловим рухом та кількістю кінетичних частинок системи. Відносне зниження тиску насиченої пари розчинника над розчином не залежить від природи розчиненої речовини, а визначається тільки числом частинок у розчині. Такі властивості розчинів називаються колігативними. До колігативних властивостей належать також підвищення температури кипіння та зниження температури замерзання розчину, осмотичний тиск.
17 Осмос - цесамовільна одностороння дифу зія молекул розчинника через напівпроникну мембрану у бік розчину із більшою концентрацією. Напівпроникною називається мембрана, яка пропускає молекули тільки розчинника. Приклади : природні - тваринні та рослинні мембрани клітин, стінки кишечника, стінки судин; штучні - колодій, целофан, желатин, пергамент, стінки глиняної посудини, які заповнені осадовою мембраною. Осмотичний тиск це надмірний гідростатичний тиск, який зупиняє осмос. Осмотична концентрація це концентрація всіх кінетичних частинок розчиненої речовини в розчині. Онкотичний тиск крові це частина осмотичного тиску, яка обумовлена ВМС і становить 0,04атм.
18 Осмотичний тиск крові = 7,7атм.
19 Закон Вант -Гоффа - осмотичний тиск розбавленого розчину неелектроліту дорівнює тому газовому тиску, який чинила би розчинена речовина, знаходячись в газоподібному стані та займаючи об'єм розчину за тієї ж температури. Рівняння осмотичного тиску для неелектролітів: P осм = CRT де С - молярна концентрація в моль/л; R - універсальна газова стала 0,082 л • атм/град • моль;Т - температура за Кельвіном. Для неелектролітів осмотична та молярна концентрації збігаються. Рівняння осмотичного тиску для електролітів: P осм = іCRT, де і - ізотонічний коефіцієнт Вант-Гоффа. Для електролітів осмотична концентрація в і разів більша за молярну: С осм. ел. = і*С
20
Ізотонічний
коефіцієнт Вант-Гоффа -
і - показує, в скільки разів осмотичний
тиск електроліту, осмотична концентрація
електроліту більша, осмотичний тиск та
осмотичну концентрацію неелектроліту,
за однакової молярної концентрації.
і
=
= 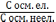
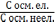 Ізотонічний
коефіцієнт Вант-Гоффа зв'язаний зі
ступенем дисоціації α рівнянням: і = 1 +
Ізотонічний
коефіцієнт Вант-Гоффа зв'язаний зі
ступенем дисоціації α рівнянням: і = 1 +

 (ν
– 1)
де ν
-
число іонів, на яке дисоціює електроліт.
(ν
– 1)
де ν
-
число іонів, на яке дисоціює електроліт.
21 Гемоліз – явище руйнування оболонки еритроцитів при введенні у плазму крові гіпотонічних розчинів, що супроводжується виходом гемоглобіну в плазму ( «лакова» кров). Плазмоліз - явище зморщування еритроцитів при введенні у плазму крові гіпертонічних розчинів. Тургор — напружений стан клітинної стінки, зумовлений тиском на неї цитоплазми зсередини клітини. Розчини з однаковим осмотичним тиском називають ізотонічними. Якщо осмотичний тиск одного розчину більший, ніж іншого, то перший розчин є гіпертонічним, а коли навпаки - то гіпотонічним. Застосування: Гіпертонічні: Застосовується як зовнішньо, так і внутрішньо.У медицині застосовуються 3—10% водяні розчини хлориду натрію, 10—40% водяні розчини глюкози й інші.
Зовнішньо: -При лікуванні гнійних ран, захворюваннях верхніх дихальних шляхів. Розчин завдяки осмотичному впливу сприяє виділенню гною з рани. Розчин має також протимікробну дію. Спосіб застосування: 3-5-10% розчин у вигляді компресів і примочок при лікуванні гнійних ран. -Для ванн, обтирань, полоскань (1-2% розчин при захворюваннях верхніх дихальних шляхів).
Внутрішньо: - Внутрішньовенно — при легеневих, шлункових, кишкових кровотечах, а також для посилення сечовиділення. У вену вводять (повільно) гіпертонічний розчин (10-20 мол 10% розчину). - Для промивання шлунку 2-5% розчин призначають усередину — при отруєнні нітратом срібла, який при цьому перетворюється в нерозчинний і нетоксичний хлорид срібла. - У вигляді клізми (75-100 мол 5% розчину), щоб викликати дефекацію. Ізотонічні Застосування ЛП у вигляді І.р. дозволяє уникнути порушення рівноваги осмосу організму. Особливе значення це має при ін’єкціях, коли розчин уводять в організм, обминувши природні захисні бар’єри — шкіру, слизову оболонку ШКТ.
22 Основною дією препаратів лужних і лужноземельнх металів є осмотична та йонна дія. Осмотичну дію має будь-яка сіль. Значну кількість солей містять біологічні рідини організму. Застосування їх у великих кількостях є найменш небезпечним. Осмотичні сечогінні засоби (маніт, сечовина), підвищуючи осмотичний тиск у канальцях, перешкоджають реабсорбції води. Слід зазначити, що така систематизація не охоплює сечогінних засобів, які впливають на кровообіг у нирках, вона мало орієнтована на механізм дії препаратів.
23 Ізоосмія - відносна постійність осмотичного тиску в рідких середовищах і тканинах організму, обумовлене підтримкою на даному рівні концентрацій речовин, що містяться в них: електролітів, білків і так далі. Нирки, крім виділення кінцевих продуктів обміну речовин беруть участь у регуляції водно-сольового обміну і в підтриманні сталості осмотичного тиску рідин тіла. Залежно від концентрації мінеральних солей у крові і в тканинній рідині змінюється концентрація сечі, яку виділяють нирки, що спричинює зміну осмотичного тиску крові. Цей процес регулюють гуморальні чинники (зміна концентрації солей у крові та відповідна зміна ос мотичного тиску крові) та нервова система. Особливе значення для підтримання осмотичного тиску крові має сталість білкового складу плазми. Осмотичний тиск підтримується за рахунок поступання в організм води і мінеральних солей та їх видалення через видільну систему. Гормон вазопресин забезпечує ізоосмію.
24 Хімічна термодинаміка - це розділ фізичної хімії, у якому вивчаються перетворення енергії в хімічних процесах та енергетичні характеристики речовин. Термодинамічна система - це тіло або сукупність тіл, які перебувають у взаємодії та відокремлені від навколишнього середовища реальною або уявною поверхнею поділу. Залежно від здатності системи обмінюватися з навколишнім середовищем енергією та речовиною розрізняють такі типи систем: - ізольована - це така система, яка не обмінюється з навколишнім середовищем ні речовиною, ні енергією;
- закрита - це система, що обмінюється з навколишнім середовищем енергією і не обмінюється речовиною (штучний супутник);
- відкрита - це система, яка обмінюється з навколишнім середовищем як енергією, так і речовиною (біосфера, живий організм). Система може бути гомогенною та гетерогенною. Гомогенна система складається з однієї фази, а гетерогенна - з кількох фаз (наприклад, лід - вода, вода - толуен тощо). Перший закон термодинаміки 1 формулювання: Енергія не створюється і не зникає. Можливий лише перехід з одного виду енергії в інший в еквіпотенціальній кількості. 2 формулювання: Вічний двигун першого роду неможливий. 3 формулювання: В ізольованих системах сума всіх видів енергії є сталою величиною.
25 Термохімічні рівняння - рівняння хімічних реакцій, в яких наведені значення їх ентальпії та вказаний агрегатний стан реактантів і продуктів реакції. Теплота утворення (перший наслідок закону Гесса) - це тепловий ефект утворення Імоль речовини із простих речовин за 25°С(298 К), 101,3 кПа і дорівнює різниці між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин, узятих з урахуванням стехіометричних коефіцієнтів рівняння реакції: ΔНутв.. = ΣΔНпрод. - ΣΔНвих. Теплота згоряння (другий наслідок закону Гесса) - це тепловий ефект згоряння Імоль речовини до С02 та Н20 і дорівнює різниці між сумою теплот згоряння вихідних речовин та сумою теплот згоряння продуктів реакції, узятих з урахуванням стехіометричних коефіцієнтів рівняння реакції: ΔНсгор. = ΣΔН вих. - ΣΔНпрод.
26 Закон Гесса: тепловий ефект хімічної реакції не залежить від шляху її проходження, а залежить від її початкового та кінцевого стану. Вивчення стану живого організму, як відкритої термодинамічної системи, лежить в основі методу калориметрії - вимірювання кількості тепла, яке виділяється під час різних фізичних, хімічних чи біологічних процесів. Калориметрія біологічних і біохімічних процесів (біокалориметрія) дозволяє кількісно характеризувати енергетичні і теплові ефекти окремих біохімічних реакцій, діяльність клітинних органел і клітин, тканин і органів, організму в цілому.
При калориметричних дослідженнях вимірюються величини теплових потоків від живого об’єкта в навколишнє середовище і розраховується кількість виробленого тепла та тепломісткість організму; вимір тепломісткості знаходять на підставі даних про масу, теплоємність і зміну температури об’єкта. Одиницями виміру тепла є калорія (ккал) чи джоуль (Дж): 1 ккал = 4,187*103 Дж. Питома теплота вимірюється у ккал/кг або Дж/кг; тепловий, потік - у ккал/м чи година Вт/м .
27 Другий закон термодинаміки: 1 формулювання: Теплота не може самовільно переходити від холодного тіла до гарячого не залишаючи змін в навколишньому середовищі. 2 формулювання: Вічний двигун другого роду неможливий, тобто двигун, який би виконував роботу без втрати тепла неможливий. 3 формулювання: всі процеси перетворення енергії відбуваються із розсіюванням енергії у вигляді теплоти. Ентропія – міра невпорядкованості системи; функція системи, яку виміряти неможливо, вимірюють її зміну. Енергія Гіббса або ізобарно - ізотермічний потенціал - це сумарний ефект прояву ентальпійного Н та ентропійного S чинників. Δ G = ΔGпрод. _ Δ Gвих.
Якщо Δ G < 0, то реакція можлива.
Якщо Δ G > 0, то реакція неможлива (іде зворотня реакція).
Якщо Δ G = 0, то система в рівновазі.
28 Всі процеси в природі відбуваються самочинно. Саме 2 закон термодинаміки визначає в якому напрямку рухається та границю передачі тепла і енергії. Енергія характеризується факторами інтенсивності(тиск, темп, поверхневий натяг), фактор ємності(к-сть речовини, потенціал, маса, обєм). Самочинні процеси направленні в сторону вирівнювання фактора інтенсивності в усіх частинах. Тому напрямок процесу і його границя можуть характеризуватися цим фактором лише коли їх значення різні у взаємодіючих тілах.
29 Застосування першого закону термодинаміки до живих систем полягає в тому, що енергія, яка надходить у живі організми з іжею, розподіляється у процесі споживання на дві частини: - виділяється в середовище у вигляді тепла та енергії, що міститься у продуктах життєдіяльності; - відкладається в клітинному матеріалі.
Сума цих двох частин дорівнює внутрішній енергії іжі, що надходить до організму. У біологічних системах процеси здійснюються при постійному тиску, тому тепловий ефект біохімічних реакцій дорівнює зміні ентальпій під час реакції.
Існування живого організму потребує підтримання його у нерівноважному стані, а це неможливо без притоку енергії ззовні. Людина в якості джерела енергії використовує продукти харчування (а саме, хімічну енергію, яка є в цих продуктах). Ця енергія вивільнюється при окисненні речовин, що супроводжується споживанням кисню і виділенням вуглекислого газу. чення різні у взаємодіючих тілах.
НЕ ВПЕВНЕНИЙ ЧИ ПРВАВИЛЬНО:Організм як термодинамічна система має свою специфіку: підвищення ентропії при самочинних процесах за 2 законом термодинаміки НЕ викликає «теплову смерть» організму. Біохімічні процеси які забезпечують життєдіяльність характеризуються інтенсивним протіканням в водних розчинах при постійній температурі і тиску. Досягнення рівноваги можливе і коли енергія Гіббса не дорівнює нулю.
30 Характеристика живого організму з точки зору термодинаміки. - живі організми не є незалежними постачальниками енергії, а лише здійснюють перебудову одних видів енергії в інші. - у біологічних системах процеси здійснюються при постійному тиску, тому тепловий ефект біохімічних реакцій дорівнює зміні ентальпій під час реакції. - Існування живого організму потребує підтримання його у нерівноважному стані, а це неможливо без притоку енергії ззовні. Перетоворення енергії відбувається відповідно до першого і другого закону термомодинаміки але відрізняється низкою специфічних властивостей Це такі:
-
Усі біохімічні процеси в клітині відбуваються за умов значних перепадів концентраціі різних змін об’ємів
-
Необхідною умовою функціонування організму є гомеостаз - сталість внутрішнього середовища незважаючи на зміну зов середовища і перебування клітини в стані справжньої термодинамічної рівноваги можливо лише в стаціонарному стані.
-
Застосування другого закону термодинаміки до живих систем неможливе без урахування впливу біологічних закономірностей так зміна ентропії у біосистемах є другорядним показником
-
Організм є відкритою системою що безперервно обмінюється з навколишнім середовищем як речовинами так і енергією. Його ознакою є: -Високий ступінь складності на всіх рівнях організації
