
Реакции раскрытия кольца
С тех пор, как в 1934 г. Зелинским,. Казанским и Плато была открыта реакция гидрогенолиза циклопентанов, она явилась предметом многих исследований.
Платина - один из
металлов, катализирующих гидрогенолиз
углеводородов. Реакция сопровождается
разрывом связей С-С и образованием
связей С-Н. При гидрогенолизе пятичленных
нафтенов на платиновых катализаторах
может происходить разрыв различных
связей пятичленного цикла. Так, в случае
метилциклопентана образуются н-гексан,
2-метил- и 3-метилпентан:

Относительные скорости гидрогенолиза различных связей пятичленвого кольца зависят от строения исходного углеводорода, свойств применяемого платинового катализатора и условий осуществления реакции.
Поскольку алюмоплатиновый катализатор риформинга бифункционален, следует прежде всего рассмотреть вопрос о роли металлической и кислотной функций катализатора в реакции раскрытия пятичленного кольца. Обнаружен эффект изменения относительных скоростей гидрогенолиза метидциклопентаиа по различным связям кольца в зависимости от условий обработки алюмоплатинового катализатора (0,3% Pt/Al2O3) водородом. Так, если катализатор восстанавливали при 350 °С, то отношение образовавшегося н-гексана к сумме образовавшихся метилпентанов составляло 0,6. Это отношение, однако, увеличивалось до 11, когда обработку катализатора водородом проводили при 550°С. Следовательно, при такой обработке значительно возрастает селективность гидрогеиолиза по связи С-С у атома углерода, связанного с заместителем. Подобный эффект авторы исследований объяснили увеличением электрофильности катализатора и, в связи с этим, изменением механизма реакции гидрогенодиза.
При длительной высокотемпературной обработке в токе водорода (520 °С, 2 МПа, продолжительность 3 недели) промышленного катализатора риформинга (0,6% Pt/Al2O3 + 0,67%С1) меняется не только состав продуктов гидрогенолиза метилциклопентана в сторону значительного преобладания н-гексана, но и резко снижается активность катализатора. Так, скорость образования н-гексана уменьшается на 93%, а скорость образования 2- и 3-метилпентанов - на 98%.
Высокотемпературная обработка в токе водорода (520 °С) и последующее частичное закоксовывание алюмоплатинового катализатора (0,35% Pt/Al2O3) также приводят к изменению состава продуктов гидрогенолиза пятичленных нафтенов.
Независимо от того, каким способом снижают активность металлического компонента алюмоплатинового катализатора в реакции гидрогенолиза, состав продуктов раскрытия кольца метилциклопента во всех случаях меняется в сторону значительного преобладания н-гексана. Подобное явление можно объяснить тем, что реакция раскрытия пятичленного кольца протекает не только на платине, но и на кислотном носителе - хлорированном оксиде алюминия. Кислотно-катализируемая реакция приводит главным образом к получению н-гексана из метилциклопентана, но скорость ее значительно меньше скорости гидрогенолиза этого углеводорода на платине.
Частичная или полная дезактивация металлической функции алюмоплатинового катализатора в реакции гидрогенолиза ведет к значительному повышению роли кислотно-катализируемой реакции раскрытия пятичленного кольца. Были получены данные, подтверждающие, что скорость реакции раскрытия кольца метилциклопентана на таких частично дезактивированных алюмоплатиновых катализаторах соизмеримы со скоростями той же реакции на кислотных носителях для этих катализаторов.
Предложен механизм кислотно-катализируемой реакции раскрытия пятичленного кольца. Раскрытие кольца метилциклопентана происходит в результате прямого протонирования циклической структуры на кислотных участках катализатора. Первой стадией реакции является образование вторичного ациклического карбкатиона, который затем, в результате отщепления протона, превращается в гексен:
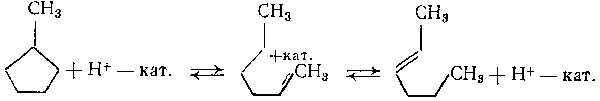
Гидрирование н-гексена на металлических участках приводит к получению н-гексана. Приведенная выше реакция обратима и может привести к образованию метилциклопентана из гексена.
Каталитический риформинг в промышленных условиях связан с применением высоких температур и воздействием на алюмоплатиновый катализатор серусодержащих соединений и отложений кокса, что, как было показано выше, приводит к дезактивации платины в реакции гидрогенолиза пятичленных нафтенов. Поэтому платина может проявлять значительную активность в этой реакции лишь в начальной стадии эксплуатации алюмоплатинового катализатора. В дальнейшем же раскрытие пятичленного кольца протекает главным образом как кислотно-катализируемая реакция.
ПРЕВРАЩЕНИЯ ПАРАФИНОВ
Реакции дегидроциклизации
Дегидроциклизация парафинов ведет к образованию как ароматических углеводородов,так и циклопентанов:
н-С 6Н1 С6Н6 + 4Н2
н-С6Н14 С5Н9СН3 + Н2
Первая из этих реакций - каталитическая ароматизация, получившая также название С6-дегидроциклизация, исходя из числа атомов углерода, входящих в образующийся цикл. Вторая реакция, в результате которой получаются пятичленные нафтены, известна как С5-дегидроциклизация. В условиях каталитического риформинга С5-дегидроциклизация также ведет к превращению парафинов в ароматические углеводороды, так как образующиеся циклопентаны подвергаются дегидроизомеризации.
Реакция С5-дегидроциклизации была открыта в 1936 г. одновременно в трех советских лабораториях в результате исследований, проведенных под руководством Казанского и Плата, Мовдавского, а также Каржева. В 1954 г. Казанским и Либерманом впервые была показана возможность успешного осуществления реакции С5-дегидроциклизации парафинов в присутствии платиновых катализаторов. Реакции дегидроциклизации парафинов были предметом многочисленных исследований.
Ниже мы рассмотрим поведение парафинов при ароматизации в условиях каталитического риформинга.
Химическое равновесие. Неоднократно проводились термодинамические расчеты с тем, чтобы установить, какие условия осуществления процесса каталитического риформннга благоприятны для протекания реакций ароматизации парафинов. Примером может служить реакция ароматизации н-гептана. Очевидно, высокие температуры и низкие давления способствуют более полному превращению н-гептана в толуол. При обычных температурах каталитического риформинга (на входе в реакторы 500 °С) степень превращений н-гептана в толуол, равная 95%, может быть достигнута при давлениях, не превышающих 1,5-1,7 МПа. При этом изменение молярного отношения водород: углеводород в пределах 4 : 1 до 10 : 1 не оказывает существенного влияния на степень превращения н-гептана в толуол.
Менее благоприятно равновесие для реакции ароматизации н-гексана, вследствие чего в этом случае процесс следует проводить при значительно более низких давлениях.
Кинетика реакции. Наиболее полно исследована кинетика каталитического риформинга н-гептана. Была изучена кинетика превращений этого углеводорода на алюмоплатиновом катализаторе АП-64 при 470-510 "С под давлением 4 МПа. Молярное отношение водород:углеводород изменяли в пределах от 2,5 до 24, а степень превращения н-гептана- от 15 до 80%.
В этих условиях н-гептан подвергался ароматизации, изомеризации и гидрокрекингу. Продукты реакции состояли из газообразных углеводородов (C1-C4), пентанов, гексанов, изомеров гептана (главным образом, метилгексанов), толуола и небольших количеств других углеводородов. Было показано, что скорость превращения н-гептана в условиях каталитического риформинга, как скорость дегидрирования циклогексана, выражается уравнением :
ri = ki Prn./( PJ)
где ki - наблюдаемая константа скорости i-й реакции; . PJ - сумма парциальных давлений углеводородов в реакционной смеси.
Приведенное уравнение справедливо при условии равенства коэффициентов адсорбции всех углеводородов и пренебрежении адсорбцией водорода.
Для оценки влияния температуры процесса интересно сопоставить значения энергий активации двух конкурирующих реакций - ароматизации и гидрокрекинга н-гептана, поскольку относительные их скорости предопределяют селективность ароматизации углеводорода. При риформинге на монометаллическом алюмоплатиновом катализаторе энергии активации реакций ароматизации и гидрокрекинга н-гептана соответственно равны 137,3 и 130,6 кДж/моль Близкие данные получены на биметаллическом алюмоплатинорениевом катализаторе. Для реакции ароматизации н-гептана значение энергии активации составляет 149,1 кДж/моль, а для гидрокрекинга 147,8 кДж/моль. Исходя из того, что энергии активации для реакций ароматизации и гидрокрекинга мало различаются, нельзя ожидать существенного изменения относительной их скорости при повышении или понижении температуры процесса риформинга.
Скорость ароматизации нормальных парафинов зависит от числа углеродных атомов в молекуле, и меняется в следующих пределах (мас.%):
|
С6 0-5 |
С7 25-45 |
С8 30-50 |
С9 55-65 |
Следовательно, выход ароматических углеводородов, а значит и скорость ароматизации парафинов возрастают с увеличением их молекулярной массы.
На основании результатов, полученных при риформинге н-парафинов на биметаллическом платинорениевом катализаторе сделан вывод, что при переходе к углеводороду более высокой молекулярной массы скорость реакции ароматизации увеличивается в 1,6-2 раза. Следует, однако, учесть, что скорости ароматизации н-гексана и н-гептана различаются в значительно большей степени. В частности, выше было показано, что в одинаковых условиях процесса выход ароматических углеводородов из н-гептана примерно в 8-10 раз больше.
Селективность, В условиях каталитического риформинга н-парафины, подвергаясь изомеризации, превращаются главным образом в малоразветвленные изомеры, которые, как и исходные углеводороды, способны подвергаться ароматизации и гидрокрекингу. В этой связи можно условно принять, что количество прореагировавшего парафина отвечает суммарному количеству, превращенному в продукты ароматизации (Ар) и гидрокрекинга (Г), а селективность (S) ароматизации углеводорода выразить следующим образом:
S = (Ap*l00)/(Ap + Г)
В качестве критерия селективности можно также воспользоваться отношением констант скоростей ароматизации и гидрокрекинга.
Данные о влиянии температуры на селективность ароматизации парафинов противоречивы. Как это уже отмечено выше, исследование кинетики риформинга н-гептана на разных катализаторах показало, что селективность ароматизации должна мало зависеть от температуры.
Увеличение температуры процесса хотя и оказывает положительное влияние на селективность ароматизации парафинов, однако достигаемый при этом эффект невелик и, следовательно, не может играть значительной роли при промышленном осуществлении каталитического риформинга.
Давление - другой параметр процесса, от которого зависит селективность превращения парафинов. При постоянстве других условий каталитического риформинга изменение давлений почти не оказывает влияния на степень превращения парафинов. Меняются только относительная скорость реакций дегидроциклизации и гидрокрекинга, следствием чего является изменение селективности процесса. Снижение давления способствует увеличению селективности реакции дегидроциклизации, иллюстрацией чему служат данные об изменении молярных выходов первичных продуктов каталитического риформинга н-гептана (в % на 100 моль превращенного гептана):
|
Давление, МПа |
Изомеры С7 |
Ароматические углеводороды и нафтены |
Углеводороды C1-С6 |
|
3,5 |
52 |
10 |
30 |
|
1,4 |
53 |
22 |
18 |
Уменьшение давления с 3,5 до 1,4 МПа при 468 °С ведет к увеличению молярной селективности ароматизации н-гептана с 22 до 42%, а при 496 °С - с 27 до 46%. Следовательно, при риформинге на алюмоплатиновом катализаторе снижение давления в 2,5 раза приводит к увеличению селективности реакции ароматизации гептана в 1,7-1,9 раза. Одновременное повышение температуры до 525 °С и понижение давления до 0,7 МПа при каталитическом риформинге н-гептана позволяет довести массовый выход толуола до 62 % на прореагировавший углеводород.
Сопоставляя данные о влиянии температуры и давления на селективность ароматизации парафинов, можно прийти к заключению, что решающую роль играет давление, при котором проводят процесс.
При каталитическом риформннге н-парафинов в одинаковых условиях селективность ароматизации зависит от числа углеродных атомов в молекуле и растет в ряду:
н-гексан < н-гептан < н-октан < н-нонан
Практическое значение имеет факт низкой селективности и малой скорости ароматизации н-гексана в обычных условиях каталитического риформинга, что во многих случаях делает нецелесообразным включение этого углеводорода и его изомеров в состав сырья для этого процесса.
Механизм ароматизации парафинов. Ароматизация парафинов на бифункциональных алюмоплатииовых катализаторах в условиях риформинга - процесс сложный, включающий ряд последовательно и параллельно идущих реакций. Наряду с реакциями С5 и С6-дегидроциклизации, катализируемыми платиной, протекают также реакции циклизации под действием кислотного компонента катализатора. Как уже упоминалось, образующиеся циклопентаны превращаются в ароматические углеводороды, подвергаясь дегидроизомеризации.
Реакции С5- и С6-дегидроциклизации протекают параллельно и независимо
Платина катализирует не только реакцию С5-дегидроциклизации н-гексана в метилциклопентан, но также его гидрогенолиз (см. выше) и взаимное превращение изомеров гексана. Поскольку эти реакции обратимы, предполагают, что они протекают с образованием одного и того же циклического переходного комплекса (ЦПК) на поверхности платины:
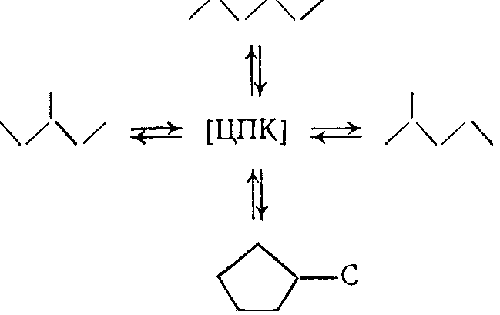
Для иллюстрации ниже приведены некоторые из возможных структур промежуточных циклических соединений:
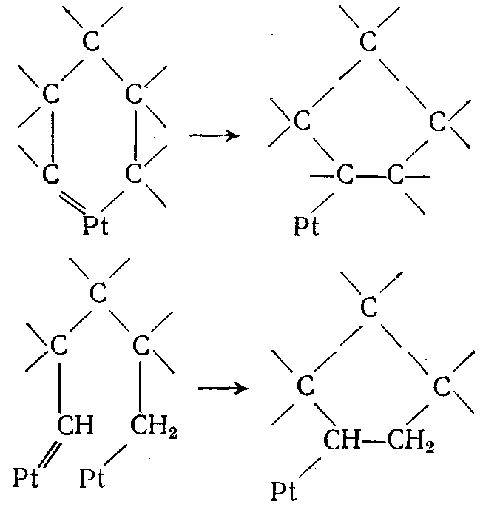
Продукты каталитического реформинга н-гексана содержат гексены, а также незначительные количества других непредельных углеводородов. Дегидрирование парафинов до олефинов на алюмоплатиновых катализаторах протекает с большой скоростью. В условиях каталитического риформинга концентрация олефинов соответствует равновесной. Это обстоятельство имеет существенное значение, поскольку олефины играют важную роль в качестве промежуточных продуктов в реакциях каталитического риформинга, в частности в реакциях ароматизации парафинов.
Один из возможных путей ароматизации н-парафинов на алюмоплатиновых катализаторах -последовательное дегидрирование по механизму, аналогичному ранее установленному для той же реакции на оксидных катализаторах. Так, схему ароматизации н-гексана можно представить следующим образом:
н-гексан н-гексен гексадиен гексатриен циклогексадиен бензол.
Гексатриен подвергается циклизации, а образующийся циклогексадиен дегидрируется и превращается в бензол. Возможность протекания реакции по такому механизму в процессе каталитического риформинга вызвала возражения, которые основаны на том, что в условиях этого процесса равновесная концентрация гексадиенов и гексатриенов весьма мала, а возможные их превращения изучены недостаточно,
Парафины подвергаются также дегидроциклизации на катализаторах риформинга по бифункциональному механизму: дегидрирование на платине, циклизация образовавшихся непредельных углеводородов на кислотных участках носителя Наглядное подтверждение реальности такого механизма: платинированный уголь не катализирует реакцию дегидроциклизации н-гептана, если к последнему добавить 0,01% тиофена (по массе, в пересчете на серу), но сохраняет высокую дегидрирующую способность. Концентрация гептенов не меняется при добавлении тиофена к гептану и близка к равновесной в примененных условиях. Не подвергается дегидроциклизации н-гептан при пропускании над оксидов алюминия. Однако реакция дегидроциклизации протекает, если н-гептаи с указанной выше примесью тиофена пропускают над смесью платинированного угля и оксида алюминия. Суммарный выход толуола и алкилциклопентанов составил 70% от выхода, полученного при дегидроциклизации чистого н-гептана (без примеси тиофена) над платинированным углем.
Поскольку скорость дегидрирования парафинов до олефинов на платине велика, лимитирующей стадией бифункциональной реакции дегидроциклизации должна быть циклизация олефина на кислотных центрах алюмоплатинового катализатора. Поэтому увеличение кислотности алюмоплатинового катализатора, а следовательно, и содержания в нем галогена, должно способствовать увеличению скорости ароматизации парафинов.
Имеются прямые доказательства того, что промотированный галогенами оксид алюминия катализирует циклизацию непредельных углеводородов.
Циклизация олефинов протекает .на кислотных центрах оксида алюминия, однако механизм реакции пока еще не установлен. Предполагают, что более предпочтительным представляется механизм реакции, который учитывает наличие в оксиде алюминия не только кислотных, но и основных центров. Реакция циклизации протекает по согласованному механизму, включающему протонирование двойной связи кислотным центром и одновременный отрыв протона от атома углерода в цепи под влиянием основного центра. Образование цикла происходит в результате взаимодействия двух полярных центров (А - кислотный центр, В - основной центр).
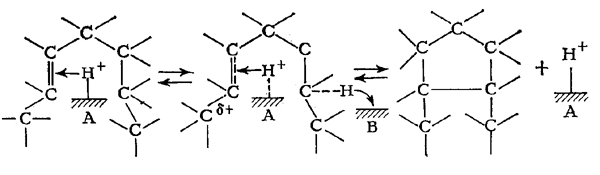
Исследования в области ароматизации парафинов на платиновых катализаторах риформинга проводили главным образом в условиях, значительно отличающихся от применяемых в промышленном процессе. Поэтому полученные результаты, интересные с научной точки зрения не позволяют прийти к однозначным выводам о роли и значении разных механизмов ароматизации парафинов в каталитическом риформинге. Однако для этой цели можно в известной мере воспользоваться данными об изменении каталитических свойств, а следовательно, и относительных скоростей реакций, под влиянием некоторых факторов, связанных с условиями эксплуатации платиновых катализаторов риформинга.
С целью подавления активности катализаторов риформинга в реакциях гидрогенолиза углеводородов их подвергают осернению (обработке серусодержащими соединениями), что способствует улучшению их селективности и стабильности. Как было показано выше, при каталитическом риформинге н-гексана на неосерненном катализаторе 0,6% Pt/ -Al2O3 первичными продуктами реакции являются бензол и метилциклопентан, а реакции С5- и С6-дегидроциклизации протекают параллельно. Иначе проходит реакция образования бензола на том же катализаторе, но подвергнутом осеряению. Кинетические исследования показали, что в этом случае реакция является последовательной:
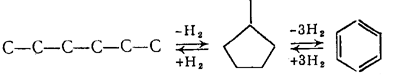
Поскольку скорость реакции дегидроциклизации возрастала с повышением кислотности алюмоплатинового катализатора (в результате дополнительного хлорирования), был сделан вывод, что реакция протекает по бифункциональному механизму.
При эксплуатации в промышленных условиях катализаторы риформинга содержат те или иные количества кокса, так как самая большая скорость коксообразования отмечается в начальный период их работы. При частичной дезактивации алюмоплатинового катализатора в результате коксоотложения, платина теряет свою активность в реакциях гидрогенолиза и изомеризации. Снижается также активность катализатора в реакциях дегидроциклизации парафинов. Однако, платина сохраняет высокую дегидрирующую способность. Был сделан вывод, что при риформинге на частично дезактивированном катализаторе состав продуктов реакции определяется главным образом теми превращениями углеводородов, которые протекают с участием кислотных центров катализатора. Следовательно, в этих условиях реакция дегидроциклизации парафинов протекает в основном по бифункциональному механизму.
О роли такого механизма реакции можно также судить но специфическому действию азотсодержащих соединений на каталитические свойства алюмоплатинового катализатора. Органические соединения азота в условиях риформинга реагируют с образованием аммиака. Адсорбируясь на кислотных центрах и блокируя их, аммиак .подавляет все реакции, протекающие с участием кислотных центров катализатора, в том числе и реакции дегидроциклизации парафинов. Так, добавление к н-нонану диэтиламина (0,2% в пересчете на азот) приводит к снижению степени превращения нонана в ароматические углеводороды с 63 до 24%. При этом дегидрирующая активность катализатора полностью сохраняется, что подтверждено испытанием катализатора в реакции дегидрирования метилциклогексана. Следовательно, при отравлении катализатора аммиаком дезактивируется только его кислотная функция, что и обусловливает резкое снижение активности катализатора в реакции дегидроциклизации парафинов
Таким образом, сопоставление и анализ имеющихся данных позволяет заключить, что в промышленных условиях каталитического риформинга парафины подвергаются дегидроциклизации главным образом по бифункциональному механизму.
Реакции изомеризации
Промышленные процессы изомеризации парафинов осуществляются в условиях, которые позволяют получать высокооктановые компоненты автомобильных бензинов В отличие от этих процессов кат. риформинг включает изомеризацию в качестве одной из реакций парафинов, и проводится она в других условиях. Характерные для него высокие температуры термодинамически неблагоприятны для получения сильноразветвленных парафинов с высоким октановым числом.
Гидрогенолиз и гидрокрекинг.
Реакции гидрогенолиза, как и реакции гидрокрекинга, приводят к превращению парафинов в подобные же, но более низкомолекулярные углеводороды. Однако, если реакцию гидрогенолиза катализируют металлические центры катализатора ряформинга, то расщепление углеводородов при гидрокрекинге происходит на кислотных центрах.
При гидрогенолизе может происходить разрыв любых С-С связей в молекулах гексанов. Содержание метана в продуктах реакции значительно возрастает с увеличением степени разветвления изомеров гексана, а следовательно с увеличением числа метальных групп. Очевидно, в этой реакции значительную роль играет разрыв связей С-С, расположенных на концах углеродных цепей гексанов.
Схема гидрогенолиза этана может быть представлена следующим образом:
С2Н5 С2Н5адс + Надс С2НХадс + аН2
C2HХ С фрагменты (под воздействием водорода) СН4
Адсорбция атомов
углерода на соседних металлических
центрах сопровождается разрывом связей
С-Н. Дальнейшая дегидрогенизация атомов
углерода приводит к образованию кратных
связей С-С и в конечном счете их разрыв.
Образующиеся фрагменты подвергаются
гидрированию в метан. Возможно, при
гидрогенолизе более высокомолекулярных
парафинов образуются несколько иные
промежуточные соединения, например
типа 1,1,3-диадсорбированных соединений:
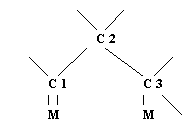
В этом промежуточном соединении может происходить разрыв связей С2-С3, но значительно более предпочтителен разрыв связи C1-С3
При справедливости такого механизма может происходить зауглероживание металлических центров платиновых катализаторов риформинга, что и подтверждается практикой.
При реакциях гидрокрекинга изомерных гексанов метан образуется в весьма малых количествах, и, следовательно, периферийные связи С-С молекул почти не расщепляются. Например, в случае 2,3-диметилбутана - гидрокрекинг этого углеводорода приводит в основном к получению пропана, при гидрогенолизе же образуется главным образом метан Хотя реакции гидрогенолиза играют весьма ограниченную роль в кат.риформинге, все же они идут, особенно в жестких условиях процесса.
Гидрокрекинг протекает в данном случае по бифункциональному механизму:
1) дегидрирование н-парафина в н-олефин на металлическом центре катализатора;
2) адсорбция н-олефина на кислотных центрах катализатора с образованием вторичного карбкатаона;
3) превращение вторичного в более стабильный третичный, либо крекинг с образованием меньшего иона карбония и олефина;
4) изомеризация н-олефина в изоолефин;
5) гидрирование образовавшихся олефинов (С3, С4) на металлических центрах катализатора в соответствующие парафины.
Подтверждением того, что процесс гидрокрекинга на катализаторах риформинга представляет собой бифункциональный катализ, является увеличение его скорости с повышением кислотности катализатора за счет галогенов. Поскольку продукты гидрокрекинга - предельные углеводороды, дезактивация катализаторов происходит значительно медленнее, чем при кат.крекинге. В соответствии с механизмом, метан и этан могут образовываться лишь в небольших количествах.
ОТНОСИТЕЛЬНЫЕ СКОРОСТИ РЕАКЦИЙ КАТАЛИТИЧЕСКОГО РИФОРМИНГА
И ИХ РОЛЬ В ПРОЦЕССЕ
Химия каталитического риформинга предопределяется свойствами применяемых катализаторов:
1) наличием у катализаторов двух функций - металлической и кислотной,
2) независимостью действия этих функций.
Ряд важнейших реакций каталитического риформинга протекает по бифункциональному механизму, в соответствии с которым отдельные стадии одной и той же реакции идут на металлических или кислотные центрах. Металл катализирует реакции дегидрирования парафинов а олефины, циклопарафинов в циклоолефины и шестичленных нафтенов в ароматические углеводороды. Непредельные углеводороды (продукты изомеризации и гидрокрекинга), мигрирующие с кислотных центров на металлические, подвергаются на них гидрированию.
На кислотной функции, осуществляемой носителем, происходит изомеризации олефинов, их циклизация и гидрокрекинг, а также превращение пятичленных циклоолефинов в шестичленные. Все эти реакции протекают по карбкатионному механизму. Таким образом олефины и циклоолефины являются важнейшими промежуточными продуктами реакции.
Согласно схеме реакций риформинга, реакции, представленные параллельно оси абсцисс, протекают на кислотных центрах, а изображенные параллельно оси ординат - на металлических центрах.
 Рис.
6. Схема реакций каталитического
риформинга
Рис.
6. Схема реакций каталитического
риформинга
Схема достаточно хорошо выражает ход бифункциональных реакций риформинга, однако она не учитывает в полной мере независимость действия металлической и кислотной функций катализатора и, следовательно возможность протекания всех стадий одной и той же реакции на металлических или кислотных центрах. Такое исключение делается только для реакции дегидрирования шестичленных нафтенов, которая полностью протекает на металлических центрах. Однако реакциям дегидродроциклизации парафинов проходит не только по бифункциональному механизму, но и монофункционально - на металле. Гидрогенолиз парафинов также протекает на металлических центрах. С другой стороны, кислотная функция катализирует размыкание кольца пятичленных нафтенов. Должны быть приняты во внимание также реакции изомеризации и гидродеалкилирования ароматических углеводородов, имеющих немаловажное значение.
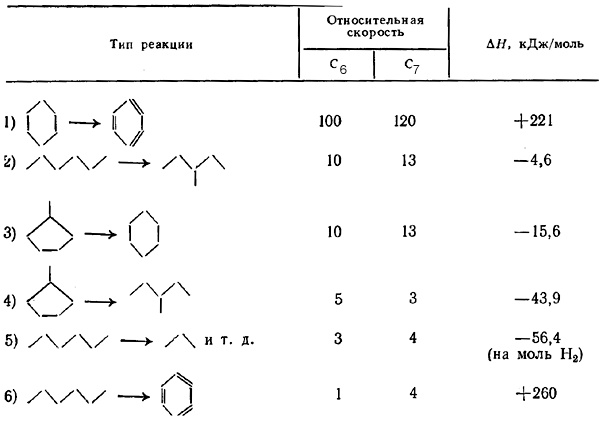
С наибольшей скоростью протекают реакции, дегидрирования шестичленных нафтенов в ароматические углеводороды, что приводит к быстрому установлению равновесия. Реакции изомеризации пятичленных нафтенов в шестичленные, а также парафинов проходят тоже с достаточно большими скоростями. К числу наиболее медленно протекающих реакций относятся реакции дегидроциклизации парафинов. Основной путь повышения как скорости, так и селективности реакций дегидроциклизации заключается в снижении давления.
Данные об относительных скоростях и тепловых эффектах реакций риформинга приведены в таблице.
Таблица 3. Относительные скорости и тепловые эффекты реакций каталитического риформинга
КАТАЛИЗАТОРЫ РИФОРМИНГА
Алюмомолибденовый катализатор (МоО3/Al2O3) был первым катализатором риформинга, нашедшим промышленное применение. Попытки использования других оксидных катализаторов (Cr2O3/Al2O3, CoO-MoO3/Al2O3) к успеху не привели.
Алюмомолибденовый катализатор, как и современные катализаторы риформинга, катализирует реакции-ароматизации, изомеризации и гидрокрекинга углеводородов. Однако селективность его в реакциях ароматизации, особенно парафинов, значительно ниже, а скорость закоксовывания намного больше. Тем не менее эти не явилось препятствием для промышленного использования во время второй мировой войны риформинга на алюмомолибденовом катализаторе, так как процесс служил для производства толуола и компонентов авиационных бензинов.
Были проведены обширные исследования, в которых было не только изучено каталитическое действие платины на разные углеводороды, но и показана практическая ее ценность как ароматизующего катализатора. Однако только в конце 40-х годов, когда возникла потребность в экономичном процессе каталитического риформинга для улучшения качества автомобильных бензинов, стали впервые применять более эффективный катализатор - платиновый. На протяжении последующих десяти лет платиновые катализаторы вытеснили оксидные, а широкие исследования привели к созданию разных их модификаций для процесса каталитического риформинга.
Дороговизна платины предопределила малое ее содержание в промышленных катализаторах риформинга, а следовательно, необходимость весьма эффективного ее использования. Этому способствовало также применение в качестве носителя оксида алюминия, который давно был известен как лучший носитель для катализаторов ароматизации. Важно было превратить алюмоплатиновый катализатор ароматизации в бифункциональный катализатор риформинга, на котором протекал бы весь комплекс реакций, рассмотренных в предыдущей главе. Для этого следовало придать носителю необходимые кислотные свойства, что было достигнуто путем промотирования оксида алюминия галогенами (фтором, хлором).
На первом этапе промышленного осуществления процесса предпочитали работать на фторированном алюмоплатиновом катализаторе.
При применявшейся технологии концентрация водяных паров в зоне катализа была велика, а потому для снижения потерь галогена (в результате отщепления от катализатора) целесообразнее было применять фторированный катализатор поскольку фтор прочно связан с катализатором.
Дальнейшее совершенствование технологии каталитического риформинга, в частности удаление из сырья каталитических ядов и его обезвоживание, позволили перейти к использованию более эффективных алюмоплатиновых катализаторов, промотированных хлором. Преимущество хлорированных катализаторов - возможность регулирования содержания хлора в катализаторах, а следовательно, и уровня их кислотности, непосредственно в условиях эксплуатации
Последнее поколение катализаторов риформинга отличается тем, что наряду с платиной, содержат один или несколько других металлов. Для таких катализаторов характерна высокая стабильность в условиях реакционного периода, что в конечном счете обеспечивает возможность получения более высоких выходов как высокооктановых бензинов риформинга, так и ароматических углеводородов.
