
Билет 3. Квантовые числа, атомные орбитали
.docx
Квантовые числа.
В квантовой
механике доказывается, что уравнению
Шредингера (2.1) удовлетворяют собственные
функции
 ,
определяемые
тремя квантовыми числами: главным n,
орбитальным
l
и магнитным
ml.
,
определяемые
тремя квантовыми числами: главным n,
орбитальным
l
и магнитным
ml.
Квантовые числа электронов
Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (n = 1,2,3, ...). Под главным квантовым числом, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0,1, ..., n - 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l 0 1 2 3 4 Буквенное обозначение s p d f g
В этом случае говорят о s-, р-, d-, f-, g-состояниях электронов, или о s-, р-, d-, f-, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т.е. область пространства, в которой наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
![]()
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна
Главное квантовое число n, согласно (2.2), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: n = 1, 2, 3,…
Из решения уравнения
Шредингера вытекает, что момент
импульса
(орбитальный момент) электрона квантуется,
т.е. не может быть произвольным, а
принимает дискретные значения,
определяемые формулой
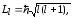 где l
- орбитальное квантовое число,
которое при заданном n
принимает
значения l
= 0, 1,…,
(n-1).
где l
- орбитальное квантовое число,
которое при заданном n
принимает
значения l
= 0, 1,…,
(n-1).
При этом проекция вектора момента импульса электрона Llz на направление z внешнего магнитного поля принимает квантованные значения, кратные ћ: Llz= ћml, где ml – магнитное квантовое число, которое при заданном l может принимать значения ml = -l, -l+1,…, -1, 0, +1,…, l-1, l, т.е. всего 2l+1 значений.
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом n на 2l+1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено голландским физиком и по его имени называется эффектом Зеемана. Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка.
Хотя энергия
электрона (2.2) и зависит только от главного
квантового числа n,
но каждому собственному значению En
(кроме E1)
соответствует несколько собственных
функций
 ,
отличающихся значениями l
и ml.
Следовательно, атом водорода может
иметь одно и то же значение энергии,
находясь в нескольких различных
состояниях. Число состояний, соответствующих
данному n
равно
,
отличающихся значениями l
и ml.
Следовательно, атом водорода может
иметь одно и то же значение энергии,
находясь в нескольких различных
состояниях. Число состояний, соответствующих
данному n
равно 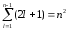 . (2.3)
. (2.3)
Квантовая механика отказывается от классического представления об электронных орбитах, а каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Электрон при своем движении как бы “размазан” по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. При этом квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве. Это облако в атоме с соотнесенными ему квантовыми числами называется атомной орбиталью (АО).
Для графического отображения АО наиболее распространена т. наз. граничная поверхность постоянного уровня │ψ│, в пределах которой сосредоточено практически все (~95%) зарядовое облако. Знаками + и - (или штриховкой) дополнительно отмечают, какой знак имеет АО в данной области. Однако смысл имеют не знаки АО сами по себе, а чередование знаков для системы АО при описании молекулярных орбиталей.
Ниже изображены 1s и одна из 2p-орбиталей. При этом цифра в обозначении орбитали - квантовое число n, а латинские буквы s, p, d, f,… соответствуют орбитальному числу l = 1, 2, 3, 4,…. 1s-орбиталь обладает необходимой для атома сферической симметрией, её внешняя граница является шаром. 2p-орбиталь имеет форму гантели. Три р-орбитали ориентируются по трем взаимно перпендикулярным осям координат (x, y, z) и обозначаются соответственно 2px, 2py, 2pz. Это соответствует трем значениям квантового числа ml = -1, 0, +1.


|
|
|
Для d-орбиталей
(l
= 2) магнитное
квантовое число может принимать пять
значений: ml
= -2, -1, 0, +1,
+2, а сами электронные d-облака
имеют более сложные формы, две из которых
изображены ниже.
Кроме формы орбитали
диаграмма
радиального распределения электронной
плотности
используется для отражения областей
максимальной вероятности нахождения
электрона в зависимости от расстояния
до атомного ядра R.
Из диаграммы видно, что расстояние пиков
зависит от значения главного квантового
числа. Чем оно больше, тем на большем
расстоянии от ядра находится область
максимальной вероятности нахождения
электрона, принадлежащего соответствующей
орбитали. Кроме того, при переходе к
уровню с более высоким значением главного
квантового числа на орбиталях одного
и того же типа (например 1s
и 2s)
появляется дополнительный участок с
вероятностью пребывания электрона,
равной нулю. В этом месте пространства
происходит смена знака волновой функции
на противоположный.
