
- •Часть 2
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •1) В кислой среде реакция протекает по уравнению
- •Электродные потенциалы. Влияние внешних факторов на величину электродного потенциала
- •Направление окислительно-восстановительных реакций
- •Задания
- •Гальванический элемент. Схема гальванического элемента. Токообразующая реакция. Эдс гальванического элемента
- •Задания
- •Электролиз. Законы фарадея
- •Задания
- •Коррозия металлов и методы защиты от коррозии
- •Задания
Электродные потенциалы. Влияние внешних факторов на величину электродного потенциала
Каждая окислительно-восстановительная полуреакция характеризуется определенным окислительно-восстановительным потенциалом. В стандартных условиях и концентрации потенциалопределяющих частиц равной 1 моль/л, его называют стандартным электродным потенциалом (Е0, В). Для многих окислительно-восстановительных систем они определены и сведены в таблицу (см. приложение).
Величина электродного потенциала зависит от природы и концентрации потенциалопределяющих частиц в растворе, температуры и рН среды . Эта зависимость выражается уравнением Нернста:
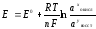 .
(1)
.
(1)
13
В этом уравнении
Е
– электродный потенциал (В); Е0-
стандартный электродный потенциал (В);
R
= 8,31
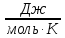 -универсальная газовая постоянная;
Т-температура
(К); n
– число моль электронов в полуреакции;
F=96500Кл–число
Фарадея; aокисл-активность
окисленной формы потенциалопределяющих
частиц (моль/л); aвосст
– активность
восстановленной формы потенциалопределяющих
частиц (моль/л).
-универсальная газовая постоянная;
Т-температура
(К); n
– число моль электронов в полуреакции;
F=96500Кл–число
Фарадея; aокисл-активность
окисленной формы потенциалопределяющих
частиц (моль/л); aвосст
– активность
восстановленной формы потенциалопределяющих
частиц (моль/л).
Введем несколько упрощений:
1) при стандартной
температуре 298К и переходе к десятичным
логарифмам, получим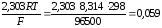 В;
В;
2) для разбавленных растворов активности с достаточным приближением могут быть заменены концентрациями (aокисл=[окисл], aвосст =[восст]). В результате для стандартной температуры уравнение принимает следующий вид:
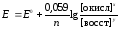 ,
(2)
,
(2)
где «х» и «y» коэффициенты перед окисленной и восстановленной формами потенциалопределяющих частиц в ОВ-полуреакции.
Например, для полуреакции окисления ионов Mn2+
Mn2++4H2O -5 ē = MnO4- + 8H+ Е0=1,507 В
слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, поэтому ур. (2) для стандартной температуры будет иметь следующий вид:
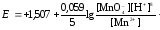
Электродный потенциал служит мерой окислительно-восстановительной способности веществ. Чем меньше значение Е0, тем большими восстановительными свойствами обладает вещество. И, наоборот, чем больше Е0, тем выше его окислительные свойства.
14
Например, перманганат KMnO4 является окислителем, но в зависимости от кислотно-щелочности среды он может проявлять различные окислительные свойства:
а) в кислой среде
MnO4-
+ 8H++
5 ē
Mn2+
+ 4H2O
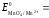 1,507
В
1,507
В
б) в нейтральной среде
MnO4-
+ 2H2О+
3 ē
MnО2
+ 4OН-
 0,6
В
0,6
В
в) в щелочной среде
MnO4-
+ ē
MnO42-
 0,56 В
0,56 В
В кислой среде Е0 больше, следовательно, в кислой среде MnO4- проявляет более сильные окислительные свойства.
Пероксид водорода H2O2, имеющий в своем составе кислород в промежуточной степени окисления (-1), может проявлять как окислительные, так и восстановительные свойства.
Восстановление H2O2 протекает по реакциям:
H2O2
+ 2H+
+ 2
ē = 2H2O
 1,776B
(кислая среда)
1,776B
(кислая среда)
H2O2
+ 2
ē = 2OН-
 0,88B
(щелочная среда)
0,88B
(щелочная среда)
Окисление H2O2 происходит по реакци:
H2O2
- 2
ē = О2
+ 2Н+
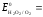 0,682B
0,682B
