
- •II. Молекулярная физика и термодинамика
- •6. Основы молекулярно-кинетической теории
- •6.2. Основное уравнение молекулярно-кинетической теории идеального газа.
- •6.5 Распределение максвелла
- •6.6 Свойства функции распределения максвелла
- •6.7 Средняя и среднеквадратичная скорости молекул
- •6.8 Распределение больцмана
- •6.9 Понятие о числе степеней свободы. Распределение энергии по степеням свободы
- •7. Основы термодинамики
- •7.1 Первое начало термодинамики
- •7.2 Работа, совершаемая при изменении объёма системы
- •7.4 Изопроцессы
- •7.5.1 Изотермический процесс
- •7.5.2 Изохорический процесс
- •7.5.3 Изобарический процесс
- •7.6 Теплоёмкость идеального газа
- •7.7 Адиабатический процесс
- •7.8 Тепловая машина. Цикл карно
- •7.9 Энтропия. Второе начало термодинамики
- •7.10 Статистическая интерпретация энтропии
- •7.11 Молекулярно-кинетическая теория и термодинамика
7.2 Работа, совершаемая при изменении объёма системы
Вновь рассмотрим замкнутый сосуд с
поршнем, внутри которого находится
некоторое количество газа. Пусть сосуд
находится внутри значительно большей
макросистемы, также представляющей
собой газ. Температура Тгаза во
всех точках объёма сосуда о динакова.
Площадь поршняS.
динакова.
Площадь поршняS.
Газ, находящийся в сосуде, давит на поршень с силой F, под действием которой поршень переместится наdx. При этом газ совершит элементарную работуA=Fdx.
Сила, действующая на поршень, равна произведению давления газа на площадь поршня, поэтому элементарная работа равна A=PSdx.
Произведение площади поршня на совершённое им перемещение есть приращение объёма, занимаемого газом в сосуде dV. Тогда элементарная работа, совершённая газом при изменении объёма
A=PdV.
Работа, совершённая газом при конечном изменении объёма
 .
.
Обратите внимание – работа, совершённая газом положительна, если газ увеличивает свой объём (в этом случае приращение объёма dVположительно). Если же объём газа уменьшается, то совершённая им работа отрицательна.
П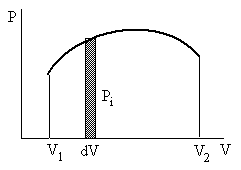 роизведениеPdVс одной стороны
равно элементарной работеA,
а с другой - площади заштрихованного
прямоугольника, показанного на рисунке.
Поэтому работа, совершённая газом при
изменении объёма, равна площади фигуры,
образованной графикомP=f(V)
на диаграммеPV.
роизведениеPdVс одной стороны
равно элементарной работеA,
а с другой - площади заштрихованного
прямоугольника, показанного на рисунке.
Поэтому работа, совершённая газом при
изменении объёма, равна площади фигуры,
образованной графикомP=f(V)
на диаграммеPV.
Ещё одно важное замечание. Если газ, находящийся в сосуде увеличит свой объём на dV, то газ, окружающий сосуд, уменьшит свой объём на такую же величину. Следовательно, работа, совершённая газом в сосуде равна по величине и противоположна по знаку работе, совершённой внешними силами над системой:
A=-A.
7.3 ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
Один и тот же газ может находиться в состояниях с разными значениями параметров состояния P,V,T. Переход газа (системы) из одного состояния в другое называютпроцессом.
Любой процесс связан с выходом системы из равновесного состояния. Например, если переместить поршень в сосуде с газом, то объём газа изменится. При этом изменится и давление газа, причём сразу после перемещения поршня давление газа в разных точках объёма станет разным – вблизи от поршня давление изменится сразу, а в удалённых точках объёма позже. Таким образом, равновесие системы нарушится. Причём равновесие нарушится тем сильнее, чем быстрее двигать поршень. Если же поршень двигать очень медленно, то нарушение равновесия будет незначительным. В пределе при бесконечно медленном перемещении поршня равновесие нарушаться не будет.
Это означает, что если процесс перехода системы из одного состояния в другое протекает бесконечно медленно, то каждое из промежуточных состояний будет равновесным. Такие процессы принято называть равновесными.
Если изменить направление равновесного процесса (например, заменив сжатие газа расширением), то система пройдёт в обратной последовательности через те же промежуточные равновесные состояния. Поэтому равновесные процессы называют обратимыми.
Реальные процессы всегда протекают за конечное время. Поэтому любой реальный процесс является неравновесным и поэтому необратимым.
В классической термодинамике рассматриваются только равновесные состояния и обратимые процессы. Реальные процессы рассматриваются в термодинамике неравновесных процессов, которая в данном курсе рассматриваться не будет.
