
- •II. Молекулярная физика и термодинамика
- •6. Основы молекулярно-кинетической теории
- •6.2. Основное уравнение молекулярно-кинетической теории идеального газа.
- •6.5 Распределение максвелла
- •6.6 Свойства функции распределения максвелла
- •6.7 Средняя и среднеквадратичная скорости молекул
- •6.8 Распределение больцмана
- •6.9 Понятие о числе степеней свободы. Распределение энергии по степеням свободы
- •7. Основы термодинамики
- •7.1 Первое начало термодинамики
- •7.2 Работа, совершаемая при изменении объёма системы
- •7.4 Изопроцессы
- •7.5.1 Изотермический процесс
- •7.5.2 Изохорический процесс
- •7.5.3 Изобарический процесс
- •7.6 Теплоёмкость идеального газа
- •7.7 Адиабатический процесс
- •7.8 Тепловая машина. Цикл карно
- •7.9 Энтропия. Второе начало термодинамики
- •7.10 Статистическая интерпретация энтропии
- •7.11 Молекулярно-кинетическая теория и термодинамика
7.4 Изопроцессы
Если в ходе процесса один из параметров состояния остаётся постоянным, его называют изопроцессом. Масса газа в ходе изопроцесса не изменяется.
Рассмотрим существующие изопроцессы.
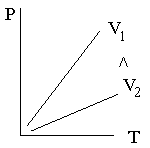
7.4.1 Изотермический процесс
Изотермическим называют процесс, в ходе которого температура газа постоянна.
Уравнение Менделеева-Клапейрона, записанное применительно к изотермическому процессу, принимает следующий вид:
PV=const,
где ![]() .
.
Г

 рафики
зависимости параметров состояния для
изотермического процесса изображены
на рисунке.
рафики
зависимости параметров состояния для
изотермического процесса изображены
на рисунке.
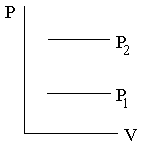
7.4.2 Изохорический процесс
Изохорическим называют процесс, идущий при постоянном объёме газа.
Уравнение Менделеева-Клапейрона, записанное применительно к изохорическому процессу, принимает следующий вид:
![]()

 ,
,
где
![]() .
.
Графики зависимости параметров состояния для изохорического процесса показаны на рисунке.
7.4.3 Изобарический процесс
Изобарическим называют процесс, идущий при постоянном давлении газа.
Уравнение Менделеева-Клапейрона, записанное применительно к изобарическому процессу, принимает следующий вид:
![]() ,
,
где
![]() .
.
Графики зависимости параметров состояния для изобарического процесса приведены ниже:


7.5 ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ
Рассмотрим первое начало термодинамики применительно к системам, участвующим в изопроцессах. Перед этим отметим следующее.
При температуре Твнутренняя энергия
газаUравна суммарной
кинетической энергии всехNмолекул газа![]() .
Учитывая выражение для расчета средней
кинетической энергии молекулы (см. , ),
можем записать
.
Учитывая выражение для расчета средней
кинетической энергии молекулы (см. , ),
можем записать
![]() .
.
Приращение внутренней энергии (это
дифференциал от U)
соответственно равно![]() .
Это означает, что внутренняя энергия
может изменяться только при изменении
температуры.
.
Это означает, что внутренняя энергия
может изменяться только при изменении
температуры.
В разделе показано, что элементарная работа, совершаемая при изменении объёма системы равнаA=PdV. Это означает, что для того, чтобы система могла совершить работу, её объём должен изменяться.
7.5.1 Изотермический процесс
Изотермический процесс идёт при постоянной температуре. Следовательно, приращение температуры dT=0. Но тогда и приращение внутренней энергии равно нулю:dU=0.
Объём газа, участвующего в изотермическом процессе, может изменяться. Следовательно, газ может совершать работу, элементарная работа совершаемая газом A0, равно как и работа, совершаемая над системойA0.
Газ, участвующий в изотермическом процессе, может участвовать в теплообмене, поэтому и элементарное количество тепла, полученное системой не равно нулю: Q0.
Обобщая сказанное, получаем
0=Q+A
или
0=Q-A
и окончательно
Q=A.
Последнее выражение показывает вид первого начала при изотермическом процессе.
Прочесть его можно следующим образом: тепло, полученное системой при изотермическом процессе, идёт на совершение работы против внешних сил.
Обратите внимание на важную деталь: температура при изотермическом процессе постоянна. Значит, несмотря на то, что системе сообщается тепло, она не нагревается!
Найдём работу, совершаемую газом при изотермическом изменении объёма.
Как показано в разделе , работа при
конечном изменении объёма равна
 .
.
Из уравнения Менделеева-Клапейрона
следует, что давление газа равно
![]() ,
поэтому работа
,
поэтому работа
 .
.
