
- •Сборник лабораторных работ
- •Оглавление
- •Элементный анализ органических веществ
- •Опыт 1. Обнаруживание углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода
- •Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
- •Опыт 6. Обнаружение галогена пробой ф.Ф. Бейльштейна (по окрашиванию пламени)
- •Алифатические углеводороды
- •Опыт 2. Получение этилена и изучение его свойств
- •Опыт 3. Получение ацетилена и изучение его свойств
- •Арены и галогениды
- •Опыт 1. Получение бензола из бензоата натрия
- •Опыт 2. Бромирование аренов
- •Опыт 6. Щелочной гидролиз хлороформа
- •Опыт 1. Сравнение спиртов по их растворимости в воде и по плотности
- •Опыт 2. Получение диэтилового эфира (межмолекулярная дегидратация этилового спирта)
- •Опыт 3. Окисление спиртов (пропанола и изопропанола) оксидом меди(II)
- •Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
- •Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
- •Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
- •Опыт 7. Доказательство кислотного характера фенолов
- •Опыт 8. Бромирование фенолов
- •Альдегиды и кетоны
- •Опыт 1. Получение ацетальдегида
- •Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
- •Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
- •Опыт 4. Получение ацетона
- •Опыт 5. Получение оксима ацетона
- •Опыт 6. Получение бисульфитного производного ацетона
- •Опыт 7. Получение акролеина из глицерина
- •Карбоновы е кислоты
- •Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
- •Опыт 2. Сравнение окисляемости кислот
- •Опыт 3. Получение сложного эфира
- •Опыт 4. Соли уксусной кислоты
- •Опыт 5. Получение бензоатов натрия и железа (III)
- •Опыт 6. Получение щавелевой кислоты и ее свойства
- •Опыт 7. Качественная реакция -оксикислот с FeCl3
- •Опыт 8. Свойства винной кислоты
- •Опыт 9. Свойства лимонной кислоты
- •Опыт 10. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 11. Гидролиз аспирина
- •Моносахариды
- •Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
- •Опыт 2. Эпимеризация кетозы в альдозу
- •Опыт 3. Обнаружение моносахаридов реактивом Фелинга
- •Опыт 4. Обнаружение моносахаридов реактивом Толленса (реакция “серебряного зеркала ”)
- •Опыт 5. Взаимодействие моносахаридов с концентрированной hCl (отличие глюкозы от фруктозы)
- •Опыт 6. Реакция Селиванова на кетогексозы
- •Сложные углеводы
- •Опыт 1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •Опыт 2. Восстанавливающие и невосстанавливающие дисахариды (проба Троммера на лактозу и сахарозу)
- •Опыт 3. Доказательство наличия лактозы в молоке
- •Опыт 4. Гидролиз (инверсия) сахарозы
- •Опыт 5. Свойства крахмала
- •Опыт 6. Раствторение целлюлозы в медно-аммиачном растворе (реактиве Швейцера)
- •Опыт 7. Кислотный гидролиз целлюлозы (клетчатки)
- •Азотсодержащие соединения
- •Опыт 1. Образование и гидролиз сернокислой соли дифениламина (дфа)
- •Опыт 2. Цветная реакция дфа с hno3 и нитратами
- •Опыт 3. Щелочной гидролиз ацетамида
- •Опыт 4. Дезаминирование ацетамида
- •Опыт 5. Получение и свойства метиламина
- •Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
- •Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
- •Опыт 8. Дезаминирование мочевины
- •Аминокислоты и белки
- •Опыт 1. Доказательство амфотерных свойств глицина
- •Опыт 2. Дезаминирование аминокислоты
- •Опыт 3. Образование медной соли глицина
- •Опыт 4. Изоэлектрическая точка и свертывание белков при нагревании
- •Опыт 5. Биуретовая реакция – качественная на пептидную связь
- •Опыт 6. Качественные (цветные) реакции на боковые аминокислотные радикалы
- •Сложные эфиры, жиры и мыла
- •Опыт 1. Получение фруктовых эфиров
- •Опыт 2. Элаидинизация масла
- •Опыт 3. Растворимость жиров в различных растворителях
- •Опыт 7. Получение мыла (омыление жира щелочью в вводно-спиртовом растворе)
- •Опыт 8. Свойства мыла
- •Опыт 1. Ферментативный гидролиз крахмала. Качественная проба на амилазу
- •Опыт 2. Влияние температуры на активность амилазы слюны
- •Опыт 3. Специфичность действия амилазы и сахаразы
- •Опыт 4. Качественная реакция на пероксидазу
- •Опыт 5. Реакция на каталазу
- •Опыт 6. Влияние рН среды на действие ферментов
- •Витамины
- •Опыт 3. Витамин е (токоферол)
- •Опыт 4. Качественная реакция на витамин рр
Опыт 5. Получение оксима ацетона
В пробирке с 6-7 мл дистиллированной H2O, охлажденной в стакане со снегом (или в ледяной воде), растворить ~ 2 г сернокислого гидроксиламина NH2OHH2SO4 + 1,5 г Na2CO3. Наблюдается бурное выделение CO2. К охлажденному и нейтрализованному раствору NH2OH добавить (при встряхивании) 10-15 капель ацетона (реактив). Наблюдается некоторый разогрев раствора (экзоэффект) и образование кристаллов кетоксима (см. в микроскопе) – оксима ацетона. В кислой среде оксимы легко гидролизуются при небольшом нагреве (регенерируется ацетон).
Напишите уравнения реакций образования кетоксима и его гид- ролиза.
Опыт 6. Получение бисульфитного производного ацетона
В пробирку к 3 мл насыщенного раствора NaHSO3 добавить 2 мл ацетона (реактив). Пробирку встряхнуть и опустить в стакан со снеговой водой. Через некоторое время начинает выпадать белый кристаллический осадок бисульфитного производного ацетона (см. в микроскопе).
Разделить кристаллы на две пробирки и осуществить их разло- жение:
(а) кислотой (1 н. HCl ) при небольшом нагреве;
(б) щелочью (1 н. NaOH).
Отметить запах выделяющихся паров (нюхать осторожно).
Напишите реакции образования бисульфитного производного ацетона и разложения его кислотой и щелочью.
Опыт 7. Получение акролеина из глицерина
В пробирку к 3-4 кристаллам KHSO4 добавить 1 каплю глицерина. Греть на спиртовке до побурения жидкости и появления тяжелых паров.
Образование акролеина может быть зафиксировано по резкому острому запаху (название акролеин от латинского acris = острый, жгучий; oleum = масло).
Схема образования акролеина следующая:
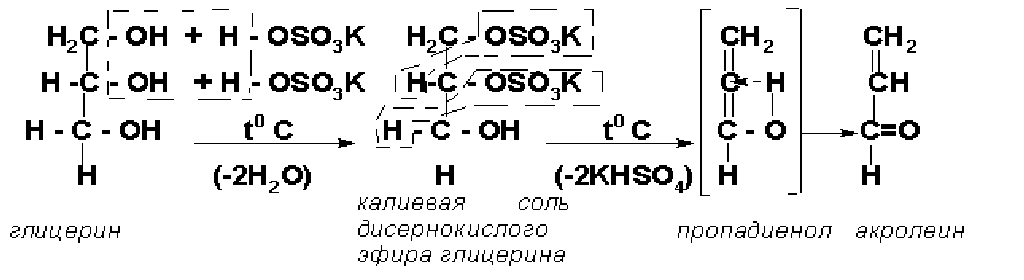
Акролеин – простейший непредельный альдегид. Реакция образования акролеина используется для обнаружения глицерина и жиров (акролеиновая проба).
ЛАБОРАТОРНАЯ РАБОТА № 6
Карбоновы е кислоты
Цель работы. Сопоставить свойства карбоновых кислот, познакомиться с их качественными реакциями.
Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
В восемь маленьких пробирок налейте по 3 мл Н2О и добавьте по 0,5 мл жидкой или 0,5 г твердой карбоновой кислоты. Перемешайте содержимое пробирок. Отметьте растворимость кислот, в том числе при нагревании (тех, которые плохо растворяются при комнатной температуре). Объясните различия в растворимости.
На универсальную индикаторную бумагу нанести по одной капле растворов кислот и определить их рН.
Напишите уравнения реакций диссоциации этих кислот.
Полученные растворы оставьте для использования в опыте 2.
Опыт 2. Сравнение окисляемости кислот
В восемь пробирок поместите по 3 капли раствора соответствующих кислот (из опыта 1), добавьте по 2-3 капли 2 н. H2SO4 и по 3 капли 5 %-го раствора KMnO4. Сопоставьте окисляемость различных кислот с их строением. Напишите соответствующие уравнения реакций.
Опыт 3. Получение сложного эфира
(а) Приготовьте 1/2 пробирки насыщенного раствора NaCl.
(б) Приготовьте смесь (*): в сухую пробирку наливают 2 мл кислоты, 2 мл спирта + 0,5 мл конц. H2SO4. Содержимое пробирки тщательно перемешайте. Смесь осторожно кипятите на слабом огне 2-3 мин. После охлаждения вылейте в пробирку с насыщенным раствором NaCl. Образовавшийся эфир всплывает на поверхность, непрореагировавшие кислоты – в водной фазе.
Отметьте запах полученного эфира (нюхать осторожно); напишите уравнение реакции образования эфира.
(*) Прием получения сложных эфиров различного состава – стандартный.
Вид получаемого эфира – по выбору:

Такого типа эфиры используются для изготовления фруктовых эссенций и в парфюмерии.
