
- •Сборник лабораторных работ
- •Оглавление
- •Элементный анализ органических веществ
- •Опыт 1. Обнаруживание углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода
- •Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
- •Опыт 6. Обнаружение галогена пробой ф.Ф. Бейльштейна (по окрашиванию пламени)
- •Алифатические углеводороды
- •Опыт 2. Получение этилена и изучение его свойств
- •Опыт 3. Получение ацетилена и изучение его свойств
- •Арены и галогениды
- •Опыт 1. Получение бензола из бензоата натрия
- •Опыт 2. Бромирование аренов
- •Опыт 6. Щелочной гидролиз хлороформа
- •Опыт 1. Сравнение спиртов по их растворимости в воде и по плотности
- •Опыт 2. Получение диэтилового эфира (межмолекулярная дегидратация этилового спирта)
- •Опыт 3. Окисление спиртов (пропанола и изопропанола) оксидом меди(II)
- •Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
- •Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
- •Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
- •Опыт 7. Доказательство кислотного характера фенолов
- •Опыт 8. Бромирование фенолов
- •Альдегиды и кетоны
- •Опыт 1. Получение ацетальдегида
- •Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
- •Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
- •Опыт 4. Получение ацетона
- •Опыт 5. Получение оксима ацетона
- •Опыт 6. Получение бисульфитного производного ацетона
- •Опыт 7. Получение акролеина из глицерина
- •Карбоновы е кислоты
- •Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
- •Опыт 2. Сравнение окисляемости кислот
- •Опыт 3. Получение сложного эфира
- •Опыт 4. Соли уксусной кислоты
- •Опыт 5. Получение бензоатов натрия и железа (III)
- •Опыт 6. Получение щавелевой кислоты и ее свойства
- •Опыт 7. Качественная реакция -оксикислот с FeCl3
- •Опыт 8. Свойства винной кислоты
- •Опыт 9. Свойства лимонной кислоты
- •Опыт 10. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 11. Гидролиз аспирина
- •Моносахариды
- •Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
- •Опыт 2. Эпимеризация кетозы в альдозу
- •Опыт 3. Обнаружение моносахаридов реактивом Фелинга
- •Опыт 4. Обнаружение моносахаридов реактивом Толленса (реакция “серебряного зеркала ”)
- •Опыт 5. Взаимодействие моносахаридов с концентрированной hCl (отличие глюкозы от фруктозы)
- •Опыт 6. Реакция Селиванова на кетогексозы
- •Сложные углеводы
- •Опыт 1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •Опыт 2. Восстанавливающие и невосстанавливающие дисахариды (проба Троммера на лактозу и сахарозу)
- •Опыт 3. Доказательство наличия лактозы в молоке
- •Опыт 4. Гидролиз (инверсия) сахарозы
- •Опыт 5. Свойства крахмала
- •Опыт 6. Раствторение целлюлозы в медно-аммиачном растворе (реактиве Швейцера)
- •Опыт 7. Кислотный гидролиз целлюлозы (клетчатки)
- •Азотсодержащие соединения
- •Опыт 1. Образование и гидролиз сернокислой соли дифениламина (дфа)
- •Опыт 2. Цветная реакция дфа с hno3 и нитратами
- •Опыт 3. Щелочной гидролиз ацетамида
- •Опыт 4. Дезаминирование ацетамида
- •Опыт 5. Получение и свойства метиламина
- •Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
- •Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
- •Опыт 8. Дезаминирование мочевины
- •Аминокислоты и белки
- •Опыт 1. Доказательство амфотерных свойств глицина
- •Опыт 2. Дезаминирование аминокислоты
- •Опыт 3. Образование медной соли глицина
- •Опыт 4. Изоэлектрическая точка и свертывание белков при нагревании
- •Опыт 5. Биуретовая реакция – качественная на пептидную связь
- •Опыт 6. Качественные (цветные) реакции на боковые аминокислотные радикалы
- •Сложные эфиры, жиры и мыла
- •Опыт 1. Получение фруктовых эфиров
- •Опыт 2. Элаидинизация масла
- •Опыт 3. Растворимость жиров в различных растворителях
- •Опыт 7. Получение мыла (омыление жира щелочью в вводно-спиртовом растворе)
- •Опыт 8. Свойства мыла
- •Опыт 1. Ферментативный гидролиз крахмала. Качественная проба на амилазу
- •Опыт 2. Влияние температуры на активность амилазы слюны
- •Опыт 3. Специфичность действия амилазы и сахаразы
- •Опыт 4. Качественная реакция на пероксидазу
- •Опыт 5. Реакция на каталазу
- •Опыт 6. Влияние рН среды на действие ферментов
- •Витамины
- •Опыт 3. Витамин е (токоферол)
- •Опыт 4. Качественная реакция на витамин рр
Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
В сухую пробирку, закрепленную в штативе, аккуратно пипеткой, не смачивая стенок, внесите 2-3 мл концентрированной H2SO4. По стенке пробирки другой пипеткой прилейте 2-3 мл этилового спирта так, чтобы получилось два слоя. Затем насыпьте 0,5-1,0 г кристаллического KМnO4, который будет размещаться на границе двух слоёв.
Через 1-2 мин начинает протекать реакция, сопровождающаяся появлением ярких вспышек. При этом чувствуется запах уксусного альдегида (зеленых яблок).
Напишите уравнение реакции окисления этанола и уравняйте:
С2Н5ОН + KMnO4 + H2SO4 CH3CHO + MnSO4 + K2SO4 + H2O
Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
В пробирку прилейте 5 капель 2 %-го раствора CuSO4 и 2-3 мл 10 %-го раствора NaOH:
CuSO4 + 2 NaOH = Cu(OH)2 + NaSO4
К образовавшемуся осадку голубого цвета добавьте 3-5 капель глицерина. Встряхивайте пробирку до растворения осадка.
Наблюдайте внешний эффект реакции: появляется васильково-синее окрашивание вследствие образования комплексного соединения глицерата меди:
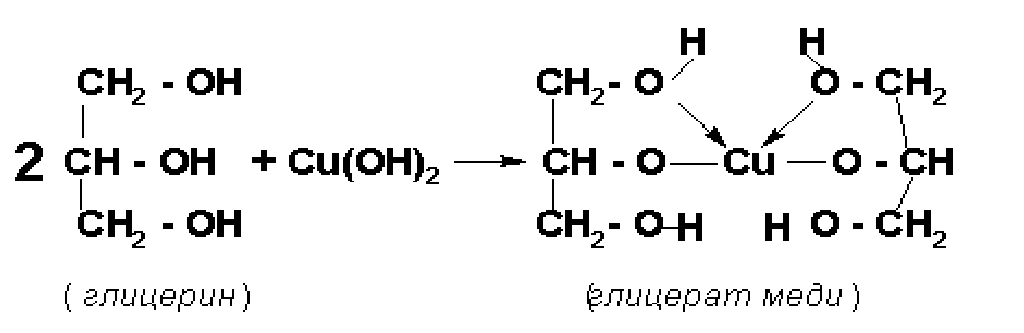
Какие свойства глицерин проявляет с гидроксидом меди?
Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
(б) – индофенольная проба (реакция Либермана)
а) В две пробирки прилейте по капле: в первую – 1 %-го растворафенола, во вторую – 1 %-го раствора резорцина.
В каждую пробирку добавьте по капле 2 %-го раствора FeCl3. В про-бирке с фенолом появляется сине-фиеолетовая окраска, с резорцином – фиолетовая.
При добавлении капли HCl окраска исчезает.
Напишите реакции образования Fe-комплексов с фенолом и резорцином.
б) В пробирку внесите 0,5 мл концентрированной H2SO4 и добавьте при перемешивании 2-3 капли 5 %-го раствора фенола. Смесь охладите в ледяной воде. К полученному раствора добавьте каплю 5 %-го раствора NaNO2. Появляется интенсивно розовое окрашивание, которое при добавлении 5 %-го NaOH (до щелочной среды) переходит в сине-зеленое за счет образования индофенола:
![]()
Интенсивная окраска обусловлена образованием в молекуле индофенола хиноидной группировки.
Опыт 7. Доказательство кислотного характера фенолов
(а) Универсальным индикатором определить рН растворов фенола и резорцина.
(б) В пробирку прилейте каплю “жидкого фенола” и 5 капель Н2О (встряхните). К полученной эмульсии фенола добавьте 2 капли NaOH, получится раствор фенолята натрия. К раствору фенолята добавьте 2 капли HCl, – раствор мутнеет вследствие выделения свободного фенола. Напишите уравнения реакций.
Опыт 8. Бромирование фенолов
В две пробирки поместите по 1 мл 1 %-х растворов фенола (в первую) и резорцина (во вторую). В каждую добавьте по каплям бромной воды. Наблюдается образование осадков трибромфенолов и обесцвечивание бромной воды. Напишите уравнения реакций.
ЛАБОРАТОРНАЯ РАБОТА № 5
Альдегиды и кетоны
Цель работы. Сопоставить свойства альдегидов и кетонов, познакомиться с их качественными реакциями.
Опыт 1. Получение ацетальдегида
а) Получение ацетальдегида окислением этанола оксидом меди. В пробирку с пробкой налейте 3 мл этанола. Медную спираль прокалите в пламени спиртовки до образования налета черного CuO и раскаленную опустите в спирт. С целью накопления продукта операцию повторите не менее 8-10 раз.
Зафиксировать запах ацетальдегида. Обнаружить уксусный альдегид можно цветной реакцией с фуксинсернистой кислотой – появляется фиолетовое окрашивание.
Накопленный ацетальдегид сохранить для следующих опытов.
Напишите уравнение реакции окисления спирта оксидом меди.
б) Получение ацетальдегида окислением этанола дихроматом калия. В сухую пробирку насыпьте 0,5 г K2Cr2O7 и прилейте 2 мл 10 % раствора H2SO4 и постепенно при встряхивании добавьте 2 мл этанола. Смесь разогревается и происходит изменение её цвета от оранжево- красного до зелено-бурого.
Напишите уравнение реакции окисления спирта дихроматом калия в кислой среде и подберите коэффициенты методом электронного баланса.
Пробирку закройте пробкой с газоотводной трубкой и закрепите в лапке штатива. Конец трубки погрузите в пробирку-приёмник с дистиллированной водой, помещенную предварительно в стакан со льдом (см. рис. 5). Пробирку с реакционной смесью осторожно нагрейте в пламени спиртовки и в течение 3-4 мин отгоняйте летучие продукты.
Наличие ацетальдегида обнаруживается по запаху или в отдельной пробе с фуксинсеринистой кислотой. Раствор использовать для реакций «серебряного» и «медного» зеркала и для альдольной конденсации.
