
- •Сборник лабораторных работ
- •Оглавление
- •Элементный анализ органических веществ
- •Опыт 1. Обнаруживание углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода
- •Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
- •Опыт 6. Обнаружение галогена пробой ф.Ф. Бейльштейна (по окрашиванию пламени)
- •Алифатические углеводороды
- •Опыт 2. Получение этилена и изучение его свойств
- •Опыт 3. Получение ацетилена и изучение его свойств
- •Арены и галогениды
- •Опыт 1. Получение бензола из бензоата натрия
- •Опыт 2. Бромирование аренов
- •Опыт 6. Щелочной гидролиз хлороформа
- •Опыт 1. Сравнение спиртов по их растворимости в воде и по плотности
- •Опыт 2. Получение диэтилового эфира (межмолекулярная дегидратация этилового спирта)
- •Опыт 3. Окисление спиртов (пропанола и изопропанола) оксидом меди(II)
- •Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
- •Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
- •Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
- •Опыт 7. Доказательство кислотного характера фенолов
- •Опыт 8. Бромирование фенолов
- •Альдегиды и кетоны
- •Опыт 1. Получение ацетальдегида
- •Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
- •Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
- •Опыт 4. Получение ацетона
- •Опыт 5. Получение оксима ацетона
- •Опыт 6. Получение бисульфитного производного ацетона
- •Опыт 7. Получение акролеина из глицерина
- •Карбоновы е кислоты
- •Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
- •Опыт 2. Сравнение окисляемости кислот
- •Опыт 3. Получение сложного эфира
- •Опыт 4. Соли уксусной кислоты
- •Опыт 5. Получение бензоатов натрия и железа (III)
- •Опыт 6. Получение щавелевой кислоты и ее свойства
- •Опыт 7. Качественная реакция -оксикислот с FeCl3
- •Опыт 8. Свойства винной кислоты
- •Опыт 9. Свойства лимонной кислоты
- •Опыт 10. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 11. Гидролиз аспирина
- •Моносахариды
- •Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
- •Опыт 2. Эпимеризация кетозы в альдозу
- •Опыт 3. Обнаружение моносахаридов реактивом Фелинга
- •Опыт 4. Обнаружение моносахаридов реактивом Толленса (реакция “серебряного зеркала ”)
- •Опыт 5. Взаимодействие моносахаридов с концентрированной hCl (отличие глюкозы от фруктозы)
- •Опыт 6. Реакция Селиванова на кетогексозы
- •Сложные углеводы
- •Опыт 1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •Опыт 2. Восстанавливающие и невосстанавливающие дисахариды (проба Троммера на лактозу и сахарозу)
- •Опыт 3. Доказательство наличия лактозы в молоке
- •Опыт 4. Гидролиз (инверсия) сахарозы
- •Опыт 5. Свойства крахмала
- •Опыт 6. Раствторение целлюлозы в медно-аммиачном растворе (реактиве Швейцера)
- •Опыт 7. Кислотный гидролиз целлюлозы (клетчатки)
- •Азотсодержащие соединения
- •Опыт 1. Образование и гидролиз сернокислой соли дифениламина (дфа)
- •Опыт 2. Цветная реакция дфа с hno3 и нитратами
- •Опыт 3. Щелочной гидролиз ацетамида
- •Опыт 4. Дезаминирование ацетамида
- •Опыт 5. Получение и свойства метиламина
- •Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
- •Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
- •Опыт 8. Дезаминирование мочевины
- •Аминокислоты и белки
- •Опыт 1. Доказательство амфотерных свойств глицина
- •Опыт 2. Дезаминирование аминокислоты
- •Опыт 3. Образование медной соли глицина
- •Опыт 4. Изоэлектрическая точка и свертывание белков при нагревании
- •Опыт 5. Биуретовая реакция – качественная на пептидную связь
- •Опыт 6. Качественные (цветные) реакции на боковые аминокислотные радикалы
- •Сложные эфиры, жиры и мыла
- •Опыт 1. Получение фруктовых эфиров
- •Опыт 2. Элаидинизация масла
- •Опыт 3. Растворимость жиров в различных растворителях
- •Опыт 7. Получение мыла (омыление жира щелочью в вводно-спиртовом растворе)
- •Опыт 8. Свойства мыла
- •Опыт 1. Ферментативный гидролиз крахмала. Качественная проба на амилазу
- •Опыт 2. Влияние температуры на активность амилазы слюны
- •Опыт 3. Специфичность действия амилазы и сахаразы
- •Опыт 4. Качественная реакция на пероксидазу
- •Опыт 5. Реакция на каталазу
- •Опыт 6. Влияние рН среды на действие ферментов
- •Витамины
- •Опыт 3. Витамин е (токоферол)
- •Опыт 4. Качественная реакция на витамин рр
Элементный анализ органических веществ
Цель работы. Освоение качественных методов обнаружения органогенных элементов в составе различных органических веществ.
Качественный анализ позволяет определить, из каких элементов построены молекулы вещества и установить его простейшую формулу. Наиболее часто в состав органических веществ, помимо углерода и водорода, входят кислород, сера, азот и галогены.
При выполнении элементного анализа органическое соединение разлагают таким образом, чтобы исследуемые элементы «перешли» в состав неорганических веществ – углерод в оксид углерода(IV), водород – в воду, азот – в цианид-ион, аммиак или молекулярный азот, сера – в сульфид-ион.
Опыт 1. Обнаруживание углерода пробой на обугливание
Первой пробой исследования неизвестного вещества для проверки его принадлежности к классу органических соединений является прокаливание вещества в пробирке, на крышке тигля и т.п. Очень многие органические соединения при этом чернеют, обугливаются, выявляя таким образом углерод, входящий в их состав.
Иногда обугливание наблюдается при действии водоотнимающих веществ, например, концентрированной H2SO4. Особенно резко такое обугливание проявляется при нагревании. Так, при нагревании обугливающее действие оказывает даже разбавленная H2SO4.
На белом листе бумаги сделайте надпись 1 %-м раствором H2SO4. После высыхания надпись невидима.
При осторожном нагреве бумаги над пламенем или над электроплиткой участки бумаги, смоченные серной кислотой, обугливаются, невидимая надпись проявляется, как написанная черной тушью.
“Коптящее пламя” – тоже пример обугливания органического вещества.
Проба на обугливание – вспомогательный, ориентировочный прием, так как отсутствие обугливания еще не позволяет утверждать об отсутствии углерода, поскольку многие органические соединения не подвергаются обугливанию.
Опыт 2. Обнаружение углерода и водорода
В
3
2
1
5
4![]()
Выделяющийся при разложении сахарозы газ пропускается через раствор баритовой воды для обнаружения в нем CO2. Факт образования воды фиксируется с помощью безводного CuSO4, который образует синий кристаллогидрат CuSO45H2O.
Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
Опыт 3. Обнаружение азота по характерному запаху
жженого органического вещества
Метод прост и надёжен, запах очень специфичен. Он характерен для всех азотсодержащих белковых веществ (шерсть, волосы, мясо, кожа, яичный белок, желатин, казеин и др.) и позволяет обнаруживать таким образом ничтожные количества указанных веществ:
а) сжечь волос – познакомиться с запахом.
б) сравнить при сжигании поведение хлопчатобумажной (х/б) и шерстяной нитей.
Запишите наблюдения.
Опыт 4. Обнаружение азота в составе мочевины
по образованию аммиака
– мочевина (карбамид)
Р![]()
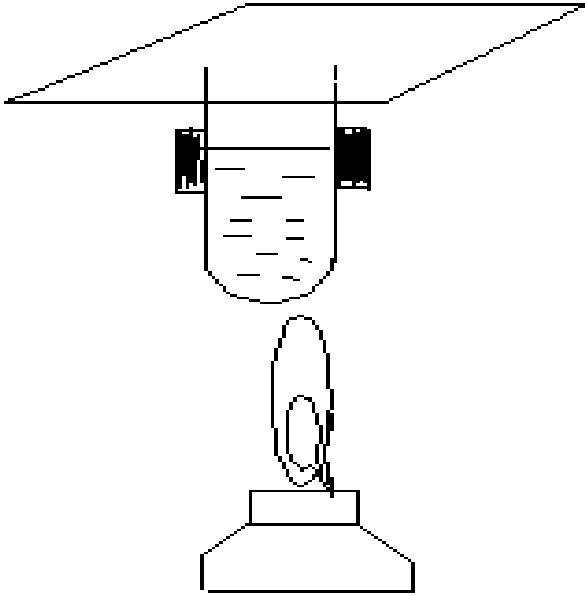 астворите
~ 0,5 г мочевины в 2 мл дистиллированной
H2O
и добавьте 2 мл 10 %-го раствора NaOH. Нагрейте
в пламени спиртовки. Красный лакмус,
смоченный водой, держать над парами
(без контакта лакмуса со щелочью), рис.
2.
астворите
~ 0,5 г мочевины в 2 мл дистиллированной
H2O
и добавьте 2 мл 10 %-го раствора NaOH. Нагрейте
в пламени спиртовки. Красный лакмус,
смоченный водой, держать над парами
(без контакта лакмуса со щелочью), рис.
2.
Напишите уравнения реакций и вы- воды.
Рис.2. Схема прибора
для обнаружения аммиака
Опыт 5. Обнаружение серы в составе тиомочевины
по образованию осадка PbS
![]()
– тиомочевина (тиокарбамид)
Сульфид свинца – очень плохо растворимое соединение черного цвета. Добавление растворимых солей свинца к растворам, содержащим анион S2–, приводит к образованию черного осадка и является чувствительной реакцией на cульфидную серу.
Опыт 5(а). К небольшому количеству раствора тиомочевины добавьте 1-2 капли раствора соли свинца. Объясните отсутствие осадка PbS.
Опыт 5(б). В сухую пробирку поместите ~0,5 г тиомочевины и таблетку NaOH. Смесь сплавьте, охладите и растворите в 2-3 мл дистиллированной H2O – перевод органической серы в неорганическое состояние (S2–). Добавьте к раствору плава соли каплю нитрата свинца.
Напишите уравнения реакций, наблюдения и выводы.
