
- •Сборник лабораторных работ
- •Оглавление
- •Элементный анализ органических веществ
- •Опыт 1. Обнаруживание углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода
- •Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
- •Опыт 6. Обнаружение галогена пробой ф.Ф. Бейльштейна (по окрашиванию пламени)
- •Алифатические углеводороды
- •Опыт 2. Получение этилена и изучение его свойств
- •Опыт 3. Получение ацетилена и изучение его свойств
- •Арены и галогениды
- •Опыт 1. Получение бензола из бензоата натрия
- •Опыт 2. Бромирование аренов
- •Опыт 6. Щелочной гидролиз хлороформа
- •Опыт 1. Сравнение спиртов по их растворимости в воде и по плотности
- •Опыт 2. Получение диэтилового эфира (межмолекулярная дегидратация этилового спирта)
- •Опыт 3. Окисление спиртов (пропанола и изопропанола) оксидом меди(II)
- •Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
- •Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
- •Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
- •Опыт 7. Доказательство кислотного характера фенолов
- •Опыт 8. Бромирование фенолов
- •Альдегиды и кетоны
- •Опыт 1. Получение ацетальдегида
- •Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
- •Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
- •Опыт 4. Получение ацетона
- •Опыт 5. Получение оксима ацетона
- •Опыт 6. Получение бисульфитного производного ацетона
- •Опыт 7. Получение акролеина из глицерина
- •Карбоновы е кислоты
- •Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
- •Опыт 2. Сравнение окисляемости кислот
- •Опыт 3. Получение сложного эфира
- •Опыт 4. Соли уксусной кислоты
- •Опыт 5. Получение бензоатов натрия и железа (III)
- •Опыт 6. Получение щавелевой кислоты и ее свойства
- •Опыт 7. Качественная реакция -оксикислот с FeCl3
- •Опыт 8. Свойства винной кислоты
- •Опыт 9. Свойства лимонной кислоты
- •Опыт 10. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 11. Гидролиз аспирина
- •Моносахариды
- •Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
- •Опыт 2. Эпимеризация кетозы в альдозу
- •Опыт 3. Обнаружение моносахаридов реактивом Фелинга
- •Опыт 4. Обнаружение моносахаридов реактивом Толленса (реакция “серебряного зеркала ”)
- •Опыт 5. Взаимодействие моносахаридов с концентрированной hCl (отличие глюкозы от фруктозы)
- •Опыт 6. Реакция Селиванова на кетогексозы
- •Сложные углеводы
- •Опыт 1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •Опыт 2. Восстанавливающие и невосстанавливающие дисахариды (проба Троммера на лактозу и сахарозу)
- •Опыт 3. Доказательство наличия лактозы в молоке
- •Опыт 4. Гидролиз (инверсия) сахарозы
- •Опыт 5. Свойства крахмала
- •Опыт 6. Раствторение целлюлозы в медно-аммиачном растворе (реактиве Швейцера)
- •Опыт 7. Кислотный гидролиз целлюлозы (клетчатки)
- •Азотсодержащие соединения
- •Опыт 1. Образование и гидролиз сернокислой соли дифениламина (дфа)
- •Опыт 2. Цветная реакция дфа с hno3 и нитратами
- •Опыт 3. Щелочной гидролиз ацетамида
- •Опыт 4. Дезаминирование ацетамида
- •Опыт 5. Получение и свойства метиламина
- •Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
- •Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
- •Опыт 8. Дезаминирование мочевины
- •Аминокислоты и белки
- •Опыт 1. Доказательство амфотерных свойств глицина
- •Опыт 2. Дезаминирование аминокислоты
- •Опыт 3. Образование медной соли глицина
- •Опыт 4. Изоэлектрическая точка и свертывание белков при нагревании
- •Опыт 5. Биуретовая реакция – качественная на пептидную связь
- •Опыт 6. Качественные (цветные) реакции на боковые аминокислотные радикалы
- •Сложные эфиры, жиры и мыла
- •Опыт 1. Получение фруктовых эфиров
- •Опыт 2. Элаидинизация масла
- •Опыт 3. Растворимость жиров в различных растворителях
- •Опыт 7. Получение мыла (омыление жира щелочью в вводно-спиртовом растворе)
- •Опыт 8. Свойства мыла
- •Опыт 1. Ферментативный гидролиз крахмала. Качественная проба на амилазу
- •Опыт 2. Влияние температуры на активность амилазы слюны
- •Опыт 3. Специфичность действия амилазы и сахаразы
- •Опыт 4. Качественная реакция на пероксидазу
- •Опыт 5. Реакция на каталазу
- •Опыт 6. Влияние рН среды на действие ферментов
- •Витамины
- •Опыт 3. Витамин е (токоферол)
- •Опыт 4. Качественная реакция на витамин рр
Опыт 3. Щелочной гидролиз ацетамида
Несколько кристаллов ацетамида поместите в пробирку, добавьте 10 капель 2н. NaOH и нагрейте. Резкий запах аммиака и посинение лакмусовой бумаги свидетельствует о гидролизе ацетамида.
Напишите уравнения реакций.
Опыт 4. Дезаминирование ацетамида
Поместите в пробирку несколько кристаллов ацетамида, добавьте 8 капель 10 %-го раствора NaNO2 и 2 капли концентрированной HNO3. Нагрейте на спиртовке.. Влажным красным лакмусом обнаружьте аммиак.
Напишите уравнение реакции гидролиза ацетамида и его обнару-жения.
Опыт 5. Получение и свойства метиламина
Предварительно приготовьте три пробирки с испытательными растворами: в первую наливают 1 мл дистиллированной воды, в две другие пробирки – по 2 мл 3 %-го раствора хлорида железа(III) и 3 %-го раствора сульфата меди(II).
В сухую пробирку внесите 0,5-1 г хлорида метиламмония и 1–2 г натронной извести. Смесь тщательно перемешайте стеклянной палочкой. Пробирку закройте пробкой с газоотводной трубкой и закрепите в лапке штатива. Реакционную смесь нагрейте на спиртовке:
[CH3 – NH3]+Cl– + NaOH = CH3 – NH2 + NaCl + H2O.
К отверстию газоотводной трубки, из которой выделяется газообразный метиламин, поднесите стеклянную палочку, смоченную концентрированной HCl – палочка окутывается туманом:
CH3 – NH2 + HCl = [CH3 –NH3]+Cl–
Через испытательные растворы пропустите газообразный мети-ламин.
Испытайте реакцию среды в первой пробирке.
В пробирке с FeCl3 через некоторое время выпадает бурый осадок
СН3 – NH2 + H2O = [CH3 –NH3]+OH–
3 [CH3 –NH3]+OH– + FeCl3 = Fe(OH)3 + 3 [CH3 –NH3]+Cl–
В пробирке с CuSO4 вначале образуется голубой осадок Cu(OH)2, который растворяется в избытке метиламина. Запишите соответствующие уравнения реакций.
Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
Эту реакцию используют как качественную реакцию на первичные амины алифатического ряда.
В пробирку с 0,2 г хлорида метиламмония приливают 1 мл воды, затем, после растворения соли, вносят 1 мл 10 %-го раствора NaNO2. Смесь тщательно перемешивают и добавляют несколько капель ледяной уксусной кислоты – выделяется азот в виде мелких пузырьков.
Запишите уравнения реакций получения HNO2 и ее реакцию с метиламином. Предложите варианты обнаружения основного продукта реакции – первичного спирта.
Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
(а) В пробирку насыпьте 0,2-0,5 г мочевины и добавьте 3-5 капель дистиллированной Н2О (отметить очень хорошую растворимость мочевины в воде). Убедитесь в том, что раствор мочевины нейтрален на лакмус.
(б) К раствору мочевины добавьте 2 капли конц. HNO3 и встряхните – сразу или через несколько секунд начинается образование кристаллов азотнокислой мочевины (реагирует мочевина с одной молекулой HNO3).
Напишите уравнение реакции образования нитрата мочевины.
Кристаллы сохраните для следующего опыта.
Опыт 8. Дезаминирование мочевины
К кристаллам азотнокислой соли мочевины (из оп. 5.) добавьте 2-3 капли NаNO2 (напишите уравнение реакции образования НNO2). При встряхивании немедленно начинается выделение газа (СО2 и N2). С помощью влажного красного лакмуса убедитесь в отсутствии аммиака.
Напишите уравнение реакции дезаминирования мочевины.
Реакция разложения мочевины азотистой кислотой используется для количественного определения мочевины по методу ван Слайка (измеряется объем выделившегося азота).
Опыт 9. Гидролиз мочевины, доказательство ее строения
В пробирку поместите 0,1-0,2 г мочевины и
добавьте (не смачивая стенок пробирки)
1-2 мл баритовой воды Ba(OH)2.
Пробку закройте неплотно и вставьте
влажный красный лакмус (рис.
8). Нагревать
на водяной бане 15-20 мин. Объясните
посинение лакмуса и появление мути в
пробирке.
пробирку поместите 0,1-0,2 г мочевины и
добавьте (не смачивая стенок пробирки)
1-2 мл баритовой воды Ba(OH)2.
Пробку закройте неплотно и вставьте
влажный красный лакмус (рис.
8). Нагревать
на водяной бане 15-20 мин. Объясните
посинение лакмуса и появление мути в
пробирке.
Напишите уравнения реакций.
В живых организмах гидролиз моче-вины происходит под действием фермента уреазы (urea – лат. мочевина).
Опыт 10. Разложение мочевины при нагревании.
Образование биурета и циануровой кислоты.
Биуретовая реакция
В сухую пробирку поместите 2 лопаточки мочевины и осторожно нагревайте (~ 5 см от пламени горелки). Сначала начинается плавление, затем выделение пузырьков газа, – аммиака, который можно зафиксировать по запаху и влажным красным лакмусом.
Вскоре выделение газа прекращается, а реакционная масса затвердевает вследствие образования биурета и циануровой кислоты. Раз- делить эти вещества можно, используя их различную растворимость в воде.
Пробирку охладите, добавьте 10 капель Н2О и 2-3 мин кипятите.
Легко растворимый биурет перейдет в раствор. Осадку циануровой кислоты дать отстояться, а раствор биурета слить в другую пробирку.
10.1. К раствору биурета добавить 2-3 капли NаOH. При этом исчезнет (если попала в раствор) муть от циануровой кислоты.
Добавьте 1 каплю CuSO4, появляется розово-фиолетовое окрашивание комплексной соли меди – биуретовая реакция (избыток CuSO4 вреден, так как маскирует характерную розовую окраску).





мочевина биурет
Название продукта – биурет – от латинских (by=два; urea=мочевина).
Биуретовая реакция является одной из главных качественных реакций на пептидную связь в пептидах и белках.
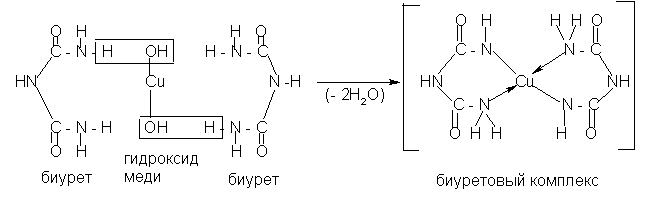
10.2. К оставшемуся осадку циануровой кислоты добавьте 2-3 капли 2 н. NH4OH, энергично встряхните и добавьте каплю CuSO4. Образуется сиреневый осадок комплексной медной соли циануровой кислоты.
Сама циануровая кислота – продукт взаимодействия трех молекул мочевины:

мочевина циануровая кислота
(две таутомерные формы )
Объясните, почему циануровая кислота (“тримочевина”), не име-ющая кислотной карбоксильной группы – СООН, является кислотой.
ЛАБОРАТОРНАЯ РАБОТА № 10
