
- •Сборник лабораторных работ
- •Оглавление
- •Элементный анализ органических веществ
- •Опыт 1. Обнаруживание углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода
- •Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
- •Опыт 6. Обнаружение галогена пробой ф.Ф. Бейльштейна (по окрашиванию пламени)
- •Алифатические углеводороды
- •Опыт 2. Получение этилена и изучение его свойств
- •Опыт 3. Получение ацетилена и изучение его свойств
- •Арены и галогениды
- •Опыт 1. Получение бензола из бензоата натрия
- •Опыт 2. Бромирование аренов
- •Опыт 6. Щелочной гидролиз хлороформа
- •Опыт 1. Сравнение спиртов по их растворимости в воде и по плотности
- •Опыт 2. Получение диэтилового эфира (межмолекулярная дегидратация этилового спирта)
- •Опыт 3. Окисление спиртов (пропанола и изопропанола) оксидом меди(II)
- •Опыт 4. Окисление спиртов перманганатом калия (сухим кристаллическим)
- •Опыт 5. Качественная реакция на многоатомные спирты с гидроксидом меди (II)
- •Опыт 6. Качественные реакции на фенолы – (а) – с FeCl3,
- •Опыт 7. Доказательство кислотного характера фенолов
- •Опыт 8. Бромирование фенолов
- •Альдегиды и кетоны
- •Опыт 1. Получение ацетальдегида
- •Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
- •Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
- •Опыт 4. Получение ацетона
- •Опыт 5. Получение оксима ацетона
- •Опыт 6. Получение бисульфитного производного ацетона
- •Опыт 7. Получение акролеина из глицерина
- •Карбоновы е кислоты
- •Опыт 1. Растворимость карбоновых кислот в воде. Сравнение их кислотности
- •Опыт 2. Сравнение окисляемости кислот
- •Опыт 3. Получение сложного эфира
- •Опыт 4. Соли уксусной кислоты
- •Опыт 5. Получение бензоатов натрия и железа (III)
- •Опыт 6. Получение щавелевой кислоты и ее свойства
- •Опыт 7. Качественная реакция -оксикислот с FeCl3
- •Опыт 8. Свойства винной кислоты
- •Опыт 9. Свойства лимонной кислоты
- •Опыт 10. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 11. Гидролиз аспирина
- •Моносахариды
- •Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
- •Опыт 2. Эпимеризация кетозы в альдозу
- •Опыт 3. Обнаружение моносахаридов реактивом Фелинга
- •Опыт 4. Обнаружение моносахаридов реактивом Толленса (реакция “серебряного зеркала ”)
- •Опыт 5. Взаимодействие моносахаридов с концентрированной hCl (отличие глюкозы от фруктозы)
- •Опыт 6. Реакция Селиванова на кетогексозы
- •Сложные углеводы
- •Опыт 1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •Опыт 2. Восстанавливающие и невосстанавливающие дисахариды (проба Троммера на лактозу и сахарозу)
- •Опыт 3. Доказательство наличия лактозы в молоке
- •Опыт 4. Гидролиз (инверсия) сахарозы
- •Опыт 5. Свойства крахмала
- •Опыт 6. Раствторение целлюлозы в медно-аммиачном растворе (реактиве Швейцера)
- •Опыт 7. Кислотный гидролиз целлюлозы (клетчатки)
- •Азотсодержащие соединения
- •Опыт 1. Образование и гидролиз сернокислой соли дифениламина (дфа)
- •Опыт 2. Цветная реакция дфа с hno3 и нитратами
- •Опыт 3. Щелочной гидролиз ацетамида
- •Опыт 4. Дезаминирование ацетамида
- •Опыт 5. Получение и свойства метиламина
- •Опыт 6. Взаимодействие первичных аминов с азотистой кислотой
- •Опыт 7. Растворимость мочевины в воде и образование ее азотнокислой соли
- •Опыт 8. Дезаминирование мочевины
- •Аминокислоты и белки
- •Опыт 1. Доказательство амфотерных свойств глицина
- •Опыт 2. Дезаминирование аминокислоты
- •Опыт 3. Образование медной соли глицина
- •Опыт 4. Изоэлектрическая точка и свертывание белков при нагревании
- •Опыт 5. Биуретовая реакция – качественная на пептидную связь
- •Опыт 6. Качественные (цветные) реакции на боковые аминокислотные радикалы
- •Сложные эфиры, жиры и мыла
- •Опыт 1. Получение фруктовых эфиров
- •Опыт 2. Элаидинизация масла
- •Опыт 3. Растворимость жиров в различных растворителях
- •Опыт 7. Получение мыла (омыление жира щелочью в вводно-спиртовом растворе)
- •Опыт 8. Свойства мыла
- •Опыт 1. Ферментативный гидролиз крахмала. Качественная проба на амилазу
- •Опыт 2. Влияние температуры на активность амилазы слюны
- •Опыт 3. Специфичность действия амилазы и сахаразы
- •Опыт 4. Качественная реакция на пероксидазу
- •Опыт 5. Реакция на каталазу
- •Опыт 6. Влияние рН среды на действие ферментов
- •Витамины
- •Опыт 3. Витамин е (токоферол)
- •Опыт 4. Качественная реакция на витамин рр
Опыт 11. Гидролиз аспирина
Аспирин – ацетилсалициловая кислота – является сложным эфиром и легко гидролизуется при нагревании без катализаторов.

Несколько кристаллов аспирина растворите в 6-7 мл Н2О. Полученный раствор разделите на две пробирки.
(а) К одной части раствора добавить 3-4 капли 3 %-го раствора FeCl3. Объясните отсутствие окрашивания.
(б) Вторую пробирку с раствором аспирина прокипятите (~1 мин).
К охлажденному раствору добавьте 3-4 капли FeCl3. Объясните появление окраски.
Напишите уравнение реакции гидролиза ацетилсалициловой кислоты и образование комплекса железа (III) c салициловой кислотой.
ЛАБОРАТОРНАЯ РАБОТА № 7
Моносахариды
Цель работы. Сопоставить свойства моносахаридов, познакомиться с их качественными реакциями.
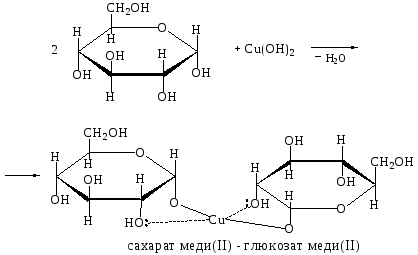
Опыт 1. Доказательство наличия в глюкозе нескольких гидроксильных групп – образование сахарата меди(II)
1.1. Качественная реакция на -гликольный фрагмент
В большой пробирке смешивают 1 мл 1 %-го раствора глюкозы и 0,5 мл 10 %-го раствора гидроксида натрия. Затем по каплям добавляют 5 %-й раствор CuSO4. Образующийся вначале голубой осадок гидроксида меди(II) при встряхивании растворяется и получается синий прозрачный раствор сахарата меди:
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4.
1.2. Окисление моносахаридов гидроксидом меди(II) – качественная реакция на альдогруппу (проба Троммера
К полученному в предыдущем опыте раствору
глюкозата меди(II)
добавьте воды (до высоты слоя жидкости
в пробирке ~3/4 высоты пробирки), перемешайте.
Пробирку сильно наклоните и грейте
только в верхней части
раствора (см. рис.
6). Нагрейте до
кипения, но не
кипятите
(при кипячении начнет разлагаться
нерастворившийся осадок Cu(OH)2
с образованием черного CuO, что «затемнит»
внешний эффект). Через несколько секунд
нагретая часть раствора изменит цвет
на оранжево-желтый – образуется осадок
CuOH. При избытке щелочи или более длительном
нагреве может образоваться желто-красный
осадок Cu2O.
полученному в предыдущем опыте раствору
глюкозата меди(II)
добавьте воды (до высоты слоя жидкости
в пробирке ~3/4 высоты пробирки), перемешайте.
Пробирку сильно наклоните и грейте
только в верхней части
раствора (см. рис.
6). Нагрейте до
кипения, но не
кипятите
(при кипячении начнет разлагаться
нерастворившийся осадок Cu(OH)2
с образованием черного CuO, что «затемнит»
внешний эффект). Через несколько секунд
нагретая часть раствора изменит цвет
на оранжево-желтый – образуется осадок
CuOH. При избытке щелочи или более длительном
нагреве может образоваться желто-красный
осадок Cu2O.
Cu2+ из состава сахарата восстанавливается до Cu1+ (в составе CuOH или Cu2O), а глюкоза окисляется до глюконовой кислоты:
t С
2 СuOH Cu2O + H2O
Опыт 2. Эпимеризация кетозы в альдозу
Ф руктоза,
не имеющая альдегидной группы, тем не
менее тоже дает положительную реакцию
Троммера. Связано это с явлениемэпимеризации
– процессом
изменения пространственного расположения
атомов относительно асимметрического
атома углерода, находящегося непосредственно
около карбонильной (С О) группы молекулы
моносахарида,
под действием щелочей.
руктоза,
не имеющая альдегидной группы, тем не
менее тоже дает положительную реакцию
Троммера. Связано это с явлениемэпимеризации
– процессом
изменения пространственного расположения
атомов относительно асимметрического
атома углерода, находящегося непосредственно
около карбонильной (С О) группы молекулы
моносахарида,
под действием щелочей.
Этот процесс проходит через стадию “енолизации” (образования ендиола):

Манноза и глюкоза являются эпимерами друг друга (отличаются расположением ОН около С2). Эпимерной этим альдозам является и фруктоза (*С2 в составе енола и кетозы перестает быть асимметрическим, каковым является в составе альдоз ).
Восстановительная способность фруктозы (кетозы) связана с предварительным ее превращением (эпимеризацией) в альдозу, которая, собственно, и дает положительную реакцию Троммера.
Опыт проводится аналогично опыту 1.2, только требует более длительного нагревания. Напишите реакцию образования сахарата меди(II) с фруктозой.
