
- •А. В. Скворцов
- •Галоген- и кислородсодержащие соединения
- •Оглавление
- •Введение функциональные производные углеводородов
- •Глава 7. Галогенопроизводные углеводородов
- •7.1. Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Химические свойства
- •7.3.1. Реакции замещения
- •7.3.2. Реакции отщепления
- •7.3.3. Восстановление галогенидов водородом
- •7.3.4. Образование металлоорганических соединений
- •7.4. Получение
- •7.5. Специфика фторопроизводных
- •7.6. Использование галогенопроизводных
- •Глава 8. Оксипроизводные углеводородов (спирты и фенолы)
- •8.1. Спирты одноатомные (алкоголи)
- •8.1.1. Изомерия и номенклатура
- •8.1.2. Физические свойства
- •Физические свойства спиртов
- •8.1.3. Химические свойства
- •Б. Реакции, протекающие с разрывом связи с–он
- •В. Реакции спиртов с участием их радикалов
- •8.1.4. Получение спиртов
- •8.1.5. Использование спиртов
- •8.2. Многоатомные спирты (полиолы)
- •8.2.1. Изомерия и номенклатура
- •8.2.2. Свойства полиолов
- •8.2.3. Получение и применение полиолов
- •8.3. Фенолы и нафтолы
- •8.3.1. Физические свойства
- •Физические свойства фенолов
- •8.3.2. Химические свойства
- •8.3.3. Получение и применение
- •Глава 9. Простые эфиры
- •9.1. Изомерия и номенклатура
- •9.2. Получение
- •9.3. Свойства простых эфиров
- •9.4. Эпоксиды (органические оксиды)
- •9.5. Использование простых эфиров
- •Глава 10. Альдегиды и кетоны – оксопроизводные углеводородов
- •10.1. Предельные альдегиды и кетоны
- •10.1.1. Физические свойства
- •Физические свойства альдегидов и кетонов
- •10.1.2. Химические свойства
- •I. Реакция присоединения
- •1. С цианистым водородом
- •2. Со спиртами (образование полуацеталей, ацеталей и кеталей):
- •3. С бисульфитом натрия (NaHso3)
- •4. Присоединение аммиака
- •II. Замещение карбонильного кислорода
- •7. Замещение карбонильного кислорода хлором
- •III. Реакции с участием атомов водорода в -положении
- •8. Галогенирование радикалов оксосоединений
- •9. Альдольно-кротоновая конденсация
- •10. Конденсация с алкинами-1 (синтезы Фаворского)
- •15. Диспропорционирование альдегидов
- •V. Реакции олиго- и полиМеРизации
- •10.2. Непредельные оксосоединения
- •10.2.1. Сопряженные (, -ненасыщенные)
- •4. Оксид серебра окисляет только альдегидную группу
- •10.2.2. Кетены (карбонилы с кумулированными связями
- •10.3. Дикарбонильные соединения
- •10.4. Получение оксосоединений
- •10.5. Применение оксосоединений
- •Глава 11. Карбоновые кислоты и их производные
- •11.1. Одноосновные предельные кислоты
- •11.1.1. Физические свойства
- •Физические свойства некоторых одноосновных карбоновых кислот
- •11.1.2. Химические свойства
- •11.1.3. Способы получения
- •11.2. Одноосновные непредельные кислоты
- •11.2.1. Свойства непредельных кислот
- •11.2.2. Получение непредельных кислот
- •11.3. Двухосновные кислоты
- •11.3.1. Свойства диовых кислот
- •11.3.2. Получение двухосновных кислот
- •11.4. Функциональные производные
- •11.4.1. Галогенангидриды
- •11.4.2. Ангидриды карбоновых кислот
- •11.4.3. Сложные эфиры органических
- •11.5. Применение карбоновых кислот
- •Глава 12. Номенклатура гетерофункциональных органических соединений
- •Глава 13. Оксикислоты (спиртокислоты)
- •13.1. Хиральность. Оптическая изомерия
- •13.2. Свойства оксикислот
- •13.3. Получение и применение оксикислот
- •Глава 14. Оксокислоты (альдегидо-
- •14.1. Получение и свойства
- •14.2. Ацетоуксусный эфир и таутомерия
- •Краткое руководство для студентов к решению задач
- •3. Отщепление:
- •IV. Правила реагирования органических соединений.
- •V. Некоторые именные реакции.
- •4. Вильямсона синтезы
- •9. Синтезы Гриньяра:
- •VI. Стандартные приемы получения функциональных групп различных классов органических соединений.
- •3. Получение группы (-он) спиртов.
- •4. Получение фенолов.
- •5 .. Получение оксогрупп
- •6. Получение карбоксилов (соон).
- •7. Реакции между Ме- и Hal-производными (синтезы Вильям-сона).
- •9. Дегидратация «длинных» диовых кислот.
- •VII. Виды заданий и последовательность их выполнения.
- •Андрей Вениаминович Скворцов
7.3.2. Реакции отщепления
1. Дегидрогалогенирование – результат действия на галогеналкилы спиртовых растворов щелочей, – один из основных приемов получения кратных связей (обусловливает вицинальное отщепление HHal):
а) б) бутен-2 бутин-2 – 2НСl 2,3-дихлорбутан 2-хлорбутан – НСl
2. Дегалогенирование полигалогенидов действием Na, Mg или Zn в спиртовой среде также дает кратные связи (а) или карбоциклы (б):
а) бутен-2 1,2-дихлорбутан
–

б) ![]()
1,4-дихлорбутан
7.3.3. Восстановление галогенидов водородом
в момент выделения
Эта группа превращений галогенидов осуществляется использованием повышенной активности атомарного водорода, который способен замещать галоген
R – Сl
+ (Zn
+ HClaq)
R
– H
+ ZnCl2
– Сl
+ (Zn
+ HClaq)
R
– H
+ ZnCl2
7.3.4. Образование металлоорганических соединений
Некоторые металлы (Mg, Zn, Pb и др.) взаимодействуют с галоген-алкилами в неполярных растворителях (эфир, тетрагидрофуран) с образованием металлоорганических соединений (например, тетраэтилсвинец Pb(C2H5)4, используемый в качестве антидетонационной присадки к моторным топливам).
Наибольшее значение для синтетической органической химии имеют реактивы В. Гриньяра (Нобелевская премия, 1912 г.)

(Применение см., например, п. 8.1.4).
7.4. Получение
Галогенопроизводные углеводородов получаются самыми различными способами.
1. Замещение атомов водорода в углеводородах на галоген:
(а) в результате галогенирования алканов, цикланов, аренов, алкенов в различных условиях получаются различные галогениды. Промышленным хлорированием метана, в зависимости от условий, получают CH3Cl, CH2Cl2, CHCl3, CCl4. Прямое хлорирование алканов обычно дает трудноразделимую смесь галогенопроизводных;
(б) бензол и его гомологи хлорируются легче, чем алканы. В зависимости от условий проведения реакций получаются разные галогенопроизводные:
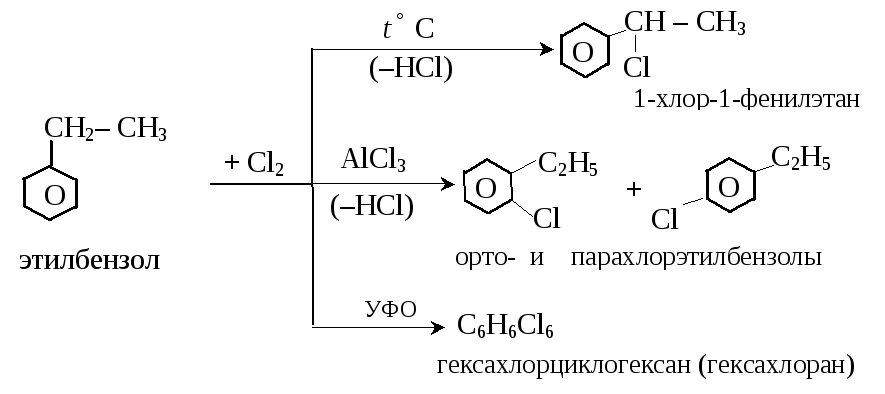
(в) возможно замещение водорода в боковой цепи алкенов при высокой температуре
![]()
![]()
2. Присоединение галогенов и галогеноводородов к ненасыщенным углеводородам:

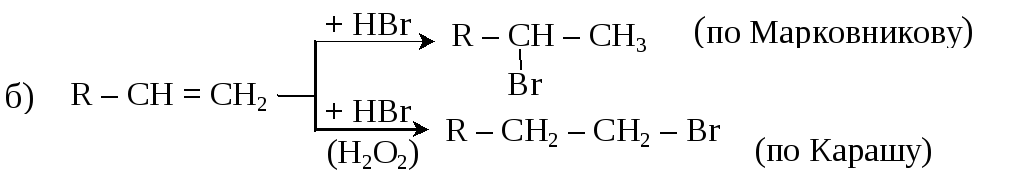
(Правило Марковникова и пероксидный эффект Караша – см. п. 3.4.2).
3. Получение галогенидов из спиртов может быть реализовано замещением спиртовой группы на галоген при действии различных галогенирующих агентов: PCl5, SOCl2 или галогеноводорода

В последнем случае CaCl2 используется в качестве водоотнимающего средства для повышения выхода галогенида.
7.5. Специфика фторопроизводных
Фторопроизводные алканов по свойствам, способам получения и использованию резко отличаются от других галогенопроизводных.
Из-за очень высокой химической активности фтора его взаимодействие с алканами происходит со взрывом и сопровождается разрушением С-скелета. Поэтому для получения фторидов используют особые методы.
1. Действие MeF на Cl-, Br- и I-производные углеводородов
C 2H5I
+ AgF C2H5F
+ AgI
2H5I
+ AgF C2H5F
+ AgI
2. Перфторсоединения – продукты полного замещения атомов водорода на атомы фтора (например, C2F6 – перфторэтан, C2F4 – перфтор-этилен и т.п.) – получают взаимодействием соединений, легко отдающих фтор (CoF3; MnF4; SbF5), с парами углеводородов
![]()
Непредельные перфториды получают действием металлического цинка на смешанные галоид-фторпроизводные
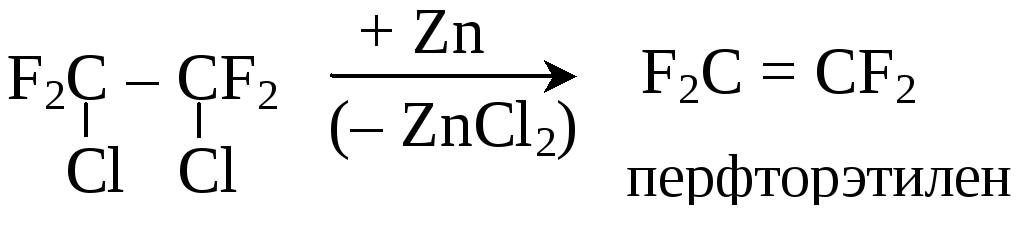
3. Прямое фторирование углеводородов может быть осуществлено в атмосфере азота
![]()
Свойства фторидов тоже значительно отличаются от свойств других галогенидов. Температуры кипения перфторуглеродов почти такие же, как у соответствующих алканов, но резко отличаются от температур кипения других галогенидов.
Монофториды, особенно третичные и вторичные, очень неустойчивы и легко отщепляют HF
![]()
Дифторпроизводные более устойчивы и малотоксичны.
Перфторсоединения отличаются исключительно высокой химической и термической устойчивостью (большинство их выдерживают нагрев до 500 С), устойчивы к действию кислот, щелочей, окислителей; неток-сичны.
