
- •А. В. Скворцов
- •Галоген- и кислородсодержащие соединения
- •Оглавление
- •Введение функциональные производные углеводородов
- •Глава 7. Галогенопроизводные углеводородов
- •7.1. Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Химические свойства
- •7.3.1. Реакции замещения
- •7.3.2. Реакции отщепления
- •7.3.3. Восстановление галогенидов водородом
- •7.3.4. Образование металлоорганических соединений
- •7.4. Получение
- •7.5. Специфика фторопроизводных
- •7.6. Использование галогенопроизводных
- •Глава 8. Оксипроизводные углеводородов (спирты и фенолы)
- •8.1. Спирты одноатомные (алкоголи)
- •8.1.1. Изомерия и номенклатура
- •8.1.2. Физические свойства
- •Физические свойства спиртов
- •8.1.3. Химические свойства
- •Б. Реакции, протекающие с разрывом связи с–он
- •В. Реакции спиртов с участием их радикалов
- •8.1.4. Получение спиртов
- •8.1.5. Использование спиртов
- •8.2. Многоатомные спирты (полиолы)
- •8.2.1. Изомерия и номенклатура
- •8.2.2. Свойства полиолов
- •8.2.3. Получение и применение полиолов
- •8.3. Фенолы и нафтолы
- •8.3.1. Физические свойства
- •Физические свойства фенолов
- •8.3.2. Химические свойства
- •8.3.3. Получение и применение
- •Глава 9. Простые эфиры
- •9.1. Изомерия и номенклатура
- •9.2. Получение
- •9.3. Свойства простых эфиров
- •9.4. Эпоксиды (органические оксиды)
- •9.5. Использование простых эфиров
- •Глава 10. Альдегиды и кетоны – оксопроизводные углеводородов
- •10.1. Предельные альдегиды и кетоны
- •10.1.1. Физические свойства
- •Физические свойства альдегидов и кетонов
- •10.1.2. Химические свойства
- •I. Реакция присоединения
- •1. С цианистым водородом
- •2. Со спиртами (образование полуацеталей, ацеталей и кеталей):
- •3. С бисульфитом натрия (NaHso3)
- •4. Присоединение аммиака
- •II. Замещение карбонильного кислорода
- •7. Замещение карбонильного кислорода хлором
- •III. Реакции с участием атомов водорода в -положении
- •8. Галогенирование радикалов оксосоединений
- •9. Альдольно-кротоновая конденсация
- •10. Конденсация с алкинами-1 (синтезы Фаворского)
- •15. Диспропорционирование альдегидов
- •V. Реакции олиго- и полиМеРизации
- •10.2. Непредельные оксосоединения
- •10.2.1. Сопряженные (, -ненасыщенные)
- •4. Оксид серебра окисляет только альдегидную группу
- •10.2.2. Кетены (карбонилы с кумулированными связями
- •10.3. Дикарбонильные соединения
- •10.4. Получение оксосоединений
- •10.5. Применение оксосоединений
- •Глава 11. Карбоновые кислоты и их производные
- •11.1. Одноосновные предельные кислоты
- •11.1.1. Физические свойства
- •Физические свойства некоторых одноосновных карбоновых кислот
- •11.1.2. Химические свойства
- •11.1.3. Способы получения
- •11.2. Одноосновные непредельные кислоты
- •11.2.1. Свойства непредельных кислот
- •11.2.2. Получение непредельных кислот
- •11.3. Двухосновные кислоты
- •11.3.1. Свойства диовых кислот
- •11.3.2. Получение двухосновных кислот
- •11.4. Функциональные производные
- •11.4.1. Галогенангидриды
- •11.4.2. Ангидриды карбоновых кислот
- •11.4.3. Сложные эфиры органических
- •11.5. Применение карбоновых кислот
- •Глава 12. Номенклатура гетерофункциональных органических соединений
- •Глава 13. Оксикислоты (спиртокислоты)
- •13.1. Хиральность. Оптическая изомерия
- •13.2. Свойства оксикислот
- •13.3. Получение и применение оксикислот
- •Глава 14. Оксокислоты (альдегидо-
- •14.1. Получение и свойства
- •14.2. Ацетоуксусный эфир и таутомерия
- •Краткое руководство для студентов к решению задач
- •3. Отщепление:
- •IV. Правила реагирования органических соединений.
- •V. Некоторые именные реакции.
- •4. Вильямсона синтезы
- •9. Синтезы Гриньяра:
- •VI. Стандартные приемы получения функциональных групп различных классов органических соединений.
- •3. Получение группы (-он) спиртов.
- •4. Получение фенолов.
- •5 .. Получение оксогрупп
- •6. Получение карбоксилов (соон).
- •7. Реакции между Ме- и Hal-производными (синтезы Вильям-сона).
- •9. Дегидратация «длинных» диовых кислот.
- •VII. Виды заданий и последовательность их выполнения.
- •Андрей Вениаминович Скворцов
11.4. Функциональные производные
карбоновых кислот
При замене в карбоксильной группе карбоновой кислоты иона Н+ на ион металла или при замене гидроксила на галоген (F; Cl; Br), на группы OCOR, OR1, NH2 образуются разнообразные функциональные производные кислот: соли, галогенангидриды, ангидриды, сложные эфиры, амиды кислот (схему см. в п. 11.1.2, б).
Одновалентный остаток кислоты, образовавшийся после удаления гидроксильной группы (R–C(O)–), называется кислотным радикалом или а ц и л о м (обозначается Ас). Название наиболее часто встречающихся ацилов:
![]()
формил ацетил пропионил бутирил
![]()
![]()
изо-бутирил валерил бензоил
Основные
химические превращения ацильных
соединений связаны с заменой группы А
в
![]() на другие группировки. Во всех этих
превращениях функциональные производные
выступают в качестве ацилирующих
агентов, в ходе которых происходит
введение в молекулу ацильного остатка
– р е а к ц и и а ц и л и р о в а н и я.
Кроме реакций ацилирования производные
кислот способны восстанавливаться,
галогенироваться и вступать в некоторые
другие реакции.
на другие группировки. Во всех этих
превращениях функциональные производные
выступают в качестве ацилирующих
агентов, в ходе которых происходит
введение в молекулу ацильного остатка
– р е а к ц и и а ц и л и р о в а н и я.
Кроме реакций ацилирования производные
кислот способны восстанавливаться,
галогенироваться и вступать в некоторые
другие реакции.
11.4.1. Галогенангидриды
Общая
формула:
![]() ,
где Х – фтор, хлор, бром, йод. Название
их строится по принципу галогеналкилов:
называется ацил и атом галогена, например:
,
где Х – фтор, хлор, бром, йод. Название
их строится по принципу галогеналкилов:
называется ацил и атом галогена, например:
![]() –формилхлорид;
–формилхлорид;![]() – ацетилбромид и т.д. Ис-пользуются и
полные названия: соответственно
хлорангидрид муравьиной кислоты;
бромангидрид уксусной кислоты и т.д.
– ацетилбромид и т.д. Ис-пользуются и
полные названия: соответственно
хлорангидрид муравьиной кислоты;
бромангидрид уксусной кислоты и т.д.
Получают галогенангидриды действием галогенидов фосфора (PCl5, PCl3), тионилхлорида SOCl2 на кислоты или их ангидриды
![]()
![]()
![]()
Галогенангидриды – наиболее реакционноспособные производные карбоновых кислот. Хлорангидриды ароматического ряда менее активны, чем алифатического.
Галогенангидриды восстанавливаются до альдегидов или спиртов:
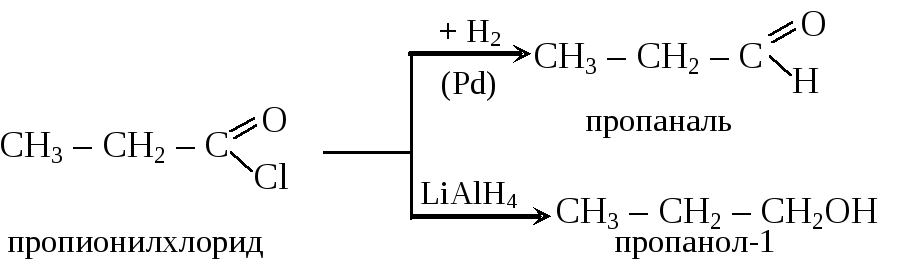
Реакции ацилирования:
фенилалкилкетон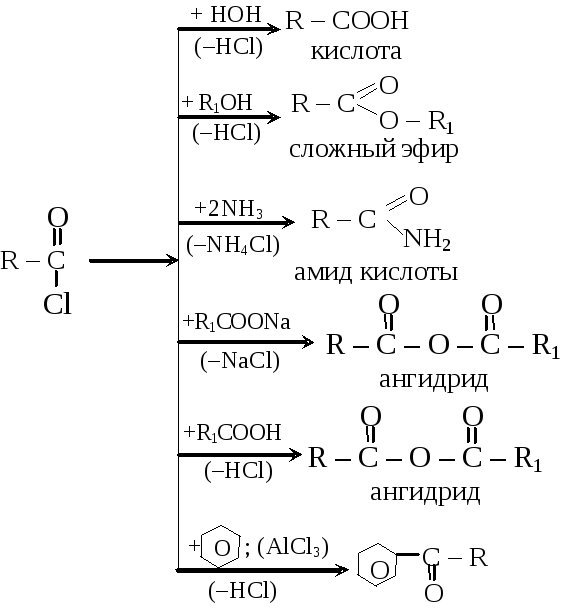
Важным для органических синтезов является полный хлорангидрид угольной кислоты – фосген COCl2
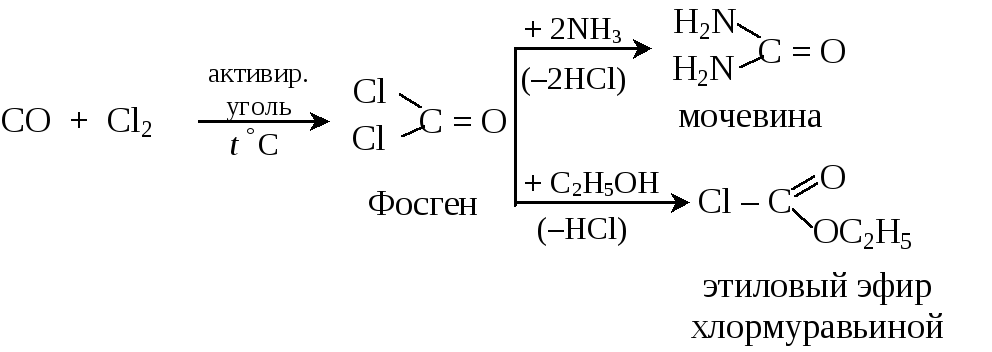
11.4.2. Ангидриды карбоновых кислот
Получаются межмолекулярной дегидратацией карбоновых кислот
![]()
![]() .
.
Смешанные ангидриды получают взаимодействием солей с хлорангидридами
![]()
![]()
(соль) (хлорангидрид) (смешанный ангидрид)
Ангидрид может быть получен взаимодействием кетена с карбоновой кислотой
![]()
(уксусная кислота) (кетен) (уксусный ангидрид)
Реакция используется в промышленности.
По химическим свойствам ангидриды напоминают хлорангидриды, но реакции ацилирования с ними протекают более мягко, чем с хлорангидридами
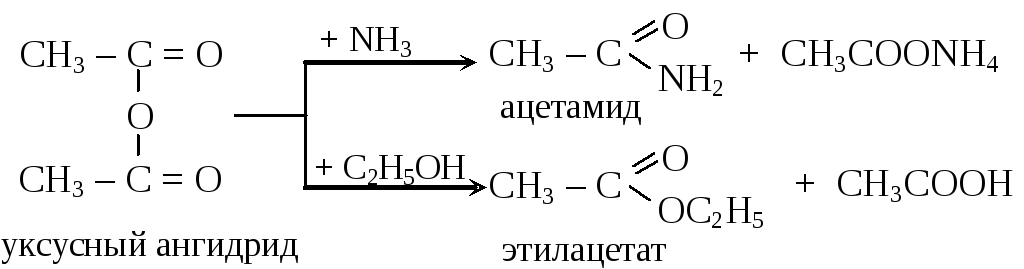
11.4.3. Сложные эфиры органических
и минеральных кислот
Сложные
эфиры являются наиболее важными
функциональными производными кислот.
Общая формула
![]() .
Формально эти соединения могут
рассматриваться как соли алкилов
(продукты замещения кислотного водорода
на углеводородный радикал), откуда и их
названия. Рациональное название строится
также по принципу «алкиловый эфир
карбоновой кислоты»
.
Формально эти соединения могут
рассматриваться как соли алкилов
(продукты замещения кислотного водорода
на углеводородный радикал), откуда и их
названия. Рациональное название строится
также по принципу «алкиловый эфир
карбоновой кислоты»
![]()
![]()
этиловый эфир изопропиловый эфир
муравьиной кислоты, бензойной кислоты,
(р.н.) этилформиат, [изопропилбензоат]
[м.н.] [этилметаноат]
Сложные эфиры широко распространены в природе. Аромат многих плодов, цветов обусловлен присутствием в них сложных эфиров. Так, этилформиат имеет запах рома, изоамилацетат – груш, этилбутират – абрикосов, изоамилбутират – ананасов, изоамиловый эфир изовалериановой кислоты имеет запах яблок, бензилацетат – запах жасмина и др. Они используются в парфюмерии и пищевой промышленности как фруктовые эссенции.
Чрезвычайно широко распространены в природе сложные эфиры высокомолекулярных кислот и спиртов – воски; жиры – сложные эфиры глицерина и высших карбоновых кислот (см. раздел «Липиды»).
Получают сложные эфиры или из природных продуктов (жиры, растительные и эфирные масла) или синтетически:
– реакция этерификации
![]()
– взаимодействие хлорангидридов и ангидридов кислот со спиртами или фенолами
![]()
бензоилхлорид этилбензоат
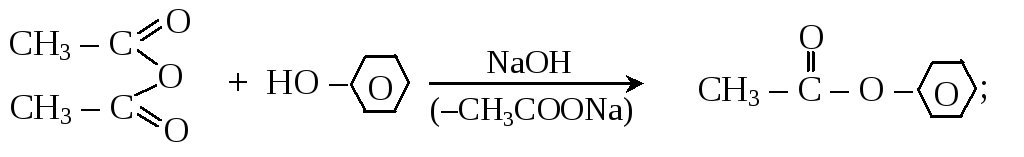
фенол фенилацетат
– промышленное значение имеют реакции присоединения карбоновых кислот к алкенам и к ацетилену
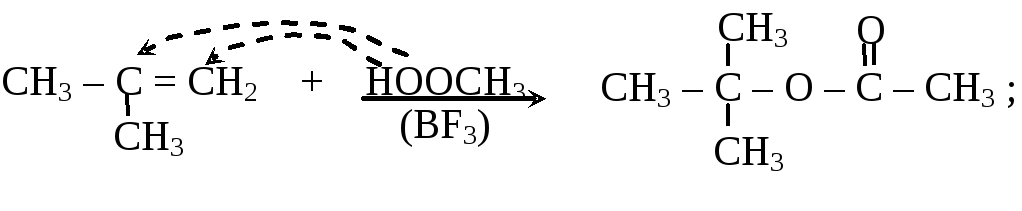
изобутилен трет-бутилацетат
![]()
ацетилен винилацетат
Винилацетат является промышленным продуктом для получения полимеров (ПВА).
1. Гидролиз (омыление) сложных эфиров – важнейшее их свойство (реакция, обратная реакция этерификации). Протекает в кислой среде (обратимо) или в щелочной среде (необратимо). В последнем случае одним из продуктов реакции является соль. Соли высших (жирных) кислот являются мылами, отсюда название реакции – омыление.
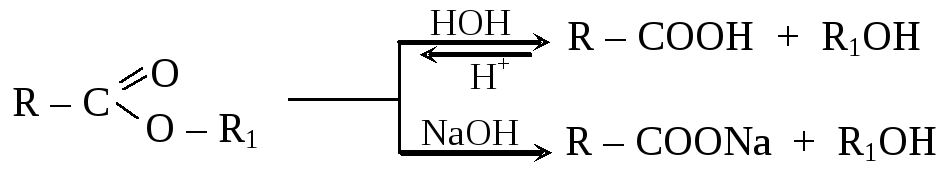
2. Перетерификация – замена спиртового остатка в молекуле сложного эфира на другой спиртовой остаток, происходящая при нагревании эфиров со спиртами в кислой или щелочной среде
![]()
3. Восстановление сложных эфиров протекает легче, чем самих кислот. В результате образуется смесь спиртов
![]()
Восстановители – натрий в кипящем спирте или литийалюминийгидрид.
4. К окислению сложные эфиры устойчивы. Это используется в реакциях окисления для защиты от окисления альдегидных спиртовых или фенольных групп, которые предварительно этерифицируются. После проведения окисления других фрагментов молекул альдегидные, фенольные или спиртовые группы регенерируются гидролизом.
5. Действие аммиака (аммонолиз) приводит к образованию амидов кислот
![]()
В образовании сложных эфиров могут участвовать и минеральные кислородсодержащие кислоты (HNO3; H2SO4; H3BO3; H3PO4)
![]()
серная кислота метилсерная кислота диметилсульфат
(монометилсульфат)
Эти соединения играют очень важную роль как в технике, так и в биологии. Так, алкилсульфаты используют как сильные алкилирующие реагенты. Через алкилсерные кислоты идет образование простых эфиров. Из эфиров азотной кислоты практическое значение имеют нитраты глицерина и этиленгликоля – взрывчатые вещества.
Огромное биологическое значение имеют эфиры фосфорной кислоты – АТФ, нуклеиновые кислоты, фосфолипиды и др.
