
- •Классическая статистическая физика Основные положения
- •Фазовое пространство системы частиц
- •Число степеней свободы
- •«Вымерзание» степеней свободы
- •Размерность фазового пространства
- •Число микросостояний в элементе объема Элемент объема фазового пространства равен
- •Объем и площадь n-мерной сферы
- •Фазовая траектория
- •Фазовый ансамбль
- •Теорема Лиувилля
- •, . (2.5)
- •Следствия теоремы
- •Микроканоническое распределение Основные понятия и определения
- •Распределение микросостояний по фазовому пространству
- •Энергетическая плотность спектра состояний
- •Нормировочная постоянная распределения
- •Микроканоническое распределение
- •Вариация числа микросостояний при изменении объема
- •Свойства энтропии
- •Пример 1
- •Пример 2
- •Каноническое распределение
- •Распределение микросостояний по фазовому пространству
- •Статистический интеграл частицы
- •Энергетическая плотность спектра состояний. Распределение микросостояний по энергии
- •Пример 1
- •Пример 2
- •Свободная энергия и статистический интеграл
- •Внутренняя энергия и статистический интеграл
- •Уравнение Гиббса–Гельмгольца
- •Термодинамические потенциалы
- •Физический смысл свободной энергии
- •Связанная энергия
- •Давление, энтропия и статистический интеграл
- •Статистический смысл энтропии
- •ТеоремА Бора – Ван-лЁвен
- •Пример 1
- •Пример 2
- •Пример 3
- •Распределение тепловой энергии по степеням свободы
- •Гамильтониан частицы
- •Средняя энергия частицы
- •Примеры
- •Неустранимая погрешность измерительного прибота
- •Флуктуации напряжения в колебательном контуре
- •Флуктуационная эдс активного сопротивления
- •Молярная теплоемкость простого тела. Закон Дюлонга и Пти
- •Вопросы коллоквиума
Свободная энергия и статистический интеграл
Из
(2.15) и (2.16) получаем соотношение между
свободной энергией и статистическим
интегралом
![]() ,
тогда
,
тогда
![]() .
(2.25)
.
(2.25)
Термодинамическая величина F выражена через статистическую величину Z, которая вычисляется интегрированием гамильтониана системы по фазовому пространству
![]() .
.
Соотношение
(2.18)
![]() подставляем в (2.25) и получаем
подставляем в (2.25) и получаем
 ,
(2.25а)
,
(2.25а)
где
при
![]() использована формула Стирлинга
использована формула Стирлинга![]() .
Подстановка (2.24в) дает
.
Подстановка (2.24в) дает
 ,
(2.25б)
,
(2.25б)
где
![]() – энергетическая плотность спектра
состояний частицы.
– энергетическая плотность спектра
состояний частицы.
Внутренняя энергия и статистический интеграл
Внутренняя энергия является средним по фазовому ансамблю значением полной энергии системы
![]() .
.
Используем (2.16) и (2.17)
-
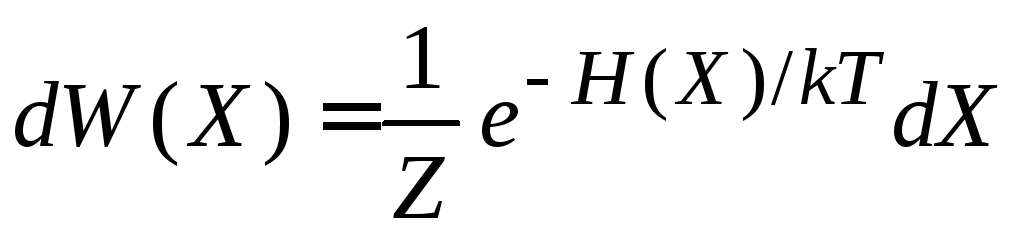 ,
, ,
,
находим
 ,
,
где использовано
 ,
,
 .
.
Учитываем
 ,
,
и получаем выражение внутренней энергии через статистический интеграл
 .
(2.26)
.
(2.26)
Уравнение Гиббса–Гельмгольца
Соотношение между внутренней и свободной энергиями называется в термодинамике уравнением Гиббса–Гельмгольца. Для его получения исключим статистический интеграл из (2.25) и (2.26).
Выражение (2.25)
![]()
записываем в виде
![]()
и подставляем в (2.26). Получаем известное в термодинамике уравнение Гиббса–Гельмгольца
 .
(2.27)
.
(2.27)
Следовательно, F – свободная энергия. Из (2.27) находим теплоемкость
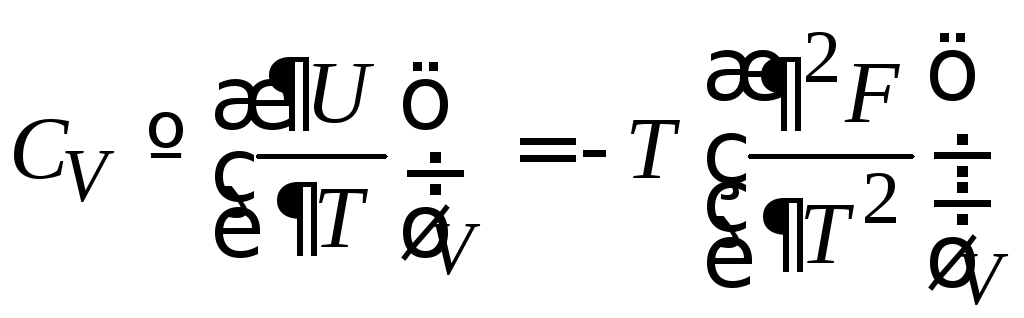 .
(2.27а)
.
(2.27а)
Выразим F через U. В первом равенстве (2.27) перегруппировываем сомножители и получаем
 .
.
Интегрируем и выражаем свободную энергию через внутреннюю энергию
 ,
(2.28)
,
(2.28)
где
учтено
![]() ,
как следует из (2.28).
,
как следует из (2.28).
Термодинамические потенциалы
Потенциалом называется функция состояния системы, не зависящая от пути перехода системы в это состояние.
Свойства потенциала:
1.
Для потенциальной функции
![]() выполняется
выполняется
 ;
;
2.
При
![]() интеграл равен нулю – изменение
потенциала при переходе системы из
некоторого состояния по замкнутому
пути в исходное состояние равно нулю;
интеграл равен нулю – изменение
потенциала при переходе системы из
некоторого состояния по замкнутому
пути в исходное состояние равно нулю;
3. Потенциал является полным дифференциалом своих аргументов.
Термодинамические потенциалы являются функциями макроскопических характеристик состояния системы: T, V, P, S, N, и отличаются друг от друга набором аргументов.
Внутренняя энергия – термодинамический потенциал, зависящий от объема, числа частиц и энтропии:
![]() .
.
Полный дифференциал
 .
(2.29)
.
(2.29)
Из первого начала термодинамики
![]() ,
,
и
из определений энтропии и работы для
равновесного, обратимого процесса
при
![]()
![]() ,
,
![]()
находим
![]() .
(2.29а)
.
(2.29а)
Сравнение с (2.29) дает
 ,
,
 .
(2.29б)
.
(2.29б)
Свободная энергия – термодинамический потенциал, зависящий от объема, числа частиц и температуры:
![]() ,
,
 .
(2.30а)
.
(2.30а)
Энтропия – термодинамический потенциал, зависящий от внутренней энергии, объема и числа частиц:
![]() ,
,
 .
(2.30б)
.
(2.30б)
Физический смысл свободной энергии
В термодинамике свободная энергия определяется в виде
![]() .
(2.31)
.
(2.31)
Берем дифференциал
![]() .
(2.31а)
.
(2.31а)
Для равновесного, обратимого процесса используем определение энтропии и первое начало термодинамики
![]() ,
,
![]() .
.
Сравниваем
с (2.31а) при
![]() ,
и получаем
,
и получаем
![]() .
.
Свободная энергия является частью внутренней энергии, которая при изотермическом процессе переходит в работу.
Из
(2.31) следует
![]() – свободная энергия равна внутренней
энергии при
– свободная энергия равна внутренней
энергии при![]() .
.
