
Органическая химия.3828
.pdf
Напишите реакции образования Fe-комплексов с фенолом и резорцином.
б) В пробирку внесите 0,5 мл концентрированной H2SO4 и добавьте при перемешивании 2-3 капли 5 %-го раствора фенола. Смесь охладите в ледяной воде. К полученному раствора добавьте каплю 5 %-го раствора NaNO2. Появляется интенсивно розовое окрашивание, которое при добавлении 5 %-го NaOH (до щелочной среды) переходит в синезеленое за счет образования индофенола:
O 
 N
N 
 OH
OH
Интенсивная окраска обусловлена образованием в молекуле индофенола хиноидной группировки.
Опыт 8. Доказательство кислотного характера фенолов
(а) Универсальным индикатором определить рН растворов фенола и резорцина.
(б) В пробирку прилейте каплю “жидкого фенола” и 5 капель Н2О (встряхните). К полученной эмульсии фенола добавьте 2 капли NaOH, получится раствор фенолята натрия. К раствору фенолята добавьте 2 капли HCl, – раствор мутнеет вследствие выделения свободного фенола. Напишите уравнения реакций.
Опыт 9. Бромирование фенолов
В две пробирки поместите по 1 мл 1 %-х растворов фенола (в первую) и резорцина (во вторую). В каждую добавьте по каплям бромной воды. Наблюдается образование осадков трибромфенолов и обесцвечивание бромной воды.
Напишите уравнения реакций.
21
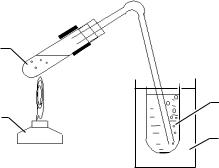
ЛАБОРАТОРНАЯ РАБОТА № 5
АЛЬДЕГИДЫ И КЕТОНЫ
Цель работы. Сопоставить свойства альдегидов и кетонов, познакомиться с их качественными реакциями.
Опыт 1. Получение ацетальдегида окислением этанола дихроматом калия
2
3
1
4
с н е г
Рис. 5. Схема прибора для получения ацетальдегида:
1 – спиртовка; 2 – пробирка с газоотводной трубкой; 3 – пробирка-приемник с дистилли–
рованной Н2О; 4 – стакан со снегом
В сухую пробирку насыпьте 0,5 г K2Cr2O7 и прилейте 2 мл 10-го % раствора H2SO4 и постепенно при встряхивании добавьте 2 мл этанола. Смесь разогревается и происходит изменение ее цвета от оранжевокрасного до зелено-бурого.
Пробирку закройте пробкой с газоотводной трубкой и закрепите в лапке штатива.
Конец трубки погрузите в пробирку-приемник с дистиллированной водой, помещенную предварительно в стакан со льдом (рис. 5).
Пробирку с реакционной смесью осторожно нагрейте в пламени спиртовки и в течение 3–4 мин отгоняйте летучие продукты.
Напишите уравнение реакции окисления спирта дихроматом калия в кислой среде и подберите коэффициенты методом электронного баланса.
22
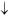
Наличие ацетальдегида обнаруживается по запаху. Раствор использовать для реакций «серебряного» и «медного» зеркала и для альдольной конденсации.
Опыт 2. Окисление альдегида (качественные реакции на альдегидную группу)
2.1. Реакция “серебряного зеркала”
К 2–3 мл реактива Толленса [Ag(NH3)2]OH (получение – см. стр.13) добавьте 5-6 капель ацетальдегида, полученного в предыдущем опыте 1, греть на водяной бане. Положительной реакцией на альдегиды считается появление бурой окраски бесцветного раствора реактива Толленса. При продолжительном (>1мин) нагревании содержимого пробирки восстановленное серебро может образовать блестящий металлический налет (“серебряное зеркало”).
Вступают ли в эту реакцию кетоны?
Напишите уравнение реакции окисления альдегида.
2.2. Реакция “медного зеркала”
В пробирку налейте 1 мл полученного в опыте 1 ацетальдегида, прибавьте 1 мл 10 %-го раствора NaOH, а затем при встряхивании по каплям добавить 2 %-й раствор CuSO4 до появления неисчезающей взвеси гидроксида меди(II) и сильно разбавьте водой:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4.
Затем верхнюю часть пробирки нагрейте до кипения – до образования желтого осадка CuOH. В этом опыте Cu(OH)2, имеющий голубую окраску, восстанавливается только до CuOH, окрашенного в желтый цвет. Металлическая медь (“медное зеркало“) получается только с
формальдегидом (остальные альдегиды восстанавливают Cu+2 только до Cu+1).
Напишите соответствующее уравнение реакции.
Опыт 3. Альдольно-кротоновая конденсация ацетальдегида
3.1. Получение альдоля (реакция Бородина)
Сухую пробирку охладите (снегом) и налейте в нее 1-1,5 мл альдегида (полученного в опыте 1). Не вынимая пробирки из стакана с ледяной водой, добавьте 5-6 капель 30 %-го раствора NaОН и повстряхивайте. Наблюдайте постепенное ослабление запаха ацетальдегида и образование вязкой жидкости – альдоля (приятный запах).
Напишите уравнение реакции димеризации ацетальдегида.
23
3.2. Кротоновая конденсация
Выньте пробирку из стакана с ледяной водой и вытрите ее снаружи. Подкислите содержимое – добавьте 6 капель 30 % CH3COOH и осторожно нагрейте. Отметьте запах продукта конденсации альдоля – кротонового альдегида – соединение с резким неприятным запахом. При достаточно долгом нагревании жидкость становится бурой – образуется смола.
Напишите уравнение реакции кротоновой конденсации альдоля. Какие продукты получаются при конденсации пропионового и
триметилуксусного альдегидов?
Опыт 4. Получение ацетона
|
|
|
|
|
4.1. Получение ацетона пиролизом |
||
|
а |
|
|
|
|||
|
|
|
б |
||||
|
|
|
ацетата кальция (или натрия). |
||||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
В пробирку (рис. 6, а) насыпьте су- |
||
|
|
|
|
|
хого ацетата на h ~ 1,5 см и закройте |
||
|
|
|
|
|
пробкой с |
короткой |
газоотводной |
|
|
|
|
|
трубкой. В пробирку (рис. 6, б) налей- |
||
|
|
|
|
|
те 2 мл H2O и поместите ее в снеговую |
||
|
|
|
|
|
воду. Пробирку а закрепите почти го- |
||
|
|
|
|
|
ризонтально, |
погрузив |
газоотводную |
|
|
|
|
|
трубку в воду в пробирке б (рис. 6). |
||
|
|
|
|
|
Нагревайте пробирку а до плавления |
||
|
|
|
|
|
|||
Рис. 6. Схема установки |
ацетата. Выделяющиеся при этом пары |
|
ацетона конденсируются в воде про- |
||
для получения ацетона |
||
бирки б. |
||
|
Реакция прекращается через 10–20 с. В пробирке б ощущается за-
пах ацетона (сравните с запахом реактива). После остывания пробирки а в нее добавьте 1 каплю HCl – идет энергичное выделение CO2.
Напишите уравнения реакций.
4.2. Доказательство образования ацетона (йодоформная проба Либена).
К капле раствора I2 в KI добавьте 5 капель 2 н. NaOH и каплю Продукта (здесь: Продукт – результат опыта 4.1). Немедленно, без нагрева, выпадает осадок с характерным запахом йодоформа. (Проба Либена обнаруживает ацетон в растворах с концентрацией ~0,04 %.)
24
Опыт 5. Получение оксима ацетона
В пробирке с 6–7 мл дистиллированной H2O, охлажденной в стакане со снегом (или в ледяной воде), растворить ~ 2 г сернокислого гидроксиламина NH2OH H2SO4 + 1,5 г Na2CO3. Наблюдается бурное выделение CO2. К охлажденному и нейтрализованному раствору NH2OH добавить (при встряхивании) 10-15 капель ацетона (реактив). Наблюдается некоторый разогрев раствора (экзоэффект) и образование кристаллов кетоксима (см. в микроскопе) – оксима ацетона. В кислой среде оксимы легко гидролизуются при небольшом нагреве (регенерируется ацетон).
Напишите уравнения реакций образования кетоксима и его гидролиза.
Опыт 6. Получение акролеина из глицерина
В пробирку к 3-4 кристаллам KHSO4 добавить одну каплю глицерина. Греть на спиртовке до побурения жидкости и появления тяжелых паров.
Образование акролеина может быть зафиксировано по резкому острому запаху (название акролеин от латинского acris = острый, жгу-
чий; oleum = масло).
Схема образования акролеина приведена ниже. Акролеин – простейший непредельный альдегид. Реакция образования акролеина используется для обнаружения глицерина и жиров (акролеиновая проба).
H2C - OH + H -
OH + H - OSO3K H - C - OH + H - OSO3K
OSO3K H - C - OH + H - OSO3K
H - C - OH |
t oC |
||
(-2H2O) |
|||
|
|
||
H |
|||
|
|||
глицерин |
|
||
H C - OSO K |
|
CH |
|
|
CH2 |
|||||
2 |
|
3 |
|
|
|
2 |
|
|
|
CH |
H-C - OSO3K |
|
C H |
|
|
||||||
H - C - OH |
|
|
t oC |
|
|
|
|
|
C=O |
|
|
|
C - O |
|
|
||||||
|
|
(-2KHSO4) |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
H |
||||
калиевая соль
дисернокислого пропадиенол акролеин эфира глицерина
25
ЛАБОРАТОРНАЯ РАБОТА № 6
КАРБОНОВЫЕ КИСЛОТЫ
Цель работы. Сопоставить свойства карбоновых кислот, познакомиться с их качественными реакциями.
Опыт 1. Растворимость карбоновых кислот в воде Сравнение их кислотности
В маленькие пробирки налейте по 3 мл Н2О и добавьте по 0,5 мл жидкой или 0,5 г твердой карбоновой кислоты. Перемешайте содержимое пробирок. Отметьте растворимость кислот, в том числе при нагревании (тех, которые плохо растворяются при комнатной температуре). Объясните различия в растворимости.
На универсальную индикаторную бумагу нанести по одной капле растворов кислот и определить их рН.
Напишите уравнения реакций диссоциации этих кислот. Полученные растворы оставьте для использования в опыте 2.
Опыт 2. Сравнение окисляемости кислот
Отберите по 3 капли растворов соответствующих кислот (из опыта 1), добавьте по 2–3 капли 2 н. H2SO4 и по 3 капли 5 %-го раствора KMnO4. Сопоставьте окисляемость различных кислот с их строением. Напишите соответствующие уравнения реакций.
Опыт 3. Получение сложного эфира
(а) Приготовьте 1/2 пробирки насыщенного раствора NaCl.
(б) Приготовьте смесь (*): в сухую пробирку наливают 2 мл кислоты, 2 мл спирта + 0,5 мл конц. H2SO4. Содержимое пробирки тщательно перемешайте. Смесь осторожно кипятите на слабом огне 2–3 мин. После охлаждения вылейте в пробирку с насыщенным раствором NaCl. Образовавшийся эфир всплывает на поверхность, непрореагировавшие кислоты – в водной фазе.
Отметьте запах полученного эфира (нюхать осторожно); напишите уравнение реакции образования эфира.
(*) Прием получения сложных эфиров различного состава – стандартный.
Вид получаемого эфира – по выбору:
26

H-C O |
((ээтилилформиат))-–ззапахпахрромама |
OC2H5 |
|
CH -C O |
(эт лацетат) - за ах яб ок |
3 |
(этилацетат) – запах яблок |
OC2H5 |
|
CH3-C O |
(изоамилацетат) -–ззапахах ггруши |
OC5H11 |
|
CH -(CH ) -C O |
(этилбутират) – |
3 2 2 |
- ззапахпах аананасаанаса |
OC2H5 |
|
Такого типа эфиры используются для изготовления фруктовых эссенций и в парфюмерии.
Опыт 4. Соли уксусной кислоты
4.1. Получение ацетата меди(II)
В пробирку внесите 0,1–0,2 г CuO и 2 мл CH3COOH и осторожно нагрейте на пламени горелки.
Обратите внимание на изменение окраски раствора. Напишите уравнение реакции.
4.2. Получение и гидролиз ацетата железа(III)
В пробирку к нескольким кристаллам CH3COONa, растворенным в 2–3 мл H2O, добавьте 5-6 капель FeCl3, перемешайте. Наблюдается появление желтовато-красного окрашивания.
Образовавшийся ацетат железа (III) – соль слабой кислоты и очень слабого основания – гидролизуется по катиону ступенчато:
1-я ступень – в момент образования средней соли; 2-я ступень – при нагревании; 3- я ступень – при кипячении.
Растворимость: гидроксоацетат (р); дигидроксоацетат (м); гидроксид железа (III) (н).
Данная реакция используется для удаления трехвалентного железа из раствора.
27

Реализуйте ступенчатый гидролиз и напишите соответствующие уравнения реакций.
Опыт 5. Получение бензоатов натрия и железа(III)
В пробирку с осадком бензойной кислоты (из опыта 1) добавьте по каплям 10 %-й раствор NaOH до растворения осадка. Затем по каплям добавьте 2 н. H2SO4 до образования осадка и снова NaOH до растворе-
ния осадка (избегать избытка щелочи!).
К полученному раствору бензоата натрия добавьте несколько капель FeCl3. Напишите все уравнения реакций.
Опыт 6. Получение щавелевой кислоты и ее свойства
6.1. Получение оксалата натрия из формиата натрия
В сухую пробирку вносят 1–2 г формиата натрия HCОONa и нагревают в пламени горелки. Сначала соль плавится, испаряется кристаллизационная вода, а затем формиат натрия отвердевает и начинается его разложение с выделением водорода
2 НСOONa |
tпл |
Na2C2O4 |
+ Н2 |
|
Нагревают осторожно, чтобы вещество не обуглилось, продолжают нагревать до полного прекращения выделения водорода.
После охлаждения в пробирку добавляют 2–3 мл дистиллированной воды, перемешивают до полного растворения плава. При наличии обуглившихся частиц раствор отфильтровать. К фильтрату по каплям добавить 0,5 н. раствор CaCl2. Что наблюдаете? Выпадает ли осадок, если к приготовленному в отдельной пробирке раствору формиата натрия прибавить раствор СаCl2?
Осадок оксалата кальция разделить на две пробирки. К одной прилить 10 %-ю соляную кислоту, а к другой – уксусную.
Запишите соответствующие уравнения реакций и наблюдения.
6.2. Окисление щавелевой кислоты перманганатом калия
В пробирку наливают 1 мл насыщенного раствора щавелевой кислоты, добавляют 1 мл 10 %-го раствора серной кислоты и 2 мл 5 %-го раствора перманганата калия. Пробирку закрывают пробкой с газоотводной трубкой, конец которой погружают в известковую воду. Смесь нагревают несильно, раствор быстро обесцвечивается, а известковая вода мутнеет.
28

Запишите уравнение реакции окисления щавелевой кислоты раствором KMnO4 в кислой среде, подберите коэффициенты методом ионно-электронного баланса.
Опыт 7. Качественная реакция -оксикислот с FeCl3
(а) В пробирку налейте 1 каплю 1 %-го раствора фенола, добавьте 3 мл H2O и 1 мл 3 %-го раствора FeCl3. Полученный темно-фиолето- вый раствор разлить на три пробирки.
(б) Приготовьте 2–3 %-е растворы оксикислот – молочной, винной, лимонной: 2 капли раствора каждой кислоты (из опыта 1) и добавьте 5–6 капель H2O.
(в) Слейте растворы кислоты с фиолетовым раствором железофенольного комплекса (а) – появляется лимонно-желтое окрашивание раствора, характерное для -оксикислот (сравните с окраской ацетата железа).
(г) Осуществите эту реакцию для определения наличия молочной кислоты в молочной сыворотке, в капустном и огуречном рассоле. Запишите наблюдения.
Опыт 8. Свойства винной кислоты
8.1. Получение гидротартрата и тартрата калия
В пробирку к 1 мл раствора винной кислоты (из оп. 1) добавьте, встрахивая, несколько капель 0,1 н. КОН и наблюдайте выпадение осадка кислой соли КНС4Н4О6 (если осадок сразу не выпадает, то пробирку охладить в снеговой воде).
К осадку добавить избыток КОН и наблюдать растворение осадка гидротартрата из-за образования средней соли К2С4Н4О6.
(Соль КНС4Н4О6 – одна из немногих солей щелочных металлов с ограниченной растворимостью, что используется в аналитической химии для обнаружения ионов К+.)
8.2. Получение реактива Фелинга
В пробирку поместите 2 капли CuSO4, + 3 капли NaOH и раствор тартрата калия из опыта 8.1. Взболтайте содержимое пробирки и наблюдайте внешний эффект реакции образования синего раствора тартратного комплекса меди – реактива Фелинга:
29
|
|
|
|
|
|
|
|
Na+ |
-OOC - CH - O H |
O - CH - COO- |
K+ |
||||
|
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
|
|
K+ |
-OOC - CH - O |
O - CH - COO- |
Na+ |
||||
|
|
|
|
H |
|
|
|
Реактив Фелинга используется для качественного и количественного определения альдегидов, углеводов и других восстановителей.
Опыт 9. Свойства лимонной кислоты
9.1. Разложение лимонной кислоты (под тягой!)
а) Приготовьте два испытательных раствора, через которые будут пропускаться продукты разложения:
–баритовой воды;
–2–3 капли I2 в KI + 10-15 капель 2 н. NaOH.
(б) В пробирку с газоотоводной трубкой поместите ~1 г кристаллической лимонной кислоты + 2 мл конц. H2SO4. Закрепите пробирку в наклонном положении. Осторожно нагрейте – сразу начинается разложение лимонной кислоты с образованием СО, СО2 и ацетона:
OH


|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t oC |
|
|
|
|
|
|
HOOC - CH2 - C - CH2 - |
|
COOH |
CO |
+ 2 CO2 |
|
+ H2O + H3C- |
C-CH3 |
|||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
COOH |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Появление и вид продуктов фиксируются:
1)СО – поджигание газа у газоотводной трубки (голубое пламя);
2)CO2 – баритовой водой (BaCO3 );
3)ацетон – иодоформной пробой Либена (см. опыт 3 в лабораторной работе № 4).
9.2. Получение цитрата кальция
В пробирку вносят 1 мл 5 %-й лимонной кислоты, которую нейтрализуют 10 %-м раствором NH4OH, приливая его по каплям при перемешивании до нейтральной реакции среды (по универсальной индикаторной бумаге). К полученному раствору цитрата аммония добавляют 1 мл 5 %-го раствора СаCl2. Затем раствор осторожно нагревают до
30
