
НОВГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ ЯРОСЛАВА МУДРОГО
АРХИПОВ Г.С., Е.И.АРХИПОВА
ОСНОВЫ ИММУНОЛОГИИ
УЧЕБНОЕ ПОСОБИЕ
ВЕЛИКИЙ НОВГОРОД
2009
|
ББК 28.073 (075) А87 УДК 577. 27 (075) |
Печатается по решению РИС НовГУ
|
Рецензент
Доктор медицинских наук
Профессор В.Р.Вебер
Архипов Г.С., Е.И.Архипова
Основы иммунологии: Учебное пособие/НовГУ им.Ярослава Мудрого. – Великий Новгород, 2009. – 47 с.
В пособии изложены структура и функции иммунной системы, закономерности иммунологической реакции при взаимодействии с антигеном, о также некоторые вопросы иммунопатологического состояния.
Предназначено для студентов 1-6 курсов медицинских факультетов, а также для врачей лечебно-профилактических учреждений.
Издание 3-е, дополненное
ББК 28. 073 (075)
© Новгородский государственный
Университет, 2009
© Г.С.Архипов, Е.И.Архипова, 2009
Иммунная система организма безусловно необходима для его выживания: без нее смерть от любой инфекции была бы практически неизбежна. Но даже безотносительно к своей жизненной важности иммунная система вызывает восхищение как пример изобретательности Природы.
Сосуму Тонегава
Здоровая, нормально работающая иммунная система сама решает, как и чем лечить болезнь прицельно точно. Если мы научимся управлять иммунной системой, эта универсальная фармацевтическая фабрика произведет лекарство, необходимое организму в данный момент, там где нужно и сколько нужно…… Новая революция в медицине действительно на пороге.
Р. В. Петров, академик АН и АМН России
Введение
Мы живем в потенциально враждебном мире. Огромное множество различных организмов хотело бы использовать наши тела как удобную среду для своего развития и размножения: вирусы, бактерии, грибы, простейшие, черви. Действие защитных механизмов, препятствующих размножению таких "паразитических" для организма человека генов, и составляет основу учебной дисциплины "иммунология". Иммунитет в настоящее время рассматривают как способ защиты не только от микробов, но и от клеток и тканей любого другого чужеродного организма или веществ, несущих в себе признаки генетически чужеродной информации. Клетки и молекулы – элементы иммунной системы – узнают чуть ли не бесконечное число чужеродных разнообразных клеток и веществ, отличая их от клеток и веществ собственного организма. Когда патологический агент (антиген) попадает в организм, они обнаруживают его и мобилизируются для его уничтожения. Они помнят каждую инфекцию, так что при повторном заражении организма тем же патогеном защита проходит более эффективно, чем в первый раз. Таким образом, главная функция иммунной системы – контроль за генетическим постоянством внутренней среды путем распознавания "своего" и "чужого" и удаление из организма чужеродных агентов.
Иммунитет – это совокупность биологических явлений (процессов и механизмов), направленных на сохранение постоянства внутренней среды (гомеостаза) и защиту организма от инфекционных и других генетически чужеродных для него агентов.
Иммунологическая защита осуществляется с помощью ряда различных механизмов, которые можно разделить на две большие группы:
1. Неспецифические механизмы иммунитета, наиболее филогенетически древние, которые направлены против любого чужеродного агента.
2. Факторы специфической иммунной защиты, активация которых происходит при проникновении в организм возбудителей или веществ, имеющих определенные (специфические) антигенные свойства. В этом случае происходит размножение специальных иммунокомпетентных клеток Т- и В-лимфоцитов и выработка определенных антител, способных избирательно связываться с поверхностными антигенами паразита и его токсического продукта.
3. Регуляторные механизмы иммунного ответа, обусловленное большим количеством цитокинов, медиаторов, гормонов и других биологически активных веществ.
Факторы и механизмы неспецифической противоинфекционнои защиты
К врожденным факторам неспецифической противоинфекционной защиты организма относятся: кожные и слизистые покровы, лимфатические узлы, лизоцим и другие ферменты полости рта и желудочно-кишечного тракта, нормальная микрофлора, интерферон, натуральные киллеры (NK) и фагоцитирующие клетки (гранулоциты и макрофаги). К факторам неспецифической защиты также относится система комплемента, представляющая собой комплекс растворимых сывороточных белков, способных по принципу каскада приходить в активное состояние и способствовать уничтожению вторгшегося паразита.
КОЖА И СЛИЗИСТЫЕ ОБОЛОЧКИ
Простейший способ избежать инфицирования — это предотвратить проникновение возбудителя в организм. Главной линией “обороны” служит кожа, которая, оставаясь неповрежденной, непроницаема для большинства инфекционных агентов. Кроме того, вырабатываемые потовыми и сальными железами молочная и жирные кислоты обладают бактерицидным действием, поэтому различные микроорганизмы, не входящие в число постоянных обитателей кожных покровов, быстро исчезают с ее поверхности.
Слизь, выделяемая стенками внутренних органов, действует как защитный барьер, препятствующий прикреплению бактерий к эпителиальным клеткам. За счет движения ресничек эпителия микробы вместе со слизью удаляются из организма. Аналогичным вымывающим действием обладают слезы, моча и слюна. Во многих секретах содержатся бактерицидные компоненты, такие как кис/юта в желудочном соке, спермин и цинк в сперме, лактопероксидаза в молоке, лизоцим в слезах, носовых выделениях и слюне.
ЛИЗОЦИМ
Лизоцим является одним из наиболее древних факторов противомикробной защиты. Он расщепляет мураминовую кислоту в составе оболочки чувствительных грамположительных микроорганизмов и в отдельных случаях может даже вызвать бактериолиз. Он синтезируется гранулоцитами, моноцитами и тканевыми макрофагами, может накапливаться в секреторных гранулах и лизосомах фагоцитов. При лизисе грамотрицательных бактерий лизоцим действует совместно с системой комплемента. В связи с этим он является важным фактором сывороточной бактерицидности, одновременно он присутствует также во всех жидкостях организма. Определение уровня его концентрации дает возможность оценить активность фагоцитарной системы. Снижение лизоцима наблюдается и при обострении хронических воспалительных заболеваний
НОРМАЛЬНАЯ МИКРОФЛОРА
Нормальная микрофлора способствует созреванию иммунной системы и поддержанию ее в состоянии высокой функциональной активности, что показано при исследовании гнотобионтов – организмов, развивающихся в стерильных условиях. Выступая в качестве антагонистов, представители нормальной микрофлоры препятствуют адгезии, внедрению и размножению патогенных микроорганизмов. В то же время представители нормальной микрофлоры могут вызывать заболевания в случаях проникновения в большом количестве из одних биотопов в другие и при иммунодефицитах (дисбактериозы).
ФАГОЦИТИРУЮЩИЕ КЛЕТКИ ОРГАНИЗМА
Учение о фагоцитарной системе создано еще И. И. Мечниковым (1896). Под фагоцитозом понимают активное поглощение клетками твердого материала. У одноклеточных этот процесс служил в основном для питания. У многих многоклеточных организмов, включая человека, фагоцитоз служит, прежде всего, фундаментальным механизмом противоинфекционной защиты. Фагоциты представляют собой клетки с особо выраженной способностью поглощать микроорганизмы и другие внедрившиеся в организм чужеродные вещества. Морфологически и функционально различают моноцитарные (макрофаги) и гранулоцитарные (микрофаги) компоненты фагоцитарной системы. Макрофаги и микрофаги имеют общее миелоидное происхождение от полипотентной стволовой клетки костного мозга. Для микрофагов характерно большое количество гранул в цитоплазме. По особенностям окрашивания различают базофильные, эозинофильные и нейтрофильные гранулоциты (лейкоциты). Наиболее многочисленны среди лейкоцитов полиморфно-ядерные нейтрофилы. Ежедневно из костного мозга в кровь выходит 10 названных лейкоцитов, а при острых инфекциях это количество может возрастать в 10 - 70 раз, при этом в крови появляются и не зрелые формы (сдвиг формулы крови влево). Активность нейтрофилов тесно связана с гранулами, содержимое которых представлено ферментами и другими биологически активными веществами: бактерицидные ферменты, нейтральные протеиназы, кислотные гидролазы и прочие вещества (лактоферрин, витамин В12-связывающий белок). С помощью этих вышеназванных ферментов и белков микрофаги осуществляют свою фагоцитирующую функцию.
Определенной фагоцитарной активностью обладают и эозинофильные лейкоциты, на клеточных мембранах которых имеются рецепторы для Fc-фрагмента комплемента IqG и белка СЗв-комплемента. Эти клетки фагоцитируют комплексы антиген — IqE — антитело, синтезируют пероксидазу, гистаминазу и другие ферменты, взаимодействуют с тучными клетками. Эозинофилы участвуют в защите организма от аллергенного воздействия в качестве антителозависимых фагоцитов. Велика роль эозинофилов и в локализации паразитарных заболеваний.
Макрофаги различных тканей организма (соединительной, печени, легких и др.) вместе с моноцитами крови и их костномозговыми предшественниками (промоноциты и монобласты) объединены в особую систему мононуклеарных фагоцитов (СМФ). Концентрация моноцитов в крови относительно невелика по сравнению с гранулоцитами (1–6% и 60 – 70% соответственно), однако продолжительность жизни значительно выше. В крови моноциты циркулируют до трех суток, а затем мигрируют в прилегающие ткани, где их количество в десятки раз больше, чем в крови. Здесь происходит окончательное созревание моноцитов либо в мобильные гистиоциты (тканевые макрофаги), либо в высокодифференцированные тканеспецифические макрофаги (альвеолярные макрофаги легких, купферовские клетки печени).
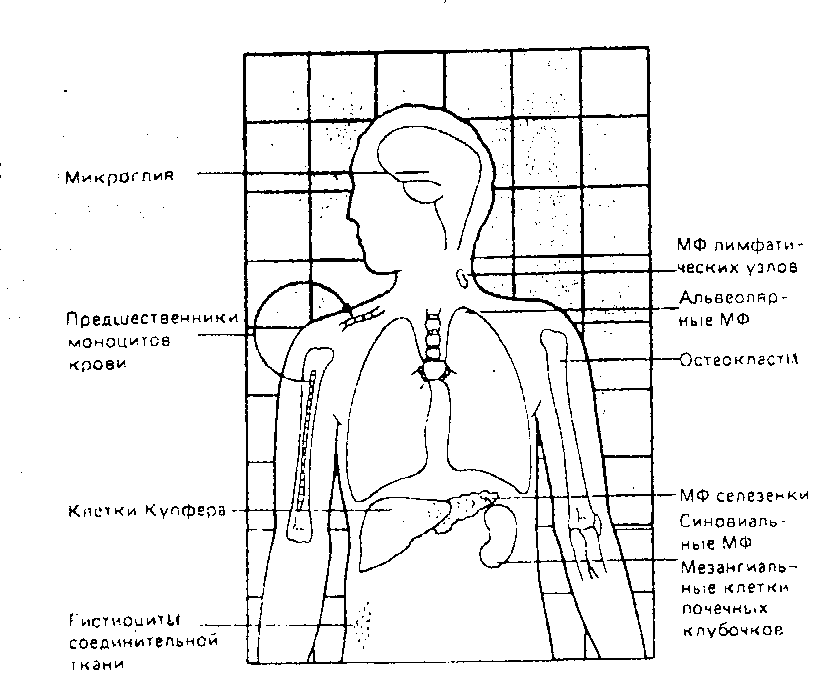
Рис.1. Мононуклеарная фагоцитарная система (первоначально включающая эндотелиальные и полиморфнондерные клетки под названием "ретикуло-эндотелиальная система", или РЭС), Предшественники промоноцитов в костном мозге развиваются в циркулирующие моноциты крови, которые со временем распределяются по всему организму в виде зрелых макрофагов (МФ), как показано на рисунке. Другие основные фагоцитирующие клетки – полиморфноядерные нейтрофилы — главным образом остаются в крови, за исключением случаев их локализации в очагах острого воспаления
Морфологическая гетерогенность клеток соответствует функциональному разнообразию мононуклеарной системы. В отличие от полиморфноядерных нейтрофилов, которые обеспечивают основную защиту от пиогенных (гноеродных) бактерий, функция макрофагов в основном связана борьбой с теми бактериями, вирусами и простейшими, которые способны существовать внутри клеток хозяина. У клеток Лангерганса кожи, дендритных клеток селезенки имеется способность перерабатывать и представлять антиген клеткам иммунной системы. В этот момент он может быть узнан соответствующими Т-лимфоцитами. Макрофаги синтезируют и секретируют во внеклеточную среду большое количество различных белков и ферментов: нейтральные протеазы, кислые гидролазы, эндогенный пироген, факторы комплемента, интерлейкин и др.
Макрофаги способны к передвижению, поглощению объектов фагоцитоза посредством опсонинов и мембранных рецепторов, обезвреживанию его в лизосомах с помощью ферментов.
Все фагоцитирующие клетки характеризуются общностью основных функций, сходством структур и метаболических процессов. Различают четыре последовательно протекающие стадии фагоцитоза:
1. Хемотаксис целенаправленное передвижение фагоцитов в направлении градиента хемоаттрактантов благодаря наличию на мембране фагоцита специфических рецепторов. В качестве хемоаттрактантов могут выступать бактериальные компоненты, продукты некроза тканей организма, активированные фракции системы комплемента — С5а, СЗа, лимфокины.
2. Адгезия — прикрепление фагоцита к мишени, может быть опосредован и не опосредован рецепторами.
3. Эндоцитоз — захватывание, которое может происходить без участия рецепторов, например, при поглощении частичек угля и при участии рецепторов, как в случае поглощения многих бактерий, грибов рода Candida и др. Маннозофруктозные рецепторы фагоцитов узнают при этом углеводные компоненты поверхностных структур микроорганизмов. Наиболее эффективным является фагоцитоз, опосредованный рецепторами для Fc-фрагмента иммуноглобулинов (см. ниже) и для фракции СЗ-комплемента. Эндоцитоз идет по принципу застежки "молния''.
4. Внутриклеточное переваривание происходит в фаголизосомах в результате слияния с первичными лизосомами. Уничтожение микроорганизма происходит в результате "окислительного взрыва" — выброса биологически активных продуктов восстановления кислорода, таких как перекись водорода, супероксидант молекулярного кислорода и гидроксильных радикалов, а также за счет кислороднезависимых механизмов, связанных с высвобождением лизоцима и гидролитических ферментов.
Многие вирулентные бактерии часто не погибают и могут длительное время персистировать внутри фагоцитов. Некоторые (токсоплазмы, микобактерии туберкулеза) могут препятствовать слиянию фагосом с лизосомами; другие (гонококки, стафилококки, стрептококки гр. А) обладают устойчивостью к действию лизосомных ферментов; третьи после эндоцитоза покидают фагосому и избегают действия ферментов (риккетсии). В этих случаях фагоцитоз остается незавершенным.
Макрофаги при поглощении антигена вырабатывают монокины — вещества, оказывающие регулирующее действие на пролиферацию, дифференциацию и функции фагоцитов, лимфоцитов, фибробластов и других клеток, например, интерлейкин-1, который стимулирует Т-лимфоциты и одновременно оказывает пирогенный эффект. Одновременно макрофаги секретируют лизоцим, компоненты комплемента, интерфероны, кислородные радикалы, благодаря которым могут убивать бактерии без фагоцитоза, а также оказывать цитотоксическое действие на раковые и аллотрансплантированные клетки.
Общая функция фагоцитов заключается в представлении на своей наружной мембране фрагментов (антигенных эпитопов) захваченных микроорганизмов. В таком виде возбудители специфически распознаются Т-лимфоцитами.
Натуральные киллеры — большие зернистые лимфоциты, которые специализированы для внеклеточного уничтожения. Объектами их нападения являются опухолевые клетки, а также клетки, зараженные некоторыми вирусами или паразитами. Полагают, что они узнают определенные структуры из ненормальных высокомолекулярных гликопротеинов, экспрессируемых на мембране инфицированной или измененной клетки. Предварительный контакт с антигеном не требуется. Главная роль в уничтожении принадлежит секретируемым белкам – перфорину и цитолизину, которые образуют трансмембранную пору на мембране атакуемой клетки, что приводит к ее лизису. Активность натуральных киллеров стимулируют интерфероны.
ИНТЕРФЕРОНЫ
Интерферон является низкомолекулярным белком, обладающим противовирусными свойствами. Впервые открыт в 1957 г. А. Айзексом и Д. Линденманном, которые обнаружили, что клетки, инфицированные вирусом гриппа, начинают вырабатывать в окружающую среду особый белок, препятствущий размножению в них вирусов. Причем животное, зараженное одним вирусом, устойчиво к заражению другим неродственным вирусом. Интерферон рассматривается как один из важнейших факторов защиты организма от первичной вирусной инфекции, кроме того, он обладает еще рядом биологических свойств: способностью ингибировать клеточную пролиферацию и рост опухолевых клеток, угнетать образование антител. Действие интерферона основано на блокаде трансляции мРНК и активации латентной эндонуклеазы, приводящей к деградации мРНК как вируса, так и хозяина.
Интерфероны подразделяют на три класса: α, β и γ. Интерферон α (лейкоцитарный) обладает выраженной противовирусной активностью, γ-Интерферон — главным образом противоопухолевой.
СИСТЕМА КОМПЛЕМЕНТА
Первые данные о существовании системы, дополняющей иммунологическую реакцию антиген — антитело, были получены в конце XIX в. Бухнером, Ж. Борде и др. Было установлено, что в сыворотке крови всех позвоночных имеется термолабильный фактор, который вызывает лизис мембран паразитов в присутствии специфических антител. Это вещество получило название комплемента (лат. comple — дополнение). В отсутствие комплемента (прогревание при t° 56°) специфические антитела способны вызывать агглютинацию чужеродных клеток, в том числе и бактериальных, однако их гибель не происходит. Добавление же свежей сыворотки, не содержащей антител, но содержащей комплемент, сопровождается лизусом клеток. В последующем были установлены и другие биологические функции комплемента, в частности, активация фагоцитоза, освобождение биологически активных аминов из гранул тучных клеток (гистамин, серотонин, брадикинин), повышение проницаемости клеточных мембран и снижение сосудистого тонуса, положительный хемотаксис, иммунное прилипание (рис. 2).
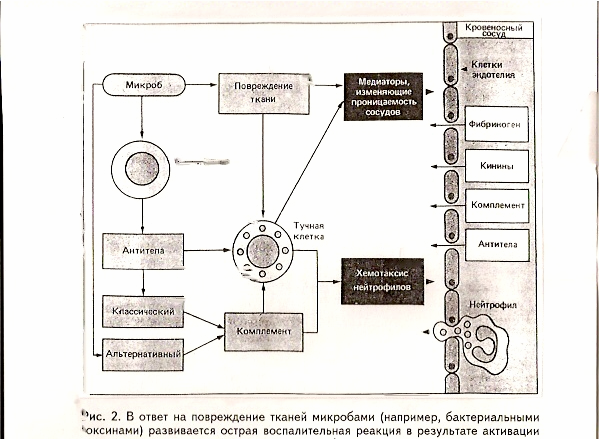
Рис. 2. В ответ на повреждение тканей микробами (например, бактериальными токсинами) развивается острая воспалительная реакция в результате активации комплемента по альтернативному пути либо с помощью антителозависимого запуска классического пути активации комплемента или дегрануляции тучных клеток (для этого существуют специальные антитела).
В настоящее время известно, что комплемент представляет собой систему сывороточных белков, состоящую из 11 компонентов и 3 ингибиторов. Компоненты, входящие в состав системы комплемента, обозначаются буквой С с порядковыми номерами от 1 до 9. Активация системы комплемента может осуществляться иммуноглобулинами класса М и G, которые входят в состав иммунного комплекса или же без участия иммуноглобулинов, но при участии пропердиновой системы (лат. perder — разрушать). Исходя из этого, существует два пути активации системы комплемента. Первый носит название классического, или антителозависимого, а второй – альтернативного, или пропердинового.
ПРОПЕРДИН
Пропердин — белок с молекулярным весом 220 000, обнаруженный в сыворотке крови Пиллемером с сотр. в 1954 — 1956 гг. Свою активность пропердин проявляет только в присутствии в сыворотке крови ионов Мд+2 и компонентов комплемента. Комплекс пропердин-коминт Мд2+ получил название системы пропердина. Система пропердина состоит из самого пропердина и трех дополнительных сывороточных белков (Н, В, Д), которые принимают участие в расщеплении СЗ-компонента комплемента. Особенность альтернативного пути активации комплемента состоит в том, что инициация может происходить без участия комплекса антиген — антитело за счет полисахаридов и липополисахаридов бактериального происхождения. Спонтанное расщепление компонента СЗ при связывании его фрагмента СЗв на бактерии в присутствии пропердинового комплекса приводит к образованию компонента СЗвВв, обладающего высокой СЗ-конвертазной активностью. Последующий каскад превращений терминальных белков С5 – С9 приводит к образованию трубчатообразного мембраноатакующего комплекса (МАК), который нарушает целостность мембраны клетки мишени и приводит к ее лизису. Одновременно низкомолекулярные фрагменты СЗв и С5а. названные анафилатоксинами, стимулируют выброс тучными клетками гистамина, гепарина и других медиаторов, вызывающих расширение капилляров, эксудацию белков плазмы, а также хемотоксическое привлечение полиморфноядерных клеток к СЗв-нагруженной бактерии, что приводит к ее уничтожению.
ФАКТОРЫ И МЕХАНИЗМЫ СПЕЦИФИЧЕСКОЙ ЗАЩИТЫ
Мутации, изменяющие структуру и состав мембран микроорганизмов, позволяют им часто избежать узнавания и ускользнуть от воздействия врожденных механизмов защиты человека. Например, большинство паразитов запускает альтернативный путь активации комплемента и фиксирует СЗв, однако эозинофильные лейкоциты почему-то не выделяют содержимое своих гранул. Многие бактерии вообще не активируют систему комплемента. Как выход из этой ситуации, эволюционно сложилась новая система, способная защитить от каждого конкретного вида микроорганизма, как бы много их ни было. Такой специфический иммунитет обеспечивают специальные иммунокомпетеитиые клетки — Т- и В- лимфоциты, которые участвуют в распознавании чужеродных антигенов, синтезе специфических антител (иммуно-глобулинов) и других формах иммунного ответа.
Самый критический момент в процессе иммунного ответа — это узнавание химического маркера, характерного для "чужого" организма в отличие от "своего". Данную функцию выполняют особые белки, отличающиеся огромным разнообразием аминокислотного состава и, соответственно, пространственной структурой. Если все молекулы какого-то конкретного структурного или функционального белка одного организма одинаковы во всех клетках, то узнающие белки иммунной системы, наоборот, существуют в миллионах или, возможно, в миллиардах различных форм. "Индивидуальность" каждой такой молекулы позволяет ей узнать специфическую мишень. Узнающие белки — это антитела (иммуноглобулины) и рецепторы Т-клеток, которые мы рассмотрим позже, а узнаваемая мишень — антигены.
АНТИГЕНЫ
Антигенами (anti — против, genos - род) называют вещества любого происхождения, в том числе микробного, которые распознаются клетками иммунной системы организма реципиента как генетически чужеродные и которые вызывают специфические гуморальные или клеточные иммунологические реакции. Под гуморальными и клеточными иммунологическими реакциями подразумевается продукция специфических иммуноглобулинов (антител) и образование специфических Т-клеток эффекторов (исполнителей).
В природе существует огромное количество самых разнообразных антигенов: возбудители инфекционных заболеваний и их токсины, поверхностные структуры эритроцитов (групповые эритроцитарные антигены), использующиеся и сегодня при решении вопроса о возможности переливания крови, поверхностные структуры лейкоцитов и других клеток организма (трансплантационные антигены), или HLA (лейкоцитарные) антигены, обусловливающие индукцию иммунного ответа и отторжение пересаженного органа или тканей.
Антигены подразделяются на полные (полноценные) и неполные (неполноценные). Последние чаще называются гаптенами (нем. Habten — присоединять). Эти вещества не имеют белков и синтез антител не индуцируют, однако обладают способностью с ними реагировать.
К полным антигенам относят протеины, полисахариды, липополисахариды, нуклеопротеиды, т. е. биополимеры, имеющие достаточно жесткую структуру и высокую молекулярную массу. Полисахариды могут обладать антигенностью только в том случае, когда их молекулярный вес не менее 600 OOU.
Гаптены, или неполные антигены, подразделяются на простые и сложные. Простые гаптены — это низкомолекулярные соединения или простые химические вещества, такие как никель, хром, бериллий, ди-нитрофенол, анилин, эфирные масла. Сложными гаптенами могут быть липиды, нуклеиновые кислоты, олигопептиды, стероиды и другие молекулы относительно сложного строения. Гаптены, попадая в организм, соединяются с отдельными компонентами данного индивидуума и тогда они приобретают свойства полноценных антигенов и могут индуцировать иммунологический ответ. Образующиеся в последующем гуморальные и клеточные факторы иммунитета, взаимодействуя с гаптеном, обусловливают аутоиммунные заболевания или клеточный тип гиперчувствительности (накопление большого количества лимфоцитов).
Основными свойствами, характеризующими вещество как антиген, являются: чужеродность, антигенность, иммуногенность, специфичность.
Чужеродность — это индивидуальное свойство антигена для каждого вида организма или для отдельных индивидуумов, передающееся по наследству. Для обозначения этого свойства известный иммунолог Ф. Бернет ввел понятие "не свое", т.е. при поступлении антигена в организм он распознается последним как чужеродный и способен вызывать иммунный ответ.
Антигенность — это мера способности антигена вызывать те или иные иммунологические реакции: большая или меньшая величина синтеза антител, большая или меньшая величина реакций клеточного иммунитета. Одно и то же вещество, не являясь антигеном для представителей одного вида, может вызывать специфический иммунный ответ у особей другого вида.
Понятие "антигенность" часто сопоставляют с иммуногенностью. Однако иммуногенность следует рассматривать как одно из проявлений антигенности, так как в иммуногенность включается и иммунологи-ческая память, т. е. способность к усиленному и ускоренному иммунному ответу при повторном внедрении антигена. Значит иммуногенность — это способность антигена создавать в организме иммунитет. Это понятие относится, главным образом, к микробным и вирусным антигенам, обеспечивающим состояние невосприимчивости к инфекционным возбудителям. Например, возбудитель дизентерии обладает высокой антигенностью, но выраженного иммунитета против него не вырабатывается, т. е. не формируется иммунологическая память, тогда как брюшно-тифозная бактерия обладает и высокоантигенным и высокоиммуногенным свойством. После перенесенного заболевания вырабатывается большое количество антител и формируется иммунологическая память, обусловливающая невосприимчивость или защиту к этой инфекции в течение всей жизни.
Специфичность — это те антигенные особенности, благодаря которым антигены отличаются друг от друга.
Различают следующие виды антигеиной специфичности: видовая [типо- или изо-специфичность), групповая (аллоспецифичность), ткане- и идиоспецифичность (тканевая, органоидная, стадийная). Видовая специфичность зависит от видовой принадлежности животного, его генетической конституции, т. е. это специфичность, благодаря которой представители одного вида организмов отличаются от особей другого вида. Такой видоспецифичностью обладают не какие-то специальные антигены, а, видимо, большинство веществ, содержащихся в организме. Близкие виды имеют достаточно сходные видоспецифические антигены, далекие — сильно различающиеся. Типоспецифичность — понятие, аналогичное видоспецифичности, но применяемое по отношению к микробным видам.
Групповая антигенная специфичность может существовать в пределах одного вида между различными группами особей. Примером групповой специфичности могут служить изоантигены человека: системы антигенов эритроцитов, их более 15, и включают они около 100 антигенов, в том числе и групповые антигены А, В, О, открытые К. Ландштейнером. По наличию групповых антигенов на эритроцитах человека люди имеют определенные группы крови, всего четыре: О (I) — отсутствие групповых антигенов на эритроцитах человека; А (II) — присутствует на эритроцитах антиген А; В (III) – присутствует на эритроцитах антиген В и АВ (IV) — присутствуют на эритроцитах А- и В-антигены.
В плазматических мембранах клеток разных тканей содержатся антигены главного комплекса гистосовместимости, или МНС (англ. major histocompatiblity complex), которые играют важнейшую роль в иммунном ответе, иммунорегуляции, реакции отторжения трансплантанта и других процессов. У человека комплекс МНС обозначают еще как HLA. По химической структуре и функциональному назначению МНС делят на два класса. МНС класса 1 находятся на мембране всех ядросодержащих клеток и являются маркерами "своего", т. е. принадлежности к конкретному организму. Они играют роль трансплантационных антигенов, уникальных у каждого человека, что является причиной отторжения трансплантанта. В случае заражения клеток вирусами МНС-антигены класса 1 в комплексе с вирусными антигенами становятся “ориентирами” для избирательного уничтожения зараженных клеток клетками-киллерами. МНС-антигены, принадлежащие к классу 2, также состоят из двух микроглобулярных цепей, близких по молекулярной массе, и находятся на плазматической мембране макрофагов, Т-и В-лимфоцитов. Эти антигены служат для распознавания антигенных эпитопов, поглощенных возбудителей Т-хелперами, что необходимо для развития специфического иммунного ответа.
Идиоспецифичность — это антигенные различия внутри конкретного индивидуума, ткани клетки.
Стадиоспецифичность (как разновидность идиоспецифичности) обусловлена антигенными различиями между клетками, находящимися на разных стадиях дифференцировки.
Существует также органоидная специфичность антигенов — понятие, отражающее антигенные различия между отдельными клеточными органоидами (ядрами, митохондриями, микросомами).
Таким образом, всякая живая клетка по своей антигенной структуре отличается от любой другой живой клетки, не принадлежащей данному организму. Чем меньше степень генетического родства, тем больше антигенные различия. Однако существуют так называемые гетерогенные антигены, или перекрестие реагирующие антигены, сходные по своей специфичности для различных видов организмов. Примером такого антигена является антиген форссмана, открытый им в 1911 г. Этот антиген — общий для тканей морской свинки и эритроцитов барана. Явление антигенного сходства, или мимикрии, может быть между организмом человека и микробами или паразитами. Для паразитов такое свойство имеет защитное значение, так как они не могут распознаваться иммунной системой хозяина и не вызывать у него специфической защитной реакции. Для хозяина такие антигены могут быть возможной причиной аутоиммунного заболевания. Так, перекрестие реагирующие антигены стрептококка играют заметную роль в развитии коллагенезов. Иммунизируя животное препаратами стрептококка группы А, можно получить антитела, реагирующие с тканевыми элементами миокарда, с гликопротеинами синовиальной жидкости и хряща. В мембранах некоторых штампов стрептококка содержатся перекрестно реагирующие антигены, близкие или идентичные структурам базальных мембран клубочков почки. Такие штампы стрептококка могут вызвать аутомммунный гломерулонефрит.
Своеобразной разновидностью антигенов являются так называемые промежуточные, или комплексные антигены. Они возникают при интеграции вирусного генома (генетический аппарат клетки) и генома клетки-мишени с последующей экспрессией вирусоиндуцированного антигена на клеточной мембране. Такой комплексный антиген может вызывать иммунологическую реакцию против клеток, пораженных вирусом. Возникающие в таких случаях иммунопатологические (аутоиммунные) процессы носят название интеграционных болезней. Иногда, однако, наблюдается и обратное явление: видовые антигены и изоантигены хозяина включаются в оболочку вибриона, что защищает его в какой-то мере от элиминации иммунной системой.
