
- •2. Общие принципы эффективного использования материальных и энергетических ресурсов
- •2.1. Масштабы потребления природных ресурсов
- •Средний химический состав земной коры
- •2.2. Сырьевые источники для химических производств и их классификация
- •2.2.1. Сырьевая база Республики Беларусь
- •2.2.2. Обогащение твердого и концентрирование жидкого и газообразного сырья
- •2.2.3. Пути эффективного использования материальных ресурсов
- •2.3. Энергетические ресурсы и их классификация
- •2.3.1. Повышение энергетической эффективности химического производства
- •2.3.2. Энерготехнологические схемы
- •2.4. Оценка эффективности химического производства на основе материального и энергетического балансов
- •2.4.1. Материальный баланс
- •Материальный баланс процесса получения фосфора из апатитовой руды
- •2.4.2. Примеры расчета материальных балансов химико-технологических процессов и контрольные задания
- •Часовой материальный баланс окисления аммиака
- •Материальный баланс производства сн3он
- •Материальный баланс производства сульфида натрия
- •Материальный баланс процесса кристаллизации СuSо4 5н2о
- •Материальный баланс процесса получения негашеной извести
- •2.4.3. Энергетический баланс химико-технологических процессов
2.4. Оценка эффективности химического производства на основе материального и энергетического балансов
Степень использования материальных и энергетических ресурсов при получении целевых продуктов устанавливается на основании материальных и энергетических балансов.
2.4.1. Материальный баланс
Материальный балансоснован на законе сохранения массы вещества, согласно которому масса веществ, поступивших в замкнутую систему, равна массе веществ на выходе из нее. Применительно к материальному балансу любого технологического процесса это означает, что масса веществ, поступивших на технологическую операцию, –приход– равна массе всех веществ, получившихся в результате ее, –расходу.
Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку (Σmприх), а правую – масса получаемых продуктов плюс производственные потери (Σmрасх):
Σmприх = Σmрасх. (24)
Уравнение материального балансаможет быть представлено в следующем виде:
m![]() +m
+m![]() +m
+m![]() +m
+m![]() =m
=m![]() +m
+m![]() +m
+m![]() +m
+m![]() (25)
(25)
где m![]() m
m![]() m
m![]() m2 массы поступившего газообразного,
жидкого и твердого сырья и вспомогательного
материала;m3,m4соответственно полученные целевой и
побочный продукты;m5непрореагировавшее сырье;m6
–производственные потери.
m2 массы поступившего газообразного,
жидкого и твердого сырья и вспомогательного
материала;m3,m4соответственно полученные целевой и
побочный продукты;m5непрореагировавшее сырье;m6
–производственные потери.
Слагаемые прихода и расхода, число которых зависит от состава производственных потоков, называют статьями материального баланса.
Материальный баланс – «зеркало» химико-технологического процесса, отражающее состав образующихся продуктов, природу исходных реагентов и вспомогательных материалов. На основании материального баланса можно рассчитать такие технологические показатели, как расходные коэффициенты сырья, вспомогательных материалов, выход целевых продуктов, побочных продуктов или отходов, степень использования сырья, селективность процесса.
Технологические показатели, получаемые на основе практического материального баланса, называют балансовыми характеристиками 8.
Расходные коэффициенты сырья (Рк1) и вспомогательных материалов (Рк2) вычисляются исходя из уравнения (25) следующим образом:
Рк1=![]()
Рк2=![]()
Выход целевого продукта (1) и побочного продукта (2) будет составлять
1=![]()
2=![]()
Степень превращениясырьяхравна
х=![]()
Селективность
процесса вычисляют
в тех случаях, когда в системе протекает
несколько реакций, одна из которых
целевая, а остальныепобочные.
В этом случае по величине расхода сырья
(m1 m5)
и по стехиометрическому уравнению
целевой реакции рассчитывают
стехиометрическое количество целевого
продуктаm![]() ,
после чего находят
,
после чего находят
=
![]()
Кроме определения технологических показателей, материальный баланс позволяет установить, на каких этапах процесса следует искать другие решения, которые обеспечили бы большую эффективность использования сырья. Для этого, кроме баланса всего процесса, составляют балансы отдельных его этапов, единичных элементов или частичные балансы по компонентам.
Стехиометрический материальный баланс. Теоретический (стехиометрический) материальный баланс рассчитывают на основе стехиометрических коэффициентов в уравнениях реакции, предусматривающих полное превращение реагентов в продукты. Часто стехиометрический баланс составляется для реакции, выражающей полный ход процесса и являющейся суммой промежуточных этапов, т. е. для такой реакции, которой в действительности не существует. Удобнее всего составлять материальный баланс по отношению к 1 молю или 1 кмолю основного исходного вещества [7]. После этого по числу моль или кмоль находят объемы и массы исходных веществ и продуктов (кг, т, м3, л).
Стехиометрические коэффициенты в химических уравнениях показывают количество моль компонентов, вступивших в химическое взаимодействие. Их можно выразить в массовых величинах, умножая стехиометрические коэффициенты на молярную массу. Например, окисление диоксида серы описывается уравнением
SO2+ 0,5O2SO3
Молярные массы составляют, г/моль или кг/кмоль: SO2– 64;O2– 32; SO3– 80, и это же уравнение с «массовыми» стехиометрическими коэффициентами будет иметь следующий вид:
64SO2+ 16O280SO3
В такой записи очевиден материальный баланс: суммарная масса исходных веществ равна массе продукта.
Пример 1.В производстве азотной кислоты определить количествоHNO3, образующейся из 1 т аммиака.
Порядок расчета
В химико-технологическом процессе протекают следующие реакции:
окисление аммиака
4NH3+ 5O2= 4NO+ 6H2О (26)
(принимаем, что NH3полностью окисляется доNO);
окисление оксида азота
2NO+O2= 2NO2(27)
хемосорбция диоксида азота
3NO2+ Н2О = 2HNO3+NO(28)
В абсорбционную колонну подается кислород, и образующийся оксид азота повторно окисляется до NO2по реакции (27).
Таким образом, образование азотной кислоты представлено стехиометрическими уравнениями (26)(28). Умножим первое из них на 1, второе – на 3, третье – на 2 и сложим их. Получим суммарное стехиометрическое уравнение (брутто-уравнение)
NH3+ 2O2=HNO3+H2О (29)
Конечно, такая реакция не известна. Но стехиометрическое уравнение показывает, в каких соотношениях реагенты вступают во взаимодействие друг с другом, согласно уравнению (29). Умножим стехиометрические коэффициенты в уравнении (29) на мольные массы соответствующих компонентов, г/моль или кг/кмоль: NH3 – 17;O2 – 32;HNO3 – 63; Н2О – 18 и получим
17NH3+ 64O2= 63HNO3+ 18H2О (30)
Из уравнения (30) видно, что для производства 63 кг азотной кислоты надо затратить 17 кг аммиака, а на 1 т (1000 кг) азотной кислоты расходуется 17 1000 / 63 = 270 кгNH3.
Удобство записи суммарного стехиометрического уравнения очевидно.
Пример 2. Сожжено 100 м3 газовой смеси, содержащей 50 об. % пропана и 50 об. % бутана. Избыток воздуха по отношению к теоретически необходимому для сгорания составляет 20%. Составить материальный баланс процесса горения и рассчитать состав продуктов сгорания (об. %).
Порядок расчета
При расчете принимаем, что воздух является смесью одного объема кислорода и 3,76 объема азота, т. е. молярное отношение О2:N2составляет 1 : 3,76. Объем 1 кмоля О2,N2при н. у. равен 22,4 м3.
Уравнения реакций горения имеют следующий вид:
С3Н8+ 5О2= 3СО2+ 4Н2О
С4Н10+ 6,5О2= 4СО2+ 5Н2О
Исходя из состава воздуха и с учетом его избытка при сжигании газовой смеси, запишем общее уравнение реакции, принимая во внимание, что молярное соотношение пропана и бутана в смеси такое же, как объемное соотношение (т. е. 1 : 1):
воздух для воздух для избыток воздуха
сжигания пропана сжигания бутана



С3Н8+ 5О2+ 18,8N2+ С4Н10+ 6,5О2+24,4N2+ 0,2(11,5О2+ 43,2N2) =
= 7CО2+ 9Н2О + 43,2N2+ 2,3О2+ 8,7N2
Данное уравнение можно записать в следующем виде:
С3Н8+ С4Н10 + 13,8О2+ 51,9N2= 7CО2+ 9Н2О + 2,3О2+ 51,9N2
Результаты материального баланса приведены в табл. 2.
Стехиометрические балансы могут быть представлены в виде уравнений, согласно которым можно рассчитать степень превращения реагентов и их концентрацию в данный момент времени (табл. 3). Так, например, общий вид уравнения реакции
а А +b В + … + i I + j J + k K… = r R + s S, (31)
где стехиометрический коэффициент; абсолютное значение стехиометрического коэффициента (для исходных веществ< 0, для продуктов > 0) [7].
Обозначим количество исходных веществ (моль) перед началом реакции через na 0,nb 0, …,ni 0, …, а количество исходных веществ в данный момент реакции –na,nb, …,ni, … . Когда исходные реагенты берутся в стехиометрическом соотношении, степени превращения каждого из них одинаковы. Если же исходные реагенты вступают в реакции не в стехиометрическом соотношении, то значение степени превращенияхзависит от того, для какого вещества эта величина рассчитывается. Следовательно, так как соотношения количеств исходных реагентов могут быть нестехиометрическими, расчет будем вести по степени превращения одного произвольно выбранного исходного реагента, напримерK:
хk=![]() .
.
В соответствии со стехиометрическим уравнением (31), когда превращению подвергается 1 моль исходного вещества K, одновременно превращение претерпевает число молей исходного веществаI, равное
ni 0ni =![]() nk 0хk.
nk 0хk.
Табл. 2, 3
Мгновенное значение концентрации исходного вещества J(мольной долиNj) равно отношению числа молейJ, содержащихся в данный момент в системе, реагирующей согласно уравнению (31), к числу всех молей, находящихся в данный момент в системе (сумма в четвертой графе табл. 3):
Nj=
 .
(32)
.
(32)
В числителе и знаменателе выражения (32) написан знак «+», так как вместо i использованоi (для исходных веществi < 0).
Разделив
числитель и знаменатель правой части
уравнения (32) на сумму чисел молей
введенных исходных веществ
![]() (сумма
во втором столбце табл. 3) и приняв во
внимание, что
(сумма
во втором столбце табл. 3) и приняв во
внимание, что
Nj
0=
![]() илиNk
0=
илиNk
0=
![]() ,
,
получим зависимость молярной доли Njисходного веществаJот молярных долей компонентов исходной смеси:
Nj=
 .
(33)
.
(33)
Когда известен состав исходной смеси, можно с помощью выведенного уравнения быстро рассчитать концентрацию каждого исходного вещества, которая соответствует данной, отнесенной к одному из реагентов (K) степени превращенияхk [7].
Мольная доля Njравна объемной доле, если в реакции участвуют газы, свойства которых близки к свойствам идеального газа, следовательно, в этом случае уравнение (33) можно использовать и для расчета объема реагирующих газов.
Если известен состав смеси вводимых в реакцию исходных веществ и аналитически определена мольная доля одного из компонентов в некоторый момент времени, можно рассчитать для этого момента значение степени превращения, отнесенное к указанному компоненту. После преобразования уравнения (33) степень превращения хkбудет равна
хk=
 .
(34)
.
(34)
В случае одновременного протекания двух параллельных реакций, например
![]()

![]()
аналогично уравнению (33) получается
 .
(35)
.
(35)
Пример 3. В реакторе для окисления аммиака на катализаторе из платиновой сетки используется воздух, обогащенный кислородом.
Газовая смесь, поступающая на окисление, содержит, об. %: NH3 – 11,30; O2 – 23,14; N2 – 63; Н2О – 2,56. Реакция протекает в двух направлениях:
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
Степени
превращения аммиака:
![]()
Рассчитать концентрацию кислорода в газах после реакции, приняв, что реагенты ведут себя как идеальный газ.
Порядок расчета
Используем уравнение (35). Исходным веществом K, для которого определяется степень превращения, будем считать аммиак. В качестве реагента J примем кислород. В соответствии со стехиометрическими уравнениями и условиями задания получаем:
 ;
;

![]() =
4
5 + 4 + 6 = 1;
=
4
5 + 4 + 6 = 1;
![]() =
4
3 + 2 + 6 = 1.
=
4
3 + 2 + 6 = 1.
Подставив эти значения в уравнение, имеем
N
Газы после реакции будут содержать 8,94 об. % кислорода. Использование уравнения (35) дало возможность решить задачу значительно быстрее, чем при составлении полного стехиометрического баланса.
Пример 4. В установке для производства серной кислоты контактным способом происходит реакция окисления
2SO2 + O2 2SO3
Газ, подводимый к контактному реактору окисления оксида серы (IV), имеет состав, об. %: SO2 – 10; O2 – 11; N2 – 79. Газ, покидающий реактор, содержит 6,8 об. % О2. Рассчитать степень превращения оксида серы (IV) и концентрации SO3, SO2 и N2 в газах после реакции.
Порядок расчета
Для вычисления значения степени превращения оксида серы (IV) используем уравнение (34).
Исходным веществом K будем считать SO2, за исходное вещество J примем О2. Имеем
![]()
![]()

Для
расчета концентраций SO3,
SO2
и N2
в газе после реакции используем уравнение
(33), помня, что
![]() :
:

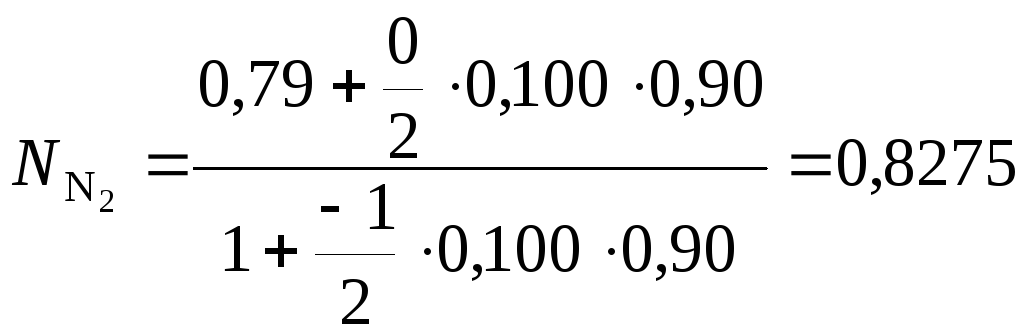
(второе
слагаемое в числителе равно нулю,
поскольку
![]() );
);
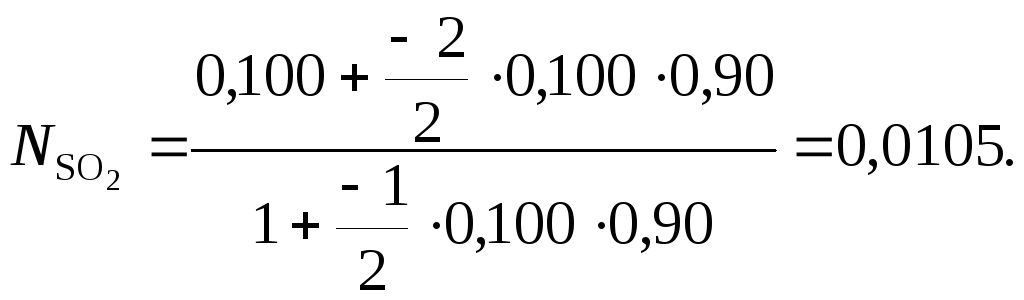
Степень
превращения оксида серы (IV)
![]() =
0,90. Концентрации SO3,
SO2
и N2
в газах после реакции, об. %: SO3
– 9,4; SO2
– 1,05; N2 –
82,75.
=
0,90. Концентрации SO3,
SO2
и N2
в газах после реакции, об. %: SO3
– 9,4; SO2
– 1,05; N2 –
82,75.
Пример 5.
Известны следующие значения константы равновесия Кр:
|
Т, С |
50 |
100 |
150 |
|
Кр |
17,29 |
0,9042 |
0,0948 |
реакции получения хлористого изопропила из стехиометрической смеси пропилена и хлористого водорода по уравнению
СН3СН=СН2 + HCl СН3СНClСН3
Общее давление Р = 1 атм.
Рассчитать
степень превращения пропилена ![]() =
x.
=
x.
Порядок расчета
Принимаем, что в реакцию вступают 1 моль пропилена и 1 моль хлористого водорода. После установления равновесия будет (1 – x) моль пропилена, (1 – x) моль хлористого водорода и x моль хлористого изопропила. Всего 2 – 2x + x = 2 – x моль.
Парциальные давления реагентов составят
![]()
Константа равновесия равна

при Р = 1 атм константа равновесия имеет вид
![]()
Решив это уравнение, имеем
![]()
(перед квадратным корнем знак «», так как x < 1). Рассчитываем значения x:
|
Т, С |
Кр |
Кр + 1 |
|
x |
Степень превращения, % |
|
50 |
17,29 |
18,29 |
4,275 |
0,766 |
76,6 |
|
100 |
0,9042 |
1,9042 |
1,380 |
0,275 |
27,5 |
|
150 |
0,0948 |
1,0948 |
1,046 |
0,045 |
4,5 |
Практический материальный баланс. Практический материальный баланс учитывает состав исходного сырья и готовой продукции, избыток одного из реагентов, степень превращения, потери сырья и целевого продукта и т. д.; т. е. составляя такой баланс, необходимо учитывать все отклонения от теоретически возможного выхода, возникающие по следующимпричинам:
термодинамическим – состояние равновесия обратимых реакций не позволяет проводить основные превращения до конца;
кинетическим – не достигается теоретическая степень превращения вследствие низких скоростей реакций, диффузионных торможений;
обусловленным механизмом процесса – например, побочные реакции уменьшают выход основного продукта и т. д.
Чем подробнее изучен процесс, тем более полно можно составить материальный баланс. Составляют его по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Поскольку на практике приходится иметь дело не с чистыми веществами, а с сырьем сложного химического состава, то для составления материального баланса следует учитывать массу всех компонентов, входящих в его состав. Для этого пользуются данными химических анализов.
За основу материального баланса обычно принимается единица массы продукта (например, тонна) или масса продукта, получаемая в единицу времени (например, баланс составляется в расчете на час, сутки, год). Как правило, все материальные расчеты сводятся в таблицу, примером которой может являться табл. 4 7.
Очень удобной формой представления баланса (особенно в сложных случаях, когда в производственной цепочке существуют обводные включения) являются диаграммы потоков (диаграммы Санкея) [7]. Пример такой диаграммы, построенной для упрощенного материального баланса процесса получения фосфора из апатитовой руды в электрической печи, приведен на рис. 11. Материальный баланс составлен на 1 т продукта и представлен в табл. 4.
Ширина потоков на диаграмме Санкея пропорциональна массам материалов (или теплотам в случае теплового баланса), участвующих в процессе.
Таблица 4
