
Reshenie-zadach-po-FHMA
.pdf
С 100,0 0,001931 0,03862 (М). 5,0
Концентрация в аликвоте раствора (5,0 мл) и в мерной колбе (250,0 мл) одинаковая. Рассчитаем концентрацию в аликвоте 10,0 мл исследуемого раствора
С 250,0 0,03862 0,9655(М). 10,0
Концентрация магния в аликвоте (10,0 мл) и в исходном растворе (1,0 л) одинаковая. Найдем массовую концентрацию магния в исходном растворе
ρ С М 0,9655 24,305 23,67(г/л)
Найдем массу магния в 1 л раствора m ρ V 23,67 1 23,67(г)
Найдем массовую долю магния
m(Mg2 ) 100% 23,67 100% 67,58(%).
mнавески 35,0269
7. РЕФРАКТОМЕТРИЯ
Пример 22 поможет Вам при решении задач № 181 – 183.
Определить нормальную концентрацию муравьиной кислоты, если показатель преломления 12,21 % -го раствора ее равен 1,3405, а показатель преломления исследуемого раствора равен 1,3375, с учетом того, что между концентрацией и показателем преломления в этом интервале существует прямолинейная зависимость. (nH2O 1.3330).
Решение: Так как зависимость между показателем преломления и концентрацией прямолинейна, в данном можно использовать для расчетов рефрактометрический фактор.
Расчитаем рефрактометрический фактор, приняв в качестве n0 показатель преломления воды
F 1,3405 1,3330 0,000614 12,21
Рассчитываем процентную концентрацию муравьиной кислоты.
31

x |
(nx no) |
|
(1,3375 1,3330) |
7,33% |
|
|
|
||||
|
F |
0,000614 |
|
||
Находим |
по справочнику плотность 7,33 %-го раствора |
||||
муравьиной кислоты ρ =1,1776 г/мл. Рассчитываем массу 1 л раствора
m = ρ • V = 1,1776 • 1000 = 1177,6 г.
В одном литре раствора содержится муравьиной кислоты
m = m = 7,33 1177,6 = 86,3 г. 100 100
Рассчитываем нормальную концентрацию муравьиной кислоты
С = m / M = 86,3 / 46,0257 = 1,875 моль/л.
Пример 23 поможет Вам при решении задач № 184 – 186 и № 194 – 195.
Для определения состава раствора этилового спирта в воде были определены показатели преломления стандартных растворов (табл.8)
Таблица 8
С, г/100 мл |
5 |
10 |
15 |
20 |
25 |
nD20 |
1.3362 |
1.3396 |
1.3433 |
1.3470 |
1.3504 |
Показатель преломления исследуемого раствора составил 1,3450. Рассчитать молярную концентрацию этилового спирта.
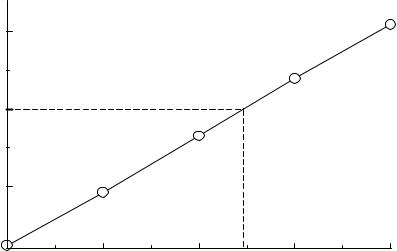
Решение. Строим градуировочный график в координатах: показатель преломления (n) – концентрация спирта в растворе
(рис.16).
32
n |
|
|
|
|
1,35 |
|
|
|
|
1,345 |
|
|
|
|
1,34 |
|
|
|
|
5 |
10 |
15 |
20 |
25 |
|
|
|
|
С, г/100мл |
Рис.16. Зависимость показателя преломления этилового спирта от |
||||
|
|
концентрации. |
|
|
По графику находим Сx = 17 г/100 мл или 170 г/л. Рассчитываем молярную концентрацию этилового спирта.
С = 170/94,0654 = 1,807 М
Пример 24 поможет Вам при решении задачи № 187.
Найти концентрацию (масс.%) нитроэтана в смеси с нитробензолом если удельная рефракция смеси 0,255 см3/г , плотности
ρ(C2H5NO2) = 1,038 и ρ(C6H5NO2) = 1,1930 г/см3; а показатели преломления n(C2H5NO2) = 1,3902 и n(C6H5NO2) =1,5526.
Решение. Для решения задачи воспользуемся правилом аддитивности рефракций.
rсмеси = r1•ω1 + r2•ω2
где: r1 и r2 – удельные рефракции нитроэтана и нитробензола; ω1 и ω2 – массовые доли нитроэтана и нитробензола. Поскольку
ω1 + ω2 = 1,
то
rсмеси = r1•ω1 + r2(1 – ω1). |
(1) |
33

Удельную рефракцию каждого компонента смеси рассчитаем по формуле
r n2 1 1 . n2 2 ρ
r |
|
1,39022 |
1 |
|
|
1 |
|
0,2285, |
|
|
|
1,038 |
|
||||||
C2H5NO2 |
1,39022 2 |
|
|
|
|||||
r |
|
1,55262 |
1 |
|
|
1 |
|
0,2680. |
|
|
|
1,193 |
|
||||||
C6H5NO2 |
1,55262 2 |
|
|
|
|||||
Подставим величины удельных рефракций в формулу(1)
0,255 = 0,2285 • ω1 + 0,2680•(1 – ω1)
и рассчитываем массовую долю компонентов
ω1 = 0,329. ω2 = 1 – ω1 = 0,671.
Рассчитываем процентную концентрацию компонентов как ω • 100. Процентное содержание нитроэтана составляет 32,9 %, а нитробензола 67,1 %.
Задача № 188 решается по тем же формулам, но в ней поставлена обратная задача, по составу раствора рассчитать удельную рефракцию.
Пример 25 поможет Вам при решении задачи № 189-193.
В табл.9 приведены показатели преломления растворов NaNO3 при различных концентрациях.
|
|
|
|
|
Таблица 9 |
С,г/100 мл |
2 |
4 |
6 |
8 |
10 |
n |
1,3354 |
1,3376 |
1,3397 |
1,3418 |
1,3439 |
Рассчитайте рефрактометрические факторы, усредните и определите концентрацию вещества (моль/л) в растворе, если его показатель преломления равен 1,3385.
Решение. Рассчитаем рефрактометрические факторы, приняв в качестве n0 показатель преломления воды,равный 1,3330
F1 1,3354 1,3330 0,0012; 2
F2 1,3376 1,3330 0,00115; 4
34

F3 1,3397 1,3330 0,00112; 6
F4 1,3418 1,3330 0,0011; 8
F5 1,3439 1,3330 0,00109. 10
Рассчитаем среднее значение рефрактометрического фактора
Fср 0,0012 0,00115 0,0112 0,0011 0,00109 0,00113.
5
Рассчитаем концентрацию вещества в растворе
C 1,3385 1,3330 4.87г/100мл. 0.00113
Рассчитываем молярную концентрацию NaNO3
C = |
С 10 |
= |
4,87 10 |
= 0.573 моль/л. |
|
MNaNO3 |
84,9947 |
|
|
8. МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ
8.1. Ионный обмен
Пример 26 поможет Вам при решении задач 196, 200–202. Для определения примесей в загрязненной соли KCl навеску
1,3551 г растворили в 200 мл дистиллированной воды. Для анализа отобрали аликвоту 10 мл и пропустили через колонку с анионитом в ОН-форме. Элюат оттитровали 0,1000 н раствором HCl. Определить массовую долю примесей в соли, если на титрование израсходовано
8,3 мл HCl.
Решение. При пропускании хлорида калия через слой анионообменника ROH на границе фаз протекает ионообменная реакция
KCl + ROH ↔ KOH + RCl,
в результате которой образуется щелочь КОН, количество которой эквивалентно количеству исходной соли:
n(KOH) = n(KCl) или С(KOH)∙ V(KOH) = C(KCl) ∙ V(KCl).
35
По результатам титрования можно найти n(KOH) в элюате: в соответствии с законом эквивалентов n(KOH) = n(HCl) = C(HCl) ∙
V(HCl). Таким образом, C(KCl) ∙ V(KCl) = C(HCl) ∙ V(HCl), C(KCl) = (C(HCl) ∙ V(HCl)) / V(KCl),
C(KCl) = (0,1000 ∙ 8,3) / 10 = 0,083 (моль-экв/л).
Масса KCl в исследуемом растворе: m(KCl) = С(KCl) ∙ Vр-ра ∙ M(KCl)∙ fэквKCl. Т.к. fэквKCl = 1, M(KCl) = 74,5513 г/моль, то: m(KCl) = 0,083 ∙ 0,2 ∙ 74,5513 ∙ 1 = 1,2376 (г).
Соответственно, масса примесей в исходной навеске: mпр = mнав – m(KCl) = 1,3551 – 1,2376 = 0,1175 (г).
Рассчитаем массовую долю примесей в соли:
ωпр = (mпр / mнав) ∙ 100% = (0,1175 / 1,3551) ∙ 100% = 8,67%. Ответ: ωпр = 8,67%.
Пример 27 поможет Вам при решении задач 197–202.
К навеске набухшего катионита в Н+–форме (2,5 г в пересчете на сухой ионит), обменная емкость которого составляет 3,6 ммоль-экв/г, прилили 100 мл 0,06 М раствора CuSO4. Определить концентрацию ионов Cu2+ в растворе после установления равновесия.
Решение. Рассчитаем количество моль-эквивалентов ионов Cu2+
в исходном растворе:
n(1/2 Cu2+) = С(1/2 Cu2+) ∙ Vр-ра.
n(1/2 Cu2+) = 2 ∙ 0,06 ∙ 0,1 = 0,012 (моль-экв) (или 12 ммоль-экв).
Т.к. из определения обменной емкости ионита следует, что 1 г сухого ионита обменивает 3,6 ммоль-экв ионов, соответственно 2,5 г ионита обменивают 2,5 ∙ 3,6 = 9 ммоль-экв ионов.
После установления равновесия в растворе останется: nост = 12 – 9 = 3 (ммоль-экв) ионов Cu2+.
Соответственно, концентрация ионов Cu2+ составит:
С(1/2 Cu2+) = nост / Vр-ра
С(1/2 Cu2+) = 3∙10-3 / 0,1 = 3∙10-2 (моль-экв/л), С(Cu2+) = 1/2 ∙ 3∙10-2 = 0,015 (моль/л).
Ответ: С(Cu2+) = 0,015 моль/л.
Пример28 поможет Вам при решении задачи 203.
Через колонку, содержащую 4г катионита в Н+–форме, пропустили 150 мл 0,05М FeCl3. Выходящий из колонки элюат собирали порциями по 25мл, обрабатывали раствором КCNS + HNO3 для получения окрашенных комплексов и фотометрически определяли концентрацию железа (III) в
36
элюате, моль/л. Рассчитать полную динамическую обменную емкость катионита (ПДОЕ) по железу.
№ порции |
1 |
2 |
3 |
4 |
5 |
6 |
С(Fe3+), М |
0 |
0 |
0,004 |
0,03 |
0,05 |
0,05 |
Решение. Рассчитаем количество ммоль-эквивалентов Fe3+,
поступившего в колонку:
no(1/3 Fe3+) = С(1/3 Fe3+) ∙ Vр-ра = 3 ∙ 0,05 ∙ 0,150 ∙ 1000 = 22,5 (ммоль-экв).
Чтобы найти суммарное количество ммоль-эквивалентов Fe3+ на выходе из колонки, рассчитаем количество ммоль-эквивалентов Fe3+ в каждой порции элюата.
Впорциях №1 и №2 Fe3+ отсутствует.
Впорции №3:
n(1/3 Fe3+) = 3 ∙ 0,004 ∙ 0,025 ∙ 1000 = 0,3 (ммоль-экв).
В порции №4:
n(1/3 Fe3+) = 3 ∙ 0,03 ∙ 0,025 ∙ 1000 = 2,25 (ммоль-экв).
В порциях №5 и №6 содержится одинаковое количество Fe3+: n(1/3 Fe3+) = 3 ∙ 0,05 ∙ 0,025 ∙ 1000 = 3,75 ммоль-экв).
Суммируем:
∑n(1/3 Fe3+) = 0,3 + 2,25 + 2 ∙ 3,75 = 10,05 (ммоль-экв).
Рассчитаем количество ммоль-эквивалентов Fe3+, поглощенного
катионитом, по разности поступившего и вышедшего количества: nпогл(1/3 Fe3+) = no(1/3 Fe3+) – ∑n(1/3 Fe3+) = 22,5 – 10,05 =
12,45 (ммоль-экв). Тогда:
ПДОЕ = nпогл(1/3 Fe3+) / mкат = 12,45 / 4 = 3,11 ммоль-экв/г. Ответ: ПДОЕ = 3,11 ммоль-экв/г.
7.2. Хроматография
Пример 29 поможет Вам при решении задач № 204 – 206. Рассчитать массовую долю (%) компонентов смеси по данным,
полученным методом газо-жидкостной хроматографии (табл.10): Таблица 10
Вещество |
S, мм2 |
k |
37

бензол |
35,6 |
0,78 |
гексан |
24,8 |
0,86 |
этанол |
50,2 |
1,40 |
о-ксилол |
10,3 |
0,84 |
Решение. Для расчетов будем использовать метод внутренней нормализации. Поэтому расчет результатов будем проводить по формуле
i = ki Si 100(kiSi)
где ki – относительный поправочный коэффициент i-го компонента, рассчитанный по формуле; Si и Sст. – площади пиков i-го компонента.
Рассчитаем величину Σ(ki∙Si)
Σ(ki∙Si) =0,78∙35,6 + 0,86∙24,5 + 1,40∙50,2 + 0,84∙10,3 = 128,028.
Рассчитаем содержание компонентов в смеси:
бензола = 0,78∙35,6∙100/128,028 = 21,7 %;гексана = 0,86∙24,8∙100/128,028 = 16,7 %;этанола = 1,40∙50,2∙100/128,028 = 54,9 %;о-ксилола = 0,84∙10,3∙100/128,028 = 6,7 %.
Пример 30 поможет Вам при решении задач № 207 – 209.
Фракцию, полученную после выделения о-ксилола из продуктов каталитического риформинга, проанализировали методом газожидкостной хроматографии на содержание этилбензола с применением толуола в качестве внутреннего стандарта (табл.11):
Таблица 11
|
Взято |
Sэтилбензола, |
k |
Sтолуола, |
k |
||
m(фракции), г |
m(толуола), г |
мм2 |
мм2 |
||||
|
|
||||||
18,54 |
|
1,98 |
108 |
0,82 |
95 |
0,79 |
|
Рассчитать массовую долю (%) этилбензола во фракции. Решение. При анализе использовался метод внутреннего
стандарта. Поэтому расчеты проводим с использованием формулы данного метода
i = ki Si r 100.
kстSст
38
где ki – относительный поправочный коэффициент i-го компонента; Si и Sст. – площади пиков i-го компонента и внутреннего стандарта; r – отношение массы внутреннего стандарта к массе анализируемой смеси (без стандарта).
Рассчитаем величину r:
r = mст./mсмеси = 1,98 / 18,54 = 0,1068
Вычислим массовую долю этилбензола во фракции
i = |
ki |
Si r 100 |
. = |
0,82 |
108 0,1068 100 |
= 12,6 %. |
|
kстSст |
|
|
|||
|
|
|
|
0,79 95 |
||
Пример 31 поможет Вам при решении задач № 210 – 212.
Пример α-метилстирол в фенольной фракции производства ацетона и фенола кумольным методом определяли методом газовой хроматографии, используя стирол в качестве внутреннего стандарта, и получили следующие данные для градуировочного графика (табл.12)
|
|
|
|
Таблица 12 |
|
ω α-метилстирола |
1,0 |
2,0 |
3,0 |
4,0 |
|
Sα-метилстирола/ |
0,88 |
1,10 |
1,32 |
1,56 |
|
Sстирола |
|||||
|
|
|
|
Рассчитать массовую долю (%) α-метилстирола в исследуемом образце,еслиоснованиепика α-метилстироларавно24мма высота– 80мм, основание пика стирола – 20мм а высота – 68мм. При решении принять k обоихвеществравным1.
Решение. Рассчитаем площади пиков α-метилстирола и стирола как площадь треугольника
Sα-метилстирола = ½ ∙24∙80 = 960 мм2; Sстирола= ½ ∙20∙68 = 680 мм2.
Рассчитаем отношение Sα-метилстирола/Sстирола
Sα-метилстирола/ Sстирола = 960 / 680 = 1,41.
Построим градуировочный график (Рис.17):
39

S -метилстирола/ S стирола |
|
|
|
|
|
|
|
|
|
1,6 |
|
|
|
|
|
|
|
|
|
1,4 |
|
|
|
|
|
|
|
|
|
1,2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
0,8 |
1,5 |
2 |
2,5 |
3 |
|
3,5 |
4 |
|
|
1 |
|
|
|
||||||
|
|
|
|
|
метилстирола |
|
|
||
Рис.17. Зависимость Sα-метилстирола/ S стирола |
от |
массовой |
доли |
α- |
|||||
метилстирола. |
|
|
|
|
|
|
|
|
|
По градуировочному графику определяем массовую долю α- метилстирола ω α-метилстирола = 3,4 %.
Пример 32 поможет Вам при решении задач № 213 – 217.
Пример Для хроматографического определения меди на бумаге, импрегнированной диэтилдитиокарбаминатом свинца методом осадочной хроматографии приготовили три стандартных раствора. Для этого навеску CuSO4 ∙5H2O массой 0,6254г растворили в колбе объемом 100мл. Затем из этой колбы взяли 10,0, 15,0 и 20,0мл раствора и разбавили в колбах на 50мл. Исследуемый раствор также разбавили в колбе на 50,0мл. Определить содержание меди в исследуемом растворе (г), если высота пиков окрашенных зон для стандартных растворов равны 27,8, 40,2 и 65,1 мм,адля исследуемого раствора52,1 мм.
Решение. Рассчитаем концентрацию меди в исходном
стандартном растворе |
|
|
||
Сисх = |
mнав MCu |
= |
0,6254 63,56 |
= 0,001581 г/мл. |
|
|
|||
|
MCuSO4 V |
251,284 100 |
||
Рассчитаем концентрацию меди в стандартных растворах
С1 = 0,001581 ∙10,0 / 50,0 = 0.0003162 г/мл;
40
