
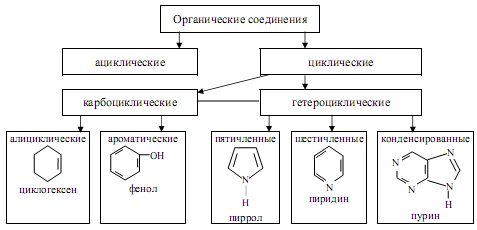
- •1.Классификация и номенклатура органических соединений
- •2)Реакции окисления
- •3)Реакция восстановлениия
- •7.1) Качаственная реакция!!!концевая 3-ая связь
- •6.Галогенпроизводные ув
- •8.Заместители бензольного кольца и их влияние на направление и скорость реакции Se:
- •9.Кислородсодержащие соединения. Спирты
- •9.1Ненасыщенные спирты:
- •10.Многоатомные спирты: гликоли
- •11.Ароматические спирты и фенолы
- •12 Альдегиды и кетоны
- •13.Карбоновые кислоты.
- •14.Углеводы
- •Моносахариды
- •15.Нитросоединения
- •Способы получения нитросоединений
- •Химические свойства
- •16. Основные химические свойства аминов.
1.Классификация и номенклатура органических соединений
Органические соединения – углеводороды и их производные.
Существует нормальный и разветвленный скелет.
Изомеры – имеют одинаковый качественный и количественный состав, но разное строение.
Теория строения орг. Соединений Бутлерова:
Ввел понятие «строения»- это последовательность соединения атомов в молекуле:
 -
1)СН3-Н2-ОН 2)СН3-О-СН3
-
1)СН3-Н2-ОН 2)СН3-О-СН3Химические св-ва зависят не только от кач-нного и колич-нного состава, но и от строения в-ва.
Вв-ва, с одинаковым кач. и кол. составом, но разным строением называются – изомерами
Хим-ое поведение атомов зависит от того, с какими атомами они соединены и находятся в окружении.
Изучая хим. св-ва вещ-ва , мы можем сделать вывод о его строении
а)углерод, связанный с 1-м атомом углерода, называется 1-ным.
б) углерод, связанный с 2-мя атомами углерода, называется 2-ным.
в)углерод, связанный с 3-мя атомами углерода, называется 3-ным.
г)углерод, связанный с 4-мя атомами углерода, называется 4-ным.
1.1Алканы
–ан
 – есть
предельные насыщенные углеводороды.
– есть
предельные насыщенные углеводороды.
Получение алканов
(ЛАБОРАТОРН.)
2Na + R-HAL(р-я вюрца, при присоединении одинакового куска-будет симм.)
H3C-CH2-Br
+ Br-CH2-CH3
 H3C-CH2-CH2-CH3
+ 2NaBr
H3C-CH2-CH2-CH3
+ 2NaBr
Алкен/алкин + Водород в присутствии кат.(H2/Ni,Pt,Pd):
CH3-CH=CH-CH3
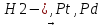 CH3-CH2-CH2-CH3
CH3-CH2-CH2-CH3
Производные алканов(R-Hal)+HI(Иодистоводородная к-та)= алкан+H-Hal+I2:
(CH3)CH(CH3)-Br+2HI = CH3-CH2-CH3+HBr+I2
Соль карбоновой к-ты + щелочь = алкан+карбонат Na:
R-(O=)CONa+NaOH→RH+Na2CO3
Соль карбоновой к-ты и электролиз(синтез Кольбе) = R-R + H2+2CO2+NaOH:
CH3-CH2-(CH3)CH-COONa =(Электр.)=
CH3-CH2-(CH3)-C-C(CH3)-CH2-CH3+2CO2+H2+NAOH
Декарбоксилирование солей карбоновых к-т:
CH3-CH2-COONA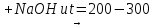 CH3-CH3+
Na2CO3
CH3-CH3+
Na2CO3
(ПРОМЫШЛЕННЫЕ)
Гидрогенизация угля:
C+H2
Метод Фишера-Тромпа
CO2+3H2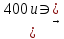 СН4
СН4
CO+3H2(синтез
газ) CH4+H2O
CH4+H2O
Крекинг УВ:
CH3(CH2)3-CH3
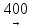 CH3-CH2-CH3
+ CH2=CH2
CH3-CH2-CH3
+ CH2=CH2
Физические свойства:
1)С1-С4 – газы 2)С5-С15-жидкости 3)С16-и выше – тв.в-ва без запаха
4)↑С = ↑Ткип. И Тпл.
Химические свойства:
1)р-я галогенирования(Cl/Br):
-Бромирование:
CH3-CH(CH3)-CH2-CH3+Br CH2-(CH3)C(Br)-CH2-CH3
CH2-(CH3)C(Br)-CH2-CH3
-Хлорирование:
а)CH4+
Cl2
 CH3Cl+HCl
CH3Cl+HCl
б)CH3-CH2-CH3+Cl2
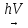 1)CH3-CHCl-CH3+HCl
1)CH3-CHCl-CH3+HCl
2)CH3-CH2-CH2Cl +HCl
2)нитрование по Коновалову:
СH3-(CH3)CH-CH3 + HNO3(p) =140=> CH3-(CH3)C(NO2)-CH3+H2O
2метилпропан 2метил2нитропропан
3)сульфохлорирования :
CH3-CH2-CH2-CH3+SO2+Cl2
 CH2-CH2-CH(SO2Cl)-CH3 +HC
CH2-CH2-CH(SO2Cl)-CH3 +HC
Вторбутилсульфохлорид
4)сульфирование (по первичному или втор. атому С):
CH3-CH2-CH2-CH3+
H2SO4
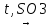 CH3-CH2-CH2-CH2(SO3H)+H2O
CH3-CH2-CH2-CH2(SO3H)+H2O
Бутан-1-сульфоновая к-та
5)Крекинг УВ:
CH3(CH2)3-CH3
 CH3-CH2-CH3
+ CH2=CH2
CH3-CH2-CH3
+ CH2=CH2
6)окисление алканов – горение:
Полное:CH4+O2 CO2+
2H2O+Q
2C4H10+14O2=8CO2+10H2O+Q
CO2+
2H2O+Q
2C4H10+14O2=8CO2+10H2O+Q
Неполное: Kat-Mn,Co CH4+3O2=2CO+4H2O+Q
2CH3-(CH2)2-CH3+5O2 4CH3-COOH+2H2O
4CH3-COOH+2H2O
2.Алкены
–
это УВ, которые содержат двойную
углерод-углеродную связь.
 ,
характеризуются
высокой реакционной способностью.
,
характеризуются
высокой реакционной способностью.
Входят в состав феромонов, эфирных масел, в виде красящих в-в в моркови и помидорах.
Радикалы(алкенилы):
1)Н2С=СН- ВИНИЛ
2)СН2-СН=СН- ПРОПЕНИЛ
3)СН2=СН-СН2- АЛЛИЛ
Характерна пространственная цис-транс-изомерия.
Получение алкенов
(ЛАБОРАТОРН.):
Дегидрогалогенирование(правило Зайцева)
Водород отщипляется от того атома С, у которого меньше всего Н.
CH3-(Br)C(CH3)-CH2-CH2-CH3

1бром-3метилпентан
CH3- (CH3)C=CH-CH2-CH3+KBr+H2O – 2метилпент-2-ен
Дегидрогалогенирование винильных дигалогеналканов.
CH3-(CH3)C(Br)-CH(Br)-CH2-CH3

2,3-дибром2метилпентан
CH3- (CH3)C=CH-CH2-CH3+ZnBr2 – 2метилпент-2-ен
Дегидратация спиртов (по Зайцеву):
CH3-CH(OH)-(H)CH-CH3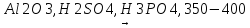 CH3-HC=CH-CH3
CH3-HC=CH-CH3
Бутан2-ол бут-2ен
+ H2O
Частичное восстановление алкадиенов и алкинов:
CH2=CH-CH=CH2
 CH3-CH2-CH=CH2
CH3-CH2-CH=CH2
(ПРОМЫШЛЕННЫЕ)
Крекинг и пиролиз из нефти:
R-CH2-CH2-R
 R-CH3+ H2C=CH-R
R-CH3+ H2C=CH-R
Дегидрирование низших алканов(отщ. Н2)
CH3-CH2-CH2-CH3
 CH3-CH=CH-CH3+
CH3-CH=CH-CH3+
CH2=CH-CH2-CH3
Физические свойства:
1)С1-С4 – газы 2)С5-С17-жидкости 3)С18-и выше – тв.в-ва 4)↑С = Ткип. И Тпл. ниже чем у алканов. Обрадают сильным запахом , плохо раств. В Н2О, хорошо в орг. Растворителях.
Химические свойства:
Реакции присоединения электрофилов:
а) кислот:
HBr, HCl, HI, H2SO4
кислот:
HBr, HCl, HI, H2SO4
b)
 :Br,
Cl
:Br,
Cl
Присоединения HBr:
При присоединении галогенводорода к несим алкенам Н присоединяется к тому =, у кого Н больше.
CH2=CH-CH2-CH3+HBr,t=> CH3-CH(Br)-CH2-CH2
Присоединение Br2(качественная реакция на кратную связь):
CH2=CH-CH2-CH3 CH3-CH2-CH(Br)-CH2(Br)
CH3-CH2-CH(Br)-CH2(Br)
Присоединение H2SO4:
CH2=CH-CH3+ →OSO3H
→OSO3H
 CH3-CH(OSO3H)-CH3
– изопропилсульфат
CH3-CH(OSO3H)-CH3
– изопропилсульфат
Присоединение Н2О(гидротация):
CH3-(CH3)C=CH-CH3
 CH3-(CH3)C(OH)-CH2-CH3
CH3-(CH3)C(OH)-CH2-CH3
Р-и присоединения Ar – против правила Марковникова.
CH3-CH=CH2+HBr CH3-CH2-CH2(Br)
CH3-CH2-CH2(Br)
Мягкое окисление (качественная реакция на кратную связь). Вагнера
CH3-(CH3)C=CH2+KMnO4

CH3-(CH3)C(OH)-CH2(OH)+MnO2↓ - 2метилпропан -1,2-диол
Жесткое окисление – озонолиз:
CH3-(CH3)C=CH2-CH3 +O2

CH3-C(=O)-CH3+H3C-(H-)C(=O)
CH3-(CH3)C≠CH2-CH3 +KMnO4
 CH3-C(=O)-CH3 +
CH3-C(=O)-CH3 +
H3C-(HO-)C(=O)
Алкен + Водород в присутствии кат.(H2/Ni,Pt,Pd)
CH3-CH=CH-CH3
 CH3-CH2-CH2-CH3
CH3-CH2-CH2-CH3
3.Алкадиены
–
это ненасыщенные углеводороды, которые
соержат в молекуле 2-е 2-ные углерод-углеродные
связи.

Алкадиены с сопряженными двойными связями.
CH2=CH-CH=CH2 бутадиен-1,3
CH2=C(CH3)-CH=CH2 изоприл
Получение алкадиенов
Дегидрирование бутана:
CH3-CH2-CH2-CH3 CH2=CH-CH2-CH3
CH2=CH-CH2-CH3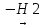
→ CH2=CH-CH=CH2
Дегидрирование изопентана:
CH3-CH(СН3)-CH2-CH3 CH2=C(СН3)-CH2-CH3
CH2=C(СН3)-CH2-CH3
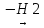 CH2=C(СН3)-CH=CH2
– метил бутадиен-1,3
CH2=C(СН3)-CH=CH2
– метил бутадиен-1,3
Получение изоприла
CH3-е(=О)-CH3
+Н-С≡С-Н
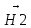 CH3-(НО-)е(СН3)≡СН
CH3-(НО-)е(СН3)≡СН
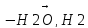
→ CH2=C(CH3)-CH=CH2 метил бутадиен-1,3
Синтез Лебедева
CH3-CH2-ОН
 CH3-(H)C(=O)
CH3-(H)C(=O)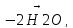 CH2=CH-CH=CH2
CH2=CH-CH=CH2
Лабораторные способы:
Дегидрирование дигалагеналканов
H2C(Br)-CH(CH3)-CH2-CH(Br)-CH3
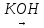
CH2=C(CH3)-CH=CH-CH3 метил пентадиен-1,3
Дегидратация спиртов:
H2C(Н)-CH(ОН)-CH(ОН)-CH2(Н) CH2=CH-CH=CH2
CH2=CH-CH=CH2
Химические свойства:
1)Реакции присоединения для алкадиенов с сопряженными связями могут протекать по двум направлениям - 1,2- и 1,4-присоединение.
1,2-Присоединение - это присоединение молекулы реагента по одной из двух двойных связей; 1,4 - это присоединение молекулы реагента по краям сопряженной системы с переносом двойной связи в ее центр. Причем присоединение несимметричных реагентов происходит в соответствии с правилом Марковникова.
Реализация того или иного направления присоединения зависит от условий проведения реакции. При пониженных температурах в среде неполярных растворителей преимущественно образуются продукты 1,2-присоединения. При повышенных температурах в среде полярных растворителей - продукты 1,4-присоединения.

