
- •18. Постоянный электрический ток.
- •19. Электрические токи в вакууме.
- •17. Вещество в электрическом поле.
- •16. Потенциал.
- •4. Диэлектрическая проницаемость среды.
- •15. Электростатика.
- •3.Электрическое поле и его напряженность.
- •9.Молекулярно – кинетические явления.
- •4.Скорость поступательного движения молекул газов.
- •10.Молекулярные столкновения, проникновения.
- •11. Явления передачи.
- •12. Основы термодинамики.
- •4.Работа , совершаемая при изменении объёма газа.
- •13. Адиабатический процесс.
- •1. Цикл Карно. Цикл Карно состоит из четырёх стадий:
- •14. Реальные газа, жидкости и твёрдые тела.
9.Молекулярно – кинетические явления.
1.Опытные
законы идеального газа. Идеальным
газом называется такой воображаемый
газ, в котором, не учитывается собственный
объем молекул, а взаимодействие между
ними осуществляется в процессе абсолютно
упругих столкновений. Опытным путём
было открыто 3 закона идеальных газов.
Закон
Бойля-Мариотта:
для данной массы m
газа при постоянной температуре Т
произведение давления газа р на его V
есть величина постоянная: рV=const
при T
и m=const.
Закон
Гей-Люссака:
объем данной массы газа при постоянном
давлении изменяется линейно с
температурой:
 при
при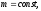 гдеα=1/273
гдеα=1/273
 -коэффициент
объемного расширения газа:t-
температура по шкале Цельсия;
-коэффициент
объемного расширения газа:t-
температура по шкале Цельсия;
 -объем
газа приt=0
-объем
газа приt=0 С.
С.
Закон
Шарля: давление
данной массы газа при постоянном объеме
изменяется линейно с температурой:
 приV
и m=const,
(
приV
и m=const,
( -давление
приt=0
-давление
приt=0 С.).Закон Дальтона:
давление смеси идеальных газов равно
сумме парциальных давлений входящих
в нее газов,
С.).Закон Дальтона:
давление смеси идеальных газов равно
сумме парциальных давлений входящих
в нее газов,
 .
.
2.Уравнение
Клапейрона-Менделеева. В
1834 г. Клапейрон путем объединения
законов Бойля-Мариотта и Гей-Люссака
установил соотношение в которое
одновременно входят все три параметра
(p,
V,
T)
состояние газа: pV/T=const.
В 1874 г. Менделеев получил наиболее общее
выражение для уравнения состояния
идеального газа, связывающее собой
параметры p,
V,
T,
массу газа и молярную массу М:
 -
уравнение Клапейрона-Менделеева,R=8.32
Дж/К*моль- универсальная молярная
газовая постоянная, т.е. она одинакова
для всех газов. m/M=v-число
молей.
-
уравнение Клапейрона-Менделеева,R=8.32
Дж/К*моль- универсальная молярная
газовая постоянная, т.е. она одинакова
для всех газов. m/M=v-число
молей.
3.Основное уравнение молекулярно-кинетической теории газов. Устанавливает зависимость между параметрами p,V газа и кинетической энергией поступательного движения его молекул.
 или
или
 ,
гдеε
,
гдеε ,
средняя кинетическая энергия
поступательного движения молекулы
газа; Е=N*ε-средняя
энергия газа.
,
средняя кинетическая энергия
поступательного движения молекулы
газа; Е=N*ε-средняя
энергия газа.
4.Скорость поступательного движения молекул газов.
5. Барометрическая формула. Барометрич. формула определяет зависимость от высоты h плотности n или давления p идеального изотермического газа, находящегося в гидростатич. равновесии в однородном поле силы тяжести. Высота h отсчитывается в напр., противоположном ускорению силы тяжести g. Б.ф. явл. частным случаем Больцмана распределения, обычно используется для описания атмосфер космич. тел (планет, звёзд). Для плотности Б.ф. можно записать в виде:
|
|
|
для
давления:
|
|
|
где n0 и p0 - плотность п давление на нек-ром начальном уровне h0, m - масса частицы газа.
 -барометрическая
формула.
-барометрическая
формула.
10.Молекулярные столкновения, проникновения.
1.
Среднее число столкновений молекулы
и средняя длина свободного пробега.
Молекулы
газа находятся в состоянии хаотичного
движения непрерывно сталкиваются друг
с другом. Путь проходимый между двумя
последовательными столкновениями
назыв. Длинной свободного пробега. Так
как мы имеем дело с огромным числом
молекул , то нужно говорить о средней
длине свободного пробега
 молекул.
Миним. Расстояние на которое сближаются
при столкновении центры двух молекул,
назыв. Эффективным диаметромd
молекулы. Так как за 1 с. Молекула проходит
путь, равный ˂v˃
и если ˂z˃-среднее
число столкновений равно 1/ ˂z˃,
поэтому
молекул.
Миним. Расстояние на которое сближаются
при столкновении центры двух молекул,
назыв. Эффективным диаметромd
молекулы. Так как за 1 с. Молекула проходит
путь, равный ˂v˃
и если ˂z˃-среднее
число столкновений равно 1/ ˂z˃,
поэтому
 =
˂v˃
=
˂v˃ =
˂v˃/
˂z˃.
В термодинамических неравновесных
системах возникают особые необратимые
процессы, назыв. Явлениями переносса,
в результате которых происходит
перераспределение массы, энергии и
количества движения в объеме этой
си-мы.
=
˂v˃/
˂z˃.
В термодинамических неравновесных
системах возникают особые необратимые
процессы, назыв. Явлениями переносса,
в результате которых происходит
перераспределение массы, энергии и
количества движения в объеме этой
си-мы.
