
- •1. Организация лабораторных занятий на кафедре аналитической химии
- •1.1. Требования безопасности при выполнении лабораторных работ
- •1.2. Первая помощь при несчастных случаях
- •1.3. Организация лабораторных занятий
- •2. Гравиметрические методы анализа
- •2.1. Основные положения
- •2.2. Техника выполнения основных операций
- •2.3. Практические работы
- •2.4. Типовые расчеты в гравиметрии
- •2.4.1. Примеры решения типовых задач.
- •2.4.2.Индивидуальные задания для самоподготовки.
- •2.5. План коллоквиума «Гравиметрические методы
- •Титриметрические методы анализа
- •3.1. Основные положения
- •3.2. Техника выполнения основных операций
- •3.2.1. Мерная химическая посуда.
- •3.2.2. Приготовление стандартных растворов.
- •3.2.3. Взятие точной навески.
- •3.2.4. Титрование.
- •4. Метод кислотно-основного титрования (метод нейтрализации)
- •4.1. Основные положения
- •4.2. Практические работы Лабораторная работа № 2 Приготовление и стандартизация рабочего раствора hCl
- •Лабораторная работа № 3 Приготовление и стандартизация рабочего раствора NaOh
- •0,1 Н. Раствором NaOh
- •Лабораторная работа № 4 Определение содержания к2со3
- •0,1 Н. Раствором нСl
- •Лабораторная работа № 5 Определение содержания h3pо4
- •0,1 Н. Раствором NaOh
- •Лабораторная работа № 6 Определение содержания солей аммония методом обратного титрования
- •4.3. Типовые расчеты в кислотно-основном титровании
- •4.3.1. Примеры решения типовых задач.
- •4.3.2. Индивидуальные задания для самоподготовки.
- •4.4. План коллоквиума «Титриметрические методы анализа. Метод кислотно-основного титрования»
- •5. Окислительно-восстановительное титрование
- •5.1. Основные положения
- •5.2. Перманганатометрия
- •5.3. Иодометрия
- •5.4. Практические работы Лабораторная работа № 7 Стандартизация рабочего раствора перманганата калия
- •Лабораторная работа № 8 Определение содержания железа (II)
- •Лабораторная работа № 9 Стандартизация рабочего раствора тиосульфата натрия
- •Лабораторная работа № 10 Определение содержания меди (II)
- •5.5. Индивидуальные задания для самоподготовки
- •5.5.1. Перманганатометрия.
- •5.5.2. Иодометрия.
- •6. Комплексонометрическое титрование
- •6.1. Основные положения
- •6.2. Практические работы Лабораторная работа № 11 Стандартизация раствора комплексона III
- •Лабораторная работа № 12 Определение общей жесткости воды
- •Лабораторная работа № 13 Определение кальция и магния при совместном присутствии
- •6.3. Индивидуальные задания для самоподготовки по методу комплексонометрического титрования
- •6.4. План коллоквиума «Метод окислительно-восстановительного титрования. Комплексонометрия»
- •7. Примеры составления отчетов
- •7.1. Гравиметричекие методы анализа
- •7.2. Титриметрические методы анализа
7.2. Титриметрические методы анализа
8. 10. 2007
Лабораторная работа № 2
Приготовление и стандартизация рабочего раствора
азотной кислоты
Цель работы– приготовить 0,1 н. растворHNO3путем разбавления концентрированного раствора и установить его точную концентрацию.
Сущность работы.Точную концентрацию раствораHNO3устанавливают по результатам титрования стандартаNa2CO3. При титровании с метиловым оранжевым протекает реакция
Na2CO3 + 2HNO3 → CO2↑ + H2O + 2NaNO3
Фактор эквивалентности
Na2CO3равен![]() .
.
Приборы и посуда: технические и аналитические весы; мерные цилиндры (20 и 50 мл); бюретка, пипетка Мора (10,0 мл); мерная колба (100,0 мл); конические колбы для титрования; денсиметр.
Реактивы: концентрированный растворHNO3;Na2CO3(х. ч.); индикатор – метиловый оранжевый.
Экспериментальные данные.
Приготовление рабочего раствора HNO3.
С помощью денсиметра измерили плотность концентрированного раствора HNO3: ρ = 1,095 г/см3. По данным справочника, этой плотности соответствует концентрация 2, 913 моль/л.
Рассчитаем объем концентрированной HNO3, необходимый для приготовления 500 мл 0,1 н.HNO3:
![]() .
.
В цилиндр объемом 500 мл прилили немного дистиллированной воды (≈100 мл), внесли рассчитанный объем концентрированной HNO3(17 мл отмерили цилиндром) и довели объем раствора до 500 мл дистиллированной водой.
Стандартизация раствора HNO3.
Расчет навески Na2CO3:
m(Na2CO3)=C(![]() Na2CO3)·V(Na2CO3)·M(
Na2CO3)·V(Na2CO3)·M(![]() Na2CO3);
Na2CO3);
m = 0,1 · 0,1 · 52,995 = 0,5300 г.
Результаты взвешивания.
Масса пустого тигля на технических весах m = 24,5 г.
Масса тигля с Na2CO3на технических весахm = 25,1 г.
Масса тигля с Na2CO3на аналитических весахm = 25,1052 г.
Навеска перенесена в мерную колбу вместимостью 100,0 мл.
Масса тигля с остатками Na2CO3на аналитических весахm = 24,5648 г.
Масса взятой навески Na2CO3m = 0,5404 г.
Расчет молярной концентрации эквивалента раствора Na2CO3:
![]() моль/л.
моль/л.
Результаты титрования.
V1= 10,3 мл;V2= 10,2 мл;V3= 10,3 мл.
Средний объем раствора HNO3:
![]() мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора HNO3:
![]() моль/л.
моль/л.
15. 10. 2007
Лабораторная работа № 4
Определение Na2CO3в растворе
Цель работы– определить массуNa2CO3в растворе.
Сущность работы.На кривой титрованияNa2CO3наблюдается два скачка. Первый скачок соответствует уравнению
Na2СО3+ НNO3=NaНСО3+NaNO3
и отвечает переходу окраски фенолфталеина. Фактор эквивалентности Na2СО3в этой реакции равен 1.
Второй скачок на кривой титрования Na2СО3раствором НNO3соответствует уравнению
NaHСО3+ НNO3= Н2O+ СО2+NaNO3
и отвечает переходу
окраски метилового оранжевого. Фактор
эквивалентности Na2СО3в этом случае равен![]() .
.
Реактивы: стандартный раствор НNO3, индикаторы – фенолфталеин и метиловый оранжевый.
Посуда: мерная колба (100,0 мл); пипетка Мора (10,0 мл); бюретка; конические колбы для титрования.
Экспериментальные данные.
1. Результаты титрования с фенолфталеином:
V1= 8,3 мл;V2= 8,2 мл;V3= 8,3 мл.
Средний объем раствора HNO3, пошедший на титрование пробы с фенолфталеином:
![]() мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора Na2СО3 по результатам титрования с фенолфталеином:
![]() моль/л.
моль/л.
Расчет массы Na2CO3:
m(Na2CO3)=0,08214·0,1·105,989·1=0,8706 г.
2. Результаты титрования с метиловым оранжевым:
V1= 16,6 мл;V2= 16,6 мл;V3= 16,5 мл.
Средний объем раствора HNO3, пошедший на титрование пробы с с метиловым оранжевым:
![]() мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора Na2СО3 по результатам титрования с метиловым оранжевым :
![]() моль/л.
моль/л.
Расчет массы Na2СО3:
m(Na2CO3)=0,1646·0,1·105,989·![]() =0,8723 г.
=0,8723 г.
Истинный результат:
m(Na2CO3)=0,8716 г.
Погрешность определений:
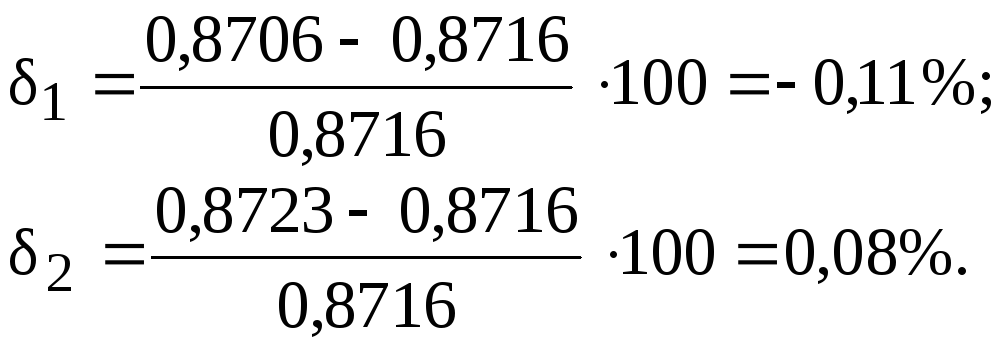
СОДЕРЖАНИЕ
|
Предисловие |
3 |
|
1. Организация лабораторных занятий на кафедре аналитической химии |
4 |
|
1.1. Требования безопасности при выполнении лабораторных работ |
4 |
|
1.2. Первая помощь при несчастных случаях |
5 |
|
1.3. Организация лабораторных занятий |
5 |
|
2. Гравиметрические методы анализа |
7 |
|
2.1. Основные положения |
7 |
|
2.2. Техника выполнения основных операций |
9 |
|
2.3. Практические работы |
14 |
|
2.4. Типовые расчеты в гравиметрии |
16 |
|
2.4.1. Примеры решения типовых задач |
16 |
|
2.4.2. Индивидуальные задания для самоподготовки |
20 |
|
2.5. План коллоквиума «Гравиметрические методы анализа» |
24 |
|
3. Титриметрические методы анализа |
25 |
|
3.1. Основные положения |
25 |
|
3.2. Техника выполнения основных операций |
28 |
|
3.2.1. Мерная химическая посуда |
28 |
|
3.2.2. Приготовление стандартных растворов |
31 |
|
3.2.3. Взятие точной навески |
33 |
|
3.2.4. Титрование |
33 |
|
4. Метод кислотно-основного титрования (метод нейтрализации |
35 |
|
4.1. Основные положения |
35 |
|
4.2. Практические работы |
35 |
|
4.3. Типовые расчеты в кислотно-основном титровании |
46 |
|
4.3.1. Примеры решения типовых задач |
46 |
|
4.3.2. Индивидуальные задания для самоподготовки |
53 |
|
4.4. План коллоквиума «Титриметрические методы анализа. Метод кислотно-основного титрования» |
61 |
|
5. Окислительно-восстановительное титрование |
62 |
|
5.1. Основные положения |
62 |
|
5.2. Перманганатометрия |
62 |
|
5.3. Иодометрия |
63 |
|
5.4. Практические работы |
64 |
|
5.5. Индивидуальные задания для самоподготовки по методам окислительно-восстановительного титрования |
69 |
|
5.5.1. Перманганатометрия |
69 |
|
5.5.2. Иодометрия |
71 |
|
6. Комплексонометрическое титрование |
73 |
|
6.1. Основные положения |
73 |
|
6.2. Практические работы |
74 |
|
6.3. Индивидуальные задания для самоподготовки по методу комплексонометрического титрования |
77 |
|
6.4. План коллоквиума «Метод окислительно-восстановительного титрования. Комплексонометрия» |
78 |
|
7. Примеры составления отчетов о выполненных лабораторных работах |
80 |
|
7.1. Гравиметрические методы анализа |
80 |
|
7.2. Титриметрические методы анализа |
81 |
|
Содержание |
85 |
Учебное издание
ХИМИЧЕСКИЕ МЕТОДЫ
КОЛИЧЕСТВЕННОГО АНАЛИЗА
Учебно-методическое пособие
Редактор Р. М. Рябая
Подписано в печать
2007. Формат
60×84![]() .
.
Бумага офсетная. Гарнитура Таймс. Печать офсетная.
Усл. печ. л. 5,2. Уч.-изд. л. 5,4.
Тираж 200 экз. Заказ
Учреждение образования
«Белорусский государственный технологический университет»
220050. Минск, Свердлова, 13.
ЛП № 02330/0133255 от 30.04.2004.
Отпечатано в лаборатории полиграфии учреждения образования
«Белорусский государственный технологический университет»
220050. Минск, Свердлова, 13.
ЛП № 02330/0056739 от 22.01.2004.
